プレスリリース 膵臓がんの進行を抑制する新種の細胞を発見―がん細胞の周囲環境を変える新規治療法の開発に期待―
プレスリリース
名古屋大学
日本医療研究開発機構
名古屋大学大学院医学系研究科の 髙橋 雅英 教授、榎本 篤 准教授のグループは、藤城 光弘 教授、水谷 泰之 病院助教(筆頭著者)、島村 徹平 教授、北海道大学の 芳賀 永 教授、藤田医科大学の 廣岡 芳樹 教授、重井医学研究所の松山 誠 室長らとの共同研究で、膵臓がんにおけるがんを抑制する線維芽細胞の特異的マーカーMeflinを同定し、がんの周りに増生する線維芽細胞の性質の多様性ががんの促進や抑制に影響することを見出しました。また線維芽細胞の性質を人為的に改変することが新しい治療法になり得る可能性を示しました。
この研究成果は、2019年8月22日付け(日本時間22日午後10時30分)米国癌学会誌「Cancer Research」のオンライン版で掲載されます。
なお、この研究は、国立研究開発法人日本医療研究開発機構(AMED)革新的先端研究開発支援事業ユニットタイプ『メカノバイオロジー機構の解明による革新的医療機器及び医療技術の創出』研究開発領域における研究開発課題「がん―間質におけるメカノバイオロジー機構の解明」(研究開発代表者:芳賀永)、次世代がん医療創生研究事業(P-CREATE)における研究開発課題「がん関連線維芽細胞の多様性の機序解明とその改変にもとづく腫瘍免疫制制御法の開発」(研究開発代表者: 榎本篤)の支援のもと行われたものです。
ポイント
- 膵臓がんの間質(かんしつ;がん細胞を取り囲む周囲の領域)に増生し、がんの進行を抑制する機能を持つ新しい細胞(がん抑制性線維芽細胞)を発見しました。
- がん抑制性線維芽細胞の数や性質の変化が、膵臓がんの悪性度・分化度に影響を与えることを明らかにしました。
- がん抑制性線維芽細胞を人為的に増加させると膵臓がんの進行が抑制されることを、マウスを用いた実験で示しました。
- 膵臓がんの間質の線維芽細胞の性質を人為的に改変することが、新しい治療戦略になる可能性を明らかにしました。
背景
膵臓がんをはじめとする難治がんの特徴の一つは、がん細胞の量と比べて間質の量が非常に多く、その間質中に多くの線維芽細胞の増生を伴うことです(図1)。線維芽細胞は私達の身体のすべての臓器に存在し、それらの形や構造の維持に必須の細胞です。がんが発生すると、がん細胞から産生される様々な因子によって線維芽細胞が増えることが知られています。このような線維芽細胞はがん関連線維芽細胞(CAF: cancer-associated fibroblast)※1と呼ばれ、がんの悪性化と治療の抵抗性に関与することが多くの研究で示されています。例えば、CAFはコラーゲンなどの多くの細胞外基質※2を産生し、がんの間質を非常に硬くします。この結果、血管がその圧によって押しつぶされてしまい(虚脱)、抗がん剤の効率的な浸透を妨げることが明らかにされています。血管が押しつぶされることは、がん組織の低酸素状態も誘導し、さらに、がん細胞の悪性度を上昇させることも知られています。また、間質の硬度の上昇自体も、がん細胞の増殖や浸潤能(周囲組織にひろがる能力)を上昇させる因子の一つです。加えて、CAFは多くの増殖因子を産生し、これらはがん細胞に作用してその増殖や浸潤を促進する機能を有する他、抗腫瘍免疫応答※3を抑制します。このように、CAFは、がん細胞の悪性化を促進する機能を有しており、現在、多くの製薬企業がCAFを標的とした新規治療法の開発を目指しています。
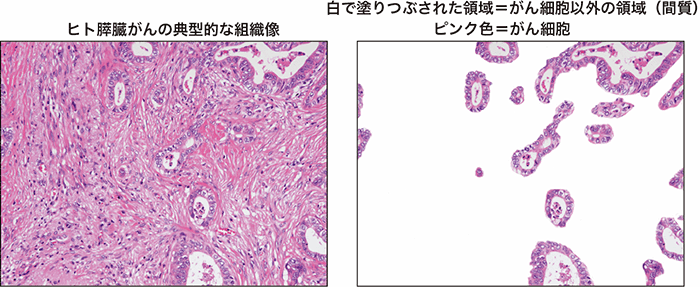
図1:膵臓がんの典型的な組織像
一方、5年ほど前、膵臓がん発症マウスモデルを用いた研究により、CAFはむしろがんを抑制する機能を有する細胞である、とそれまでの仮説とは相反する複数の研究結果が発表され、「CAFはがんの味方か敵か」という議論がなされるようになっていました。現在では、CAFは免疫細胞と同様に多様性に富む存在であり、がんにとって味方である「がん促進性CAF」とがんにとって敵である「がん抑制性CAF」の両者が存在する、という仮説が提唱されています[参考文献1]。しかしながら、後者の細胞の本態や特異的マーカー分子(その細胞の旗印となる遺伝子やタンパク質)は明らかではありませんでした。
研究成果
本研究チームは、以前に間葉系幹細胞※4のマーカーとして同定されたMeflin(メフリン)と呼ばれる膜型分子※5が[参考文献2]、膵臓がんのCAFの一部の種類に発現していることを明らかにしました(図2)。
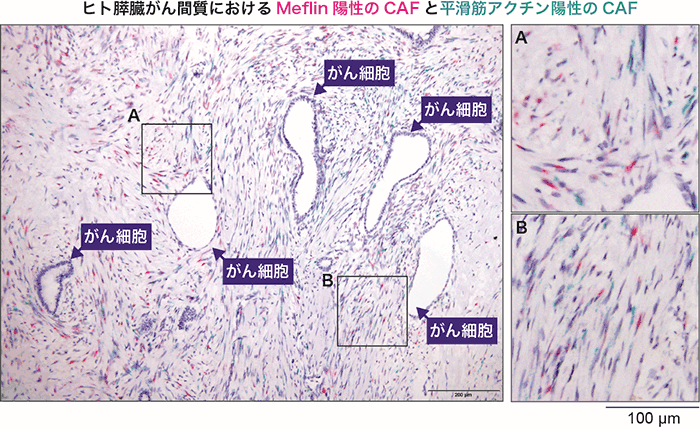
図2:膵臓がんにおけるMeflin(赤)と平滑筋アクチン(緑)の遺伝子発現の様子
Meflin単独陽性、平滑筋アクチン単独陽性、両者共陽性のCAFが混在して増生
Meflin陽性CAFの量の多さは膵臓がん患者の良好な術後の生存率に影響しますが、膵臓がん発症マウスモデルでMeflin遺伝子を欠失させると、がんの進行を促進することを見出しました。興味深いことに、Meflin陽性CAFを欠失したマウス個体では、より悪いタイプ(低分化型)の膵臓がんが高頻度に出現することも判明しました。また、膵臓がん細胞の移植実験でMeflin陽性CAFを除去すると腫瘍の増殖が盛んになり、ある特定の細胞の運命を追跡する実験(細胞系譜解析)では、がんの進行に伴って、Meflin陽性CAFが別のタイプのCAF(平滑筋アクチン※6陽性;α-SMA(smooth muscle actin)陽性)に分化することも見出しました。さらに、コラーゲンなどの細胞外基質を観察するための特殊な顕微鏡(第二高調波顕微鏡)を用いた検証から、Meflin分子の機能は間質の硬化やがん細胞の悪性化に結びつく細胞外基質の改築(リモデリング)の抑制であることも明らかとなりました。以上の結果から、Meflin陽性CAFは、これまで本態が不明であったがん抑制性CAFである可能性が示唆されました(図3)。
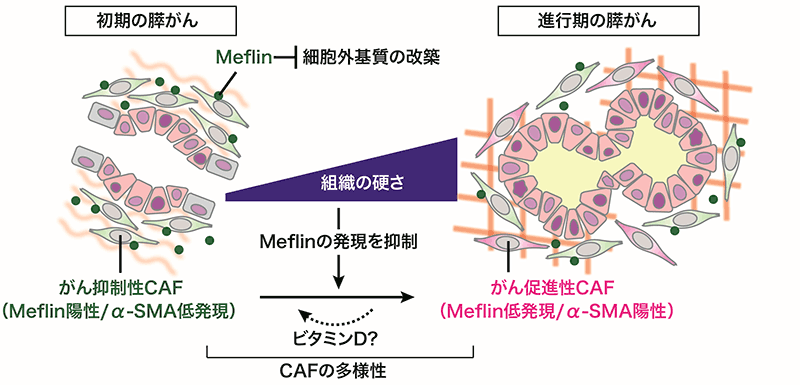
本研究の結果は、Meflin陽性CAFは膵臓がんの初期段階から間質に浸潤し(周囲組織へ広がり)、がんの進行に伴ってMeflinの発現が低下する可能性を示唆しています。細胞の運命を調べる解析(細胞系譜解析)により、Meflin陽性CAFはα-SMA陽性のCAFを生み出すことを見出しました。α-SMA陽性CAFは、がん促進性CAFであるとする研究成果が多く報告されていますが、一方で背反する報告もみられ、いまのところ結論に至っていません。また本研究チームが別に発表した最近の研究では、線維芽細胞におけるMeflinの発現は、環境(基質)の硬さ、TGF-β(transforming growth factor β)シグナル※7、虚血、加齢、細胞の継代などの因子により、顕著に低下あるいは消失することを報告しています[参考文献3]。このことは、がんの進行に伴ってCAFにおけるMeflinの発現が低下し、CAFががんの進行を促す細胞に変化する、すなわち「がん抑制性CAF」から「がん促進性CAF」に変わる(形質転換)する可能性を示しています(stromagenic switch)。いわば、がん抑制性CAFが、がん細胞の側に寝返る(敵から味方になる)という現象ががんの進行中に起きているとも考えられます。
さらに本研究チームは、線維芽細胞にビタミンDを投与することによりMeflinの発現が上昇することも示しました(図3)。現在、米国では、既存のがん薬物療法にビタミンDを組み合わせた治療法の治験が複数進行中であり、それらの結果と本研究成果の関連の解明も期待されます。
なお、がん抑制性CAFの存在は、現時点では膵臓がんのみで提唱されているものであり、他のがんに関しては詳細に解析されていません。今後は他のがんでも、がん抑制性CAFの存在の有無を確認していく必要があります。
社会的意義・今後の展開
約50年前にMicheal Stoker博士(グラスゴー大学)は、発がんウイルスの一種であるポリオーマウイルスによって形質転換されたがん細胞の増殖が線維芽細胞によって抑制されることを示し、私達の身体の線維芽細胞の本来の機能は、がんの抑制であることを提唱しました[参考文献4]。本研究は長年にわたって議論されてきた同博士の仮説を裏付けるものであり、線維芽細胞に関する今後の研究の発展に寄与するものと推察されます。
また、がんの間質に存在する免疫細胞の多様性は多くの研究の対象となってきましたが、CAFの多様性に関する解析はこれまで不十分でした。本研究によって膵臓がんのCAFの多様性の一部が明らかとなりました。今後は、がん促進性CAFをがん抑制性CAFに変換する新しい治療法の開発が期待されますが、本研究はその開発をすすめるために役立つ可能性が考えられます。
用語説明
- ※1 がん関連線維芽細胞(CAF):
- がん組織は、がん細胞と、それ以外の間質(かんしつ)から構成されます。間質はCAF、免疫細胞、骨髄由来細胞、腫瘍血管、リンパ管、CAFによって産生される細胞外基質から構成されています。CAFは骨髄や全身の血管周囲に存在する間葉系幹細胞、星細胞(膵臓や肝臓に存在する特殊なタイプの線維芽細胞)などの複数の細胞種に由来する細胞であることが過去の研究により明らかにされています。
- ※2 コラーゲン・細胞外基質:
- 線維芽細胞をはじめ多くの細胞は細胞外基質とよばれる物質を細胞の外に分泌することが知られています。細胞外基質にはコラーゲン、エラスチン、フィブロネクチンなど多くの種類があります。細胞外基質はいわば「のり」のように細胞外に沈着し、多くの細胞が機能するための足場を構築することが知られています。また細胞外基質の性質が変化すると組織の線維化・硬化を引き起こすことも知られています。
- ※3 抗腫瘍免疫応答:
- 私達の身体の免疫細胞はがんを発見するとこれを攻撃するしくみを備えています。これを抗腫瘍免疫応答と呼びます。
- ※4 間葉系幹細胞:
- 骨髄あるいは全身の臓器の血管の周囲に存在する細胞で、多種の細胞を生み出す能力を有しています。発生期においては骨、軟骨、骨格筋、脂肪等を生み出す一方、成体では主に線維芽細胞を生み出すことが知られています。単一な細胞ではなく、多様性に富む細胞であることが知られています。
- ※5 膜型分子:
- 細胞の中でなく細胞膜上に存在する分子を膜型分子あるいは膜分子と呼びます。
- ※6 平滑筋アクチン(α-SMA):
- 一般的にCAFのマーカーとして用いられている分子です。α-SMA陽性CAFの量とがんの悪性度が相関するという報告が複数されている一方、CAFを人工的に除去すると膵臓がんの進行が抑制される、という研究結果も報告されています。
- ※7 TGF-βシグナル:
- 多くのタイプのがんや線維化疾患において、病態を進行させることが知られています。TGF-βはがん細胞などの多彩な細胞によって産生され、その細胞自身あるいは線維芽細胞に発現しているTGF-β受容体に作用することで、がんの悪性化あるいは組織の線維化に寄与することが知られています。
発表雑誌
- 掲載紙:
- Cancer Research
- 論文名:
- Meflin-positive cancer-associated fibroblasts inhibit pancreatic carcinogenesis
- 著者:
- Yasuyuki Mizutani, Hiroki Kobayashi, Tadashi Iida, Naoya Asai, Atsushi Masamune, Akitoshi Hara, Nobutoshi Esaki, Kaori Ushida, Shinji Mii, Yukihiro Shiraki, Kenju Ando, Liang Weng, Seiichiro Ishihara, Suzanne M. Ponik, Matthew W. Conklin, Hisashi Haga, Arata Nagasaka, Takaki Miyata, Makoto Matsuyama, Tomoe Kobayashi, Tsutomu Fujii, Suguru Yamada, Junpei Yamaguchi, Tongtong Wang, Susan L. Woods, Daniel L. Worthley, Teppei Shimamura, Mitsuhiro Fujishiro, Yoshiki Hirooka, Atsushi Enomoto, & Masahide Takahashi
- 所属:
- 1Department of Pathology, 2Gastroenterology and Hepatology, 4Division of Molecular Pathology, Center for Neurological Disease and Cancer, 9Anatomy and Cell Biology,
12Department of Gastroenterological Surgery (Surgery II), 13Division of Surgical Oncology, Department of Surgery, and 14Division of Systems Biology, Nagoya University Graduate School of Medicine, Nagoya, 466-8550, Japan
3School of Medicine, University of Adelaide and South Australian Health and Medical Research Institute, Adelaide, South Australia, Australia
5Division of Gastroenterology, Tohoku University Graduate School of Medicine, Sendai, Japan
6Faculty of Advanced Life Science, Hokkaido University, Sapporo, Japan
7Department of Cell and Regenerative Biology, University of Wisconsin-Madison, Madison, WI, USA
8Division of Anatomy, Department of Human Development and Fostering, Meikai University School of Dentistry, Sakado, Japan
10Division of Molecular Genetics, Shigei Medical Research Institute, Okayama, Japan
11Department of Surgery and Science, Graduate School of Medicine and Pharmaceutical Sciences, University of Toyama, Toyama, Japan
15Department of Liver, Biliary Tract and Pancreas Diseases, Fujita Health University, Toyoake, Japan - DOI:
- 10.1158/0008-5472.CAN-19-0454
参考文献
- [1]
- Kobayashi H, Enomoto A, Woods SL, Burt AD, Takahashi M, Worthley DL. Cancer-associated fibroblasts in gastrointestinal cancer. Nat Rev Gastroenterol Hepatol. 16:282-295, 2019. doi: 10.1038/s41575-019-0115-0.
- [2]
- Maeda K, Enomoto A, Hara A, Asai N, Kobayashi T, Horinouchi A, Maruyama S, Ishikawa Y, Nishiyama T, Kiyoi H, Kato T, Ando K, Weng L, Mii S, Asai M, Mizutani Y, Watanabe O, Hirooka Y, Goto H, Takahashi M. Identification of Meflin as a Potential Marker for Mesenchymal Stromal Cells. Sci Rep. 6:22288, 2016. doi: 10.1038/srep22288.
- [3]
- Hara A, Kobayashi H, Asai N, Saito S, Higuchi T, Kato K, Okumura T, Bando YK, Takefuji M, Mizutani Y, Miyai Y, Saito S, Maruyama S, Maeda K, Ouchi N, Nagasaka A, Miyata T, Mii S, Kioka N, Worthley DL, Murohara T, Takahashi M, Enomoto A. Roles of the mesenchymal stromal/stem cell marker Meflin in cardiac tissue repair and the development of diastolic dysfunction. Circ Res. 2019. doi: 10.1161/CIRCRESAHA.119.314806. [Epub ahead of print]
- [4]
- Stoker MG, Shearer M, O'Neill C. Growth inhibition of polyoma-transformed cells by contact with static normal fibroblasts. J Cell Sci. 1:297-310, 1966
お問い合わせ
研究内容
名古屋大学医学部・医学系研究科腫瘍病理学
教授 髙橋 雅英
TEL:052-744-2093 FAX:052-744-2098
E-mail:mtakaha“AT”med.nagoya-u.ac.jp
広報担当
名古屋大学医学部・医学系研究科
総務課総務係
TEL:052-744-2228 FAX:052-744-2785
E-mail:iga-sous“AT”adm.nagoya-u.ac.jp
AMED事業に関するお問い合わせ
国立研究開発法人 日本医療研究開発機構(AMED)
革新的先端研究開発支援事業
基盤研究事業部 研究企画課
TEL:03-6870-2224
E-mail:kenkyuk-ask“AT”amed.go.jp
次世代がん医療創生研究事業
戦略推進部 がん研究課
TEL:03-6870-2221
E-mail:cancer“AT”amed.go.jp
※E-mailは上記アドレス“AT”の部分を@に変えてください。
関連リンク
掲載日 令和元年8月22日
最終更新日 令和元年8月22日


