プレスリリース リソソームが成体神経幹細胞を制御するメカニズムを解明
プレスリリース
京都大学
日本医療研究開発機構(AMED)
概要
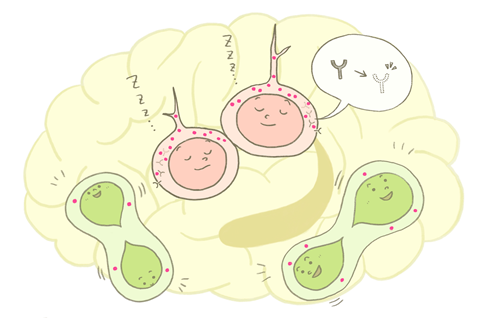
京都大学ウイルス・再生医科学研究所 小林妙子助教と影山龍一郎同教授(兼:物質―細胞統合システム拠点=iCeMS(アイセムス)連携PI)らの研究グループは、成体脳内の神経幹細胞の増殖・休眠がリソソーム活性の変動によって制御されていることを見いだしました。
大人の神経幹細胞は脳内の海馬歯状回や側脳室の周辺領域にわずかに存在していますが、そのほとんどが増殖や分化を停止した休眠状態にあります。休眠状態は、一生涯という長い期間、幹細胞を良い状態で体の中にストックしておくために重要です。本研究グループは、休眠状態では細胞内のタンパク質群を全体的に制御している特別なシステムがあるのではないかと考えて解析を行ってきました。これまでに脳室周囲の休眠状態の神経幹細胞でリソソームが多く存在することは報告されていましたが、「休眠」にリソソームがどのような役割を持つのかについては、全く明らかにされていませんでした。リソソームは細胞内で様々な物質の分解を行う細胞内小器官であり、エンドサイトーシスによって細胞内に取り込まれた膜受容体を分解します。本研究グループは、増殖している神経幹細胞が休眠状態に入る際に、1.細胞内のリソソームが増加すると共にリソソーム活性が上昇すること、2.増殖のシグナル伝達に関わる膜受容体をより速やかに分解すること、また、3.リソソームの働きを阻害すると神経幹細胞は休眠状態を脱すること、逆に、4.リソソーム活性を人工的に上昇させると神経幹細胞は増殖をやめて休眠状態に入ること、を見いだしました。この成果により、成体脳内の神経幹細胞において、リソソーム活性が休眠状態の重要な制御因子であることを明らかにしました。
本研究成果は、2019年11月29日に国際学術誌「Nature Communications」にオンライン掲載されます。
*イラストを記事等に転載される場合は、上記のクレジット(制作者名)を必ず明記してください。
背景
大人の神経幹細胞※1は脳内の海馬歯状回※2や側脳室※3の周辺領域にわずかに存在していますが、そのほとんどが増殖や分化を停止した休眠状態にあります。「休眠状態」は、一生涯という長い間、幹細胞を良い状態で体の中にストックしておくために必須のメカニズムです。休眠状態の神経幹細胞は適切なシグナルを受け取り、活性化されて再び増殖を始めた状態(「活性化状態」)になると、分化して成熟ニューロンを作り出すことができます。既に様々なシグナル伝達経路によって神経幹細胞の休眠・活性化が制御されることが報告されています。しかし、休眠・活性化による細胞内のタンパク質恒常性※4の変化についてはほとんど明らかになっていません。
京都大学ウイルス・再生医科学研究所 小林妙子助教、影山龍一郎教授らは、神経幹細胞内のタンパク質恒常性に着目し、休眠状態で細胞内のタンパク質の分解を制御している新たなメカニズムを想定して解析を行いました。細胞内のタンパク質分解は、主にユビキチン・プロテアソーム経路※5とリソソーム経路※6によって行われています。遺伝子発現の解析によって休眠状態の神経幹細胞では膜受容体※7が豊富に発現していることが報告されており、特別に制御されたタンパク質分解のシステムが存在するのではないかと考えられました。昨年に他グループから、成体脳内の脳室周囲に存在する細胞の遺伝子発現を1細胞単位で解析することにより、休眠状態の神経幹細胞にリソソーム※6が多く存在することが報告されました。しかし、休眠・活性化にリソソームがどのように機能しているのかについては、全く示されていませんでした。
研究手法・成果
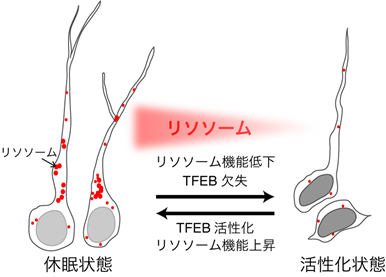
本研究の出発点は当研究室の末田らが最近報告した、休眠状態での転写因子Hes1に関連する遺伝子発現の振動パターンの違いでした。その違いを生む要因の一つとしてHes1タンパク質分解を検討したところ、休眠状態ではHes1の分解だけではなく、プロテアソーム(タンパク質を分解する巨大な酵素複合体)によるタンパク質分解が全体的に低下していることを示唆するデータが得られました。既に胚性幹細胞※8では、分化の状態でプロテアソーム活性が変化して細胞内のタンパク質恒常性を制御することが報告されていましたので、増殖状態と休眠状態の神経幹細胞におけるプロテアソーム活性を比較しました。プロテアソームは三種類のペプチダーゼ活性※9(トリプシン様、キモトリプシン様、カスペース様)があり、三種類の基質となるペプチドを用いて測定を行いました。その結果、トリプシン様活性が休眠状態で顕著に上昇しており、この上昇は予想に反してプロテアソームではなく、リソソーム酵素であるカテプシン※10の活性に依存していました。つまり、休眠状態でリソソームの活性が著しく上昇していることが分かりました。またプロテアソーム活性は、休眠状態で低下していることも分かりました。
培養した神経幹細胞を用いて休眠状態への誘導過程を詳細に調べると、細胞増殖因子や細胞増殖に関わるシグナル膜受容体が減少する一方で、リソソームの構成因子やリソソーム機能を上昇させる転写因子TFEB※11の発現が上昇していることが分かりました。免疫染色やリソソームの基質を用いて細胞内のリソソーム活性を測定すると、休眠状態ではリソソーム数の増加と活性の上昇が検出されました。次に、リソソーム機能を特異的に阻害する薬剤で休眠状態の神経幹細胞を処理すると、細胞増殖のシグナル伝達に関わる膜受容体が蓄積し、その後、細胞増殖が起こることも分かりました。細胞増殖に関わる膜受容体のEGFレセプター※12は、活性化されるとエンドサイトーシス経路※13でリソソームにより分解されることが知られています。そこで神経幹細胞における活性化型EGFレセプターの分解速度を調べると、休眠状態でより速やかに分解されていました。これらの結果から、神経幹細胞は休眠状態でリソソーム活性を上昇させ、活性化された膜受容体を速やかに分解して外部からのシグナル伝達を弱めることにより、積極的に休眠状態を維持しているということが分かりました。
次に、休眠状態では、リソソームに関連する遺伝子の発現を制御する主要な転写因子TFEBが活性化されていることが分かりました。このTFEBに着目し、TFEB遺伝子のノックアウトによるリソソーム機能の低下と、TFEB活性型※14の過剰発現によるリソソーム機能の上昇を誘導して、その影響を調べました。培養した神経幹細胞、および脳内の神経幹細胞にのみ時期特異的なノックアウトが可能なマウスを用いて解析を行いました。過剰発現にはレンチウイルスベクター※15を用いて発現の誘導を行いました。その結果、TFEB遺伝子のノックアウトによりリソソーム機能を低下させると、培養した神経幹細胞は休眠状態に入りにくく、また、成体マウスの脳内では、海馬歯状回に増殖状態の神経幹細胞が増加することを見いだしました。逆に、TFEB活性型の過剰発現によりリソソーム機能を上昇させると、増殖状態の神経幹細胞が休眠状態へ誘導されることを、培養した神経幹細胞と成体マウス脳内の海馬歯状回の神経幹細胞で見いだしました。これらの結果から、成体マウス脳内の神経幹細胞でリソソーム機能が上昇すると休眠状態となり、リソソーム機能が低下すると増殖状態となること、すなわちリソソーム機能の変化が神経幹細胞の増殖・休眠を制御しているという新たなメカニズムを明らかすることが出来ました。
波及効果、今後の予定
近年、リソソームは細胞内の最終分解装置としての役割だけではなく、細胞内の栄養状態を感知するセンサーでもあり、シグナル伝達の連結点としての機能も報告されています。リソソームは細胞の生存に関わる基礎の部分を担っていますので、安易にリソソームを阻害する手法はとれませんが、その下流で働く因子群を同定できれば、将来、神経幹細胞の状態を脳内で制御するツールの開発が期待できます。
研究プロジェクトについて
本研究は「成体神経幹細胞の休眠状態を制御する細胞内分解機構の解明」(基盤研究C、課題番号JSPS 17K07409、代表者:小林妙子)、「幹細胞の多様化機構の分子基盤の解明および均一分化方法の開発」(武田科学振興財団ライフサイエンス研究奨励、代表者:小林妙子)、「転写因子Hes1タンパク質機能調節による幹細胞制御」(内藤記念女性研究者研究助成、代表者:小林妙子)、「振動遺伝子による時間制御機構」(新学術領域「脳構築における発生時計と場の連携」課題番号16H06480、代表者:影山龍一郎)、「成体脳神経幹細胞の機能低下メカニズムの解明と再活性化に向けた技術開発」(AMED-CREST、課題番号JP18gm1110002、代表者:影山龍一郎)、「光操作技術を用いた神経幹細胞の新規分化制御法の開発」(日本医療研究開発機構(AMED)課題番号JP18bm0704020、代表者:今吉格)、「階層的な動的ネットワークの構築」(新学術領域「非線形発振現象を基盤としたヒューマンネイチャーの理解」(課題番号15H05876、代表者:郡宏)の支援をうけて行われました。
用語解説
- ※1.神経幹細胞:
- 大人の体の中にも存在する組織幹細胞の一つであり、自己複製能と神経系の細胞(ニューロン(神経細胞)、グリア細胞)を作り出す多分化能を持つ未分化な細胞。組織幹細胞は、分化の方向が組織を構成する細胞種に限られるが、様々な細胞種を作り出せる幹細胞のこと。グリア細胞は神経系を構成する神経細胞ではない細胞の総称。
- ※2.海馬歯状回:
- 脳の中で学習や記憶に重要な役割を果たす海馬の中に存在する領域。
- ※3.側脳室の周辺領域:
- 脳内の腔である脳室の一つである側脳室を取り囲む領域。
- ※4.タンパク質恒常性:
- 細胞内のタンパク質の組成をある一定の状態に維持しようとする機構。
- ※5.ユビキチン・プロテアソーム経路:
- 選択的にユビキチンを付加されたタンパク質が、プロテアソームによって分解される経路で、細胞内の不要タンパク質の分解のための主要な経路である。ユビキチンは、76アミノ酸からなるタンパク質で、他のタンパク質に付加されてタンパク質分解等の目印となる。プロテアソームは、タンパク質の分解を行うタンパク質分解酵素の複合体であり、シリンダー状の構造の内部でタンパク質を切断する。
- ※6.リソソーム・リソソーム経路:
- リソソームは細胞内小器官の一つで、膜に囲まれた内部は酸性化されており、様々な分解酵素を含んでいる。リソソーム経路は細胞内の不要物の分解のための主要な経路の一つであり、エンドサイトーシスやオートファジーによって運ばれた物質をリソソームで分解する。
- ※7.膜受容体:
- 細胞膜に存在して細胞外からのシグナル等を受け取って細胞内に伝えるタンパク質。
- ※8.胚性幹細胞:
- 発生初期段階の胚の一部(内部細胞塊)から作られた細胞でありES細胞と呼ばれる。
- ※9.三種類のペプチダーゼ活性:
- プロテアソームはタンパク質分解酵素の複合体であるため、異なるタンパク質分解の活性を持っており、タンパク質分解酵素であるトリプシン・キモトリプシン・カスペースに似た切断部位の特異性をもつ酵素を含んでいる。
- ※10.カテプシン:
- リソソームに局在するプロテアーゼ群。
- ※11.転写因子TFEB:
- リソソームに関連する因子の発現を上昇させる転写因子であり、リン酸化によって不活性化される。
- ※12)EGFレセプター:
- 上皮成長因子(EGF)と結合して活性化される細胞膜貫通型の受容体。
- ※13.エンドサイトーシス・エンドサイトーシス経路:
- エンドサイトーシスは細胞外の分子や細胞膜タンパク質などを細胞内に取り込む機構。とりこまれた物質は細胞内小器官の一つであるエンドソームを経て最終的にリソソームで分解される。
- ※14.TFEB活性型:
- リン酸化によって不活性化される部分を無くして常に活性を持つ状態にした変異体。
- ※15.レンチウイルスベクター:
- 非分裂細胞にも効率よく遺伝子を導入することができるウイルスベクター。
研究者のコメント
最初の発見から論文にするまでに4年かかりました。根気強く協力して頂いた共著者の方々と、支えてくれた家族に心から御礼申し上げます。リソソームは多様な機能を持つ細胞内小器官です。神経幹細胞でのリソソームの機能変化によって制御されているメカニズムをさらに明らかにしていきたいです。
論文タイトルと著者
- タイトル:
- Enhanced lysosomal degradation maintains the quiescent state of neural stem cells
(リソソーム分解の促進が神経幹細胞の休眠状態を維持する) - 著者:
- Taeko Kobayashi, Wenhui Piao, Toshiya Takamura, Hiroshi Kori, Hitoshi Miyachi, Satsuki Kitano, Yumiko Iwamoto, Mayumi Yamada, Itaru Imayoshi, Seiji Shioda, Andrea Ballabio and Ryoichiro Kageyama
- 掲載誌:
- Nature Communications
お問い合わせ先
小林(小曽戸) 妙子(こばやし(こそど) たえこ)
京都大学ウイルス・再生医科学研究所・助教
TEL:075-751-4013
FAX:075-751-4807
E-mail:tkobayas”AT”infront.kyoto-u.ac.jp
報道に関するお問い合わせ
京都大学総務部広報課 国際広報室
TEL:075-753-5729 FAX:075-753-2094
E-mail:comms”AT”mail2.adm.kyoto-u.ac.jp
AMED事業に関すること
革新的先端研究開発支援事業(AMED-CREST)
国立研究開発法人日本医療研究開発機構(AMED)
〒100-0004 東京都千代田区大手町一丁目7番1号
基盤研究事業部 研究企画課
TEL:03-6870-2224
E-mail:kenkyuk-ask”AT”amed.go.jp
再生医療実現プロジェクト
戦略推進部 再生医療研究課
TEL:03-6870-2220
E-mail:saisei”AT”amed.go.jp
※E-mailは上記アドレス"AT"の部分を@に変えてください。
掲載日 令和元年11月29日
最終更新日 令和元年11月29日


