プレスリリース 異常な翻訳停滞の強制終了を試験管内で再現―リボソームのユビキチン化による新生ペプチド鎖の運命決定機構―
プレスリリース
東北大学
ミュンヘン大学
東京都医学総合研究所
日本医療研究開発機構
東北大学大学院薬学研究科の稲田利文教授、松尾芳隆助教とドイツミュンヘン大学Roland Beckmann教授、東京都医学総合研究所佐伯泰副参事研究員らの研究グループは、強い翻訳停滞を引き起こし、共翻訳的な分解の対象になる内在性の配列を発見しました。更に、この翻訳停滞の仕組みを分子レベルで明らかにしました。また、翻訳停滞からリボソームの強制的なサブユニット解離までの多段階反応を試験管内で再現することに成功しました。本研究は、文部科学省科学研究費補助金(基盤研究(A)、(C)、新学術領域研究「ケモテクノロジーが拓くユビキチンニューフロンティア」)、日本医療研究開発機構の革新的先端研究開発支援事業(AMED-CREST)「全ライフコースを対象とした個体の機能低下機構の解明」、(公財)武田科学振興財団、(公財)加藤記念バイオサイエンス振興財団の研究助成により実施しました。この研究成果は、2020年3月23日(月曜日)16時(英国時間)に英国科学誌『Nature Structural & Molecular Biology』にオンライン掲載されます。
ポイント
- 強い翻訳停滞によって合成途中のタンパク質を分解経路へと導く内在性の配列を世界で初めて発見し、強い翻訳停滞を誘導する分子機構を、クライオ電子顕微鏡を用いた構造解析、遺伝学や生化学的な手法を用いた機能解析によって解明しました。
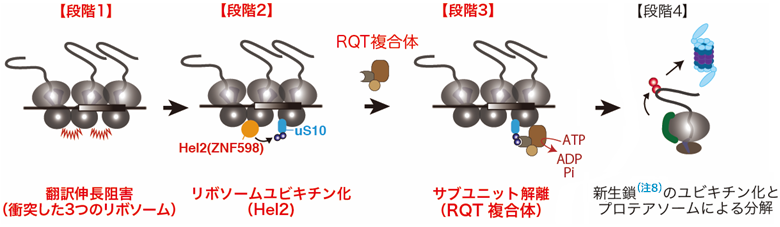
- 異常翻訳を認識する品質管理であるRQCの分子機構における4段階の反応(①翻訳停滞、②リボソームの衝突、③衝突したリボソームのユビキチン化、④ユビキチン化されたリボソームのサブユニット解離)を、内在性の配列を用いて試験管内で再現することに世界で初めて成功しました。
- 異常翻訳によりタンパク質の恒常性が破綻すると、自閉症などの神経変性疾患が発症することが知られおり、今回の研究成果はその発症機構の理解につながる重要な基盤としての知見になることが期待されます。
研究の背景
正確な遺伝子発現は生命現象の根幹であり、その破綻や異常はさまざまな疾患の原因になります。細胞が保持する品質管理機構(注1)は、異常な遺伝子産物を認識し排除することで遺伝子発現の正確性を保証しています。
タンパク質はmRNA(注2)を鋳型にしたリボソーム(注3)による翻訳反応によって合成されます。タンパク質の合成途上での翻訳停止は遺伝子産物の機能に重大な欠損を示すため、品質管理機構によって認識され排除される必要があります。研究グループは、これまでに、翻訳伸長の反応が途中で停止した場合に、合成途上のポリペプチド鎖のユビキチン化(注4)とプロテアソーム(注5)による迅速な分解が起こることを世界に先駆けて報告してきました。
翻訳伸長中のリボソームがmRNA上で強く停滞すると、後続のリボソームが追いつき、先頭で停止したリボソームと衝突します(図1)。RQC因子(注6)はこのリボソーム同士の衝突を異常な翻訳とみなし、衝突したリボソームにユビキチン化という目印をつけます。ユビキチン化されたリボソームはサブユニットへと解離し、途中まで合成された新生ペプチド鎖は分解経路に進みます(図1)。しかし、ユビキチン化に依存したサブユニット解離(注7)は、正常な翻訳終結で起こるサブユニット解離とは分子機構が異なっており、その詳細はこれまで不明でした。
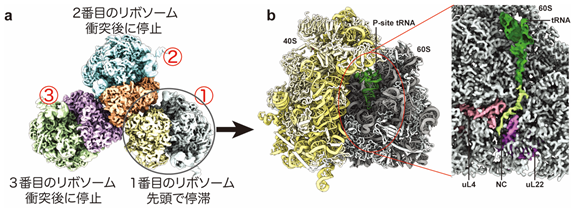
(b)翻訳伸長の段階で停滞したリボソーム内での、合成途中のタンパク質とリボソームの特異的な相互作用をクライオ顕微鏡で観察。
研究の概要
今回、研究グループは、強い翻訳停滞によってタンパク質合成を分解経路へと導く内在性の配列を世界で初めて発見し、その停滞メカニズムを、クライオ電子顕微鏡(注9)を用いた構造解析、遺伝学や生化学的な手法を用いた機能解析によって明らかにしました。また、発見した内在性の配列を用いて、①翻訳停滞、②リボソームの衝突、③衝突したリボソームのユビキチン化、④ユビキチン化されたリボソームのサブユニット解離までの多段階反応を試験管内で再現することに成功し、RQT複合体(注10)が翻訳停滞したリボソームのサブユニット解離を誘導する本体であることを初めて証明しました。また、試験管内の再現実験により、品質管理機構に関与する因子の詳細な機能が明らかになりました。
社会的意義と今後の展望
異常タンパク質は、翻訳後にさまざまな要因で立体構造等の変化により生じますが、異常mRNAの翻訳や不正確な翻訳反応でも産生されます。タンパク質の合成途中のエラーによる翻訳停止はタンパク質の機能の重大な欠陥を引き起こし、タンパク質の恒常性の破綻につながります。タンパク質の恒常性の破綻は、更に不良なタンパク質の蓄積やオルガネラ(注11)の損傷、シグナル伝達経路の撹乱など、広範な細胞機能の障害を引き起こすため、アルツハイマー病やパーキンソン病などの神経変性疾患の原因になると考えられます。RQCは真核生物に広く保存されており、特に神経細胞において重要であり、RQCが欠損したマウスでは、高い頻度で神経細胞死と行動異常が報告されています。更に、自閉症患者で複数のRQC因子の変異が同定されています。従って、自閉症発症の分子基盤の理解には、RQCの機能低下による翻訳異常の理解が極めて重要であると考えられます。
用語説明
- 注1 品質管理
- 異常な遺伝子産物を認識し分解することで、遺伝子発現の正確性を保証するシステム。
- 注2 mRNA
- メッセンジャーRNAの略で日本語では伝令RNA。タンパク質合成の設計図となる遺伝情報を持つRNA。
- 注3 リボソーム
- mRNAの持つ遺伝情報に従ってアミノ酸同士を結合させ、タンパク質を合成する装置。タンパク質とRNAから構成される巨大な複合体である。
- 注4 ユビキチン化
- ユビキチンは76アミノ酸からなる低分子タンパク質である。ユビキチンが他のタンパク質のリジン残基に共有結合で付加されると、タンパク質の活性を制御したりプロテアソームによって認識され分解されたりする。
- 注5 プロテアソーム
- ユビキチン化された異常なタンパク質を分解する因子。複数のタンパク質が集合して出来る複合体である。
- 注6 RQC(Ribosome Quality Control)因子
- 異常な翻訳停滞を認識し、分解へと導く品質管理機構に関与する因子。代表的な因子として、異常な翻訳停滞を認識するHel2や合成されたペプチド鎖へ分解シグナルを付加するLtn1などが挙げられる。
- 注7 サブユニット解離
- リボソームの大と小からなる2つのサブユニットが分離すること。
- 注8 新生鎖
- リボソームによる翻訳反応の中間体であり、合成途中のタンパク質のこと。
- 注9 クライオ電子顕微鏡
- 試料を低温(液体窒素と同程度)のまま観察できる装置を備えた高性能な透過型電子顕微鏡。
- 注10 RQT(Ribosome Quality Control Trigger)複合体
- 異常な翻訳停滞を認識し、品質管理機構の誘導に関与する複合体。RNAヘリカーゼ Slh1、ユビキチンタンパク質 Cue2、機能未知タンパク質 Ykr023wという3つの因子から構成される。
- 注11 オルガネラ
- 細胞の内部で特に分化した形態や機能をもつ構造体の総称。核、小胞体、ゴルジ体、ミトコンドリアや葉緑体などが挙げられる。
論文名
- 論文名
- “RQT complex dissociates ribosomes collided on endogenous RQC substrate SDD1”
(RQT複合体は内在性RQC基質SDD1のmRNA上で衝突したリボソームを解離させる) - 発表雑誌
- Nature Structural & Molecular Biology
- DOI
- 10.1038/s41594-020-0393-9
- URL
- https://www.nature.com/articles/s41594-020-0393-9
お問合せ先
研究に関すること
東北大学大学院薬学研究科:稲田 利文 教授
電話:022-795-6874
メールアドレス:toshifumi.inada.a3“AT”tohoku.ac.jp
東北大学に関すること
薬学研究科事務:星野 公太郎
電話:022-795-6801
メールアドレス:kotaro.hoshino.d2“AT”tohoku.ac.jp
AMEDに関すること
国立研究開発法人日本医療研究開発機構
基盤研究事業部 研究企画課
電話:03-6870-2224
メールアドレス:kenkyuk-ask“AT”amed.go.jp
※E-mailは上記アドレス“AT”の部分を@に変えてください。
掲載日 令和2年3月24日
最終更新日 令和2年3月24日


