プレスリリース 「毒を以て毒を制す」悪性腫瘍の治療法―逆転の発想による治療抵抗性腫瘍の新しい治療戦略―
プレスリリース
東北大学大学院医学系研究科
東北大学東北メディカル・メガバンク機構
日本医療研究開発機構
発表のポイント
- 抗がん剤や放射線治療に抵抗性を示す腫瘍に対する新しい治療戦略の有効性を、マウスを用いた実験で実証しました。
- 転写因子※1Nrf2の活性化を伴う治療抵抗性※2腫瘍に対して、周囲の正常細胞のNrf2を活性化させることで、腫瘍の進行を抑制できることを明らかにしました。
- 転写因子Nrf2の活性化は正常細胞を防御する役割もあり、副作用の少ない治療法になると期待できます。
概要
転写因子Nrf2の活性化は、肺がんや食道がんなど様々ながんで見られ、がん細胞に抗がん剤や放射線に対する治療抵抗性を獲得させることで患者の予後を悪化させます。このようながんに対して、がん細胞のNrf2を抑制する治療法が開発されていますが、副作用の心配もあり、現在はまだ実用化されていません。
東北大学大学院医学系研究科の鈴木未来子准教授、山本雅之教授らは、がん細胞のNrf2を抑制するのではなく、がん周囲の正常細胞(特に免疫細胞)においてNrf2を活性化させることで、がんの進行を抑制できることを、マウスを用いた実験で実証しました。Nrf2の活性化は正常細胞を防御する役割もあるため、副作用の少ない治療法になると期待されます。
今回の研究成果は、日本時間2020年7月8日に米国癌学会の学術誌「Cancer Research」のオンライン版で公開されます。
詳細
Nrf2は、細胞が毒物や酸化ストレス※3に曝された際に活性化し、これらのストレスから細胞を防御する役割をもつ転写因子です。肺がんの約20-30%には、Nrf2が常に活性化するような遺伝子変異※4が生じており、これによりがん細胞は抗がん剤治療や放射線治療に対する抵抗性を獲得することが知られています。このようなNrf2活性化を伴う悪性腫瘍に対して、がん細胞におけるNrf2を抑制する治療法が検討されています。しかし、Nrf2はストレスから正常細胞を守る役割もあるため、Nrf2の抑制は副作用の懸念があり、実用化されていません。
一方で、以前に山本教授らの研究グループは、免疫細胞などの正常細胞でNrf2を活性化すると、腫瘍の進行を抑制できることを報告しました(平本ら、2014年、DOI:10.1158/1940-6207.CAPR-14-0094.)。そこで本研究では、Nrf2活性化を伴う悪性腫瘍についても、周囲の正常細胞でのNrf2を活性化させることで、腫瘍を抑制できるか検討しました。遺伝子組換え※5技術を用いて、Nrf2を抑制するはたらきをもつKeap1タンパク質の量を減らすことでNrf2を全身で活性化させたマウスと、対照となる野生型※6のマウスに、Nrf2活性化肺がんを作らせ、がんの進行を観察しました。野生型マウスと比べて、全身でNrf2を活性化したマウスは、腫瘍の大きさが減少し(図)、生存率が上昇しました。さらに、全身でNrf2を活性化したマウスにおいて、血液細胞(免疫細胞)でのみNrf2を活性化しないようにすると、腫瘍抑制効果が弱まったことから、特に免疫細胞におけるNrf2活性化が腫瘍抑制に重要であることがわかりました。
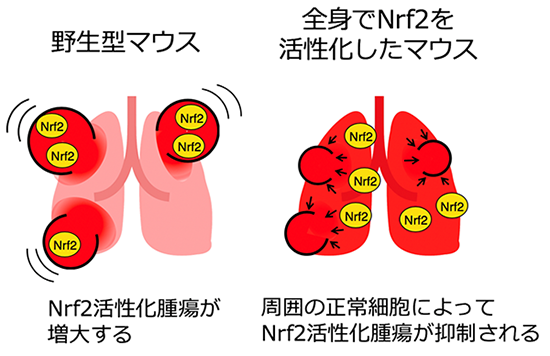
Nrf2は正常細胞をストレスから保護する役割をもつため、Nrf2を抑制する治療法に比べて、この治療法では副作用が少なくなると考えられます。この研究成果は、予後不良のがんに対する新しい治療法の開発に結びつくものと期待されます。
用語解説
- ※1 転写因子
- DNAに結合し、遺伝子の発現を制御するタンパク質の総称。
- ※2治療抵抗性
- 標準的な治療を行っても、効果がみられないこと。
- ※3 酸化ストレス
- 活性酸素種などによるストレス。DNAやタンパク質などを損傷させる。
- ※4 遺伝子変異
- DNAの配列が変化し、タンパク質の発現量や機能が変化すること。
- ※5 遺伝子組換え
- DNAの配列を人工的に変化させ、タンパク質の発現量や機能を変化させること。
- ※6 野生型
- 遺伝子変異を起こしていない野生の集団に最も多くみられる状態。
論文情報
Microenvironmental activation of Nrf2 restricts the progression of Nrf2-activated malignant tumors
「微小環境でのNrf2活性化は、Nrf2活性化を伴う悪性腫瘍の進行を制限する」
- 掲載誌:
- Cancer Research
- DOI:
- 10.1158/0008-5472.CAN-19-2888
- 著者:
- 東北大学大学院 医学系研究科 医化学分野
- 林真貴子、久我有祐美、Harit Panda、山本雅之*(東北大学 東北メディカル・メガバンク機構を兼任)
- 東北大学大学院 医学系研究科 ラジオアイソトープセンター
- 鈴木未来子
- 東北大学 加齢医学研究所
- 北村大志、本橋ほづみ
研究支援先
本研究は、国立研究開発法人日本医療研究開発機構(AMED)の次世代がん医療創生研究事業(AMED P-CREATE)における研究開発課題「抗がん剤・放射線治療抵抗性がんを標的としたNRF2阻害剤の開発」(研究開発代表者:山本雅之)、文部科学省科学研究費補助金などの支援を受けて行われました。
お問い合わせ先
研究に関すること
東北大学大学院医学系研究科 医化学分野
東北大学東北メディカル・メガバンク機構長
教授 山本雅之(やまもとまさゆき)
電話番号:022-717-8084
E-mail:masiyamamoto“AT”med.tohoku.ac.jp
東北大学大学院医学系研究科 ラジオアイソトープセンター
准教授 鈴木未来子(すずきみきこ)
電話番号:022-717-8088
E-mail:suzukimikiko“AT”med.tohoku.ac.jp
報道担当
東北大学東北メディカル・メガバンク機構
長神風二(ながみふうじ)
電話番号:022-717-7908 ファクス:022-717-7923
E-mail:pr“AT”megabank.tohoku.ac.jp
AMED事業に関すること
日本医療研究開発機構(AMED)
創薬事業部 医薬品研究開発課
電話番号:03-6870-2311
E-mail:cancer“AT”amed.go.jp
※E-mailは上記アドレス“AT”の部分を@に変えてください。
関連リンク
掲載日 令和2年7月8日
最終更新日 令和2年7月8日


