プレスリリース 生体内におけるHIV-1感染細胞のマルチオミクス解析―エイズ根治法の手がかり探索に道―
プレスリリース
東京大学
日本医療研究開発機構
発表者
佐藤佳(東京大学医科学研究所 附属感染症国際研究センター システムウイルス学分野 准教授)
発表のポイント
- 小動物モデル「ヒト化マウス」(注1)を用いたHIV-1感染モデルを作出し、その検体を用いたマルチオミクス解析(注2)を実施し、生体内における「真の」HIV-1感染細胞の特徴を多角的に明らかにした。
- HIV-1プロウイルスのヒトのゲノムへの組込み部位によって、感染細胞のウイルス産生能力が規定される可能性が示唆された。
- 生体内におけるHIV-1感染細胞は、さまざまな形質を示す不均質な細胞の集団であり、その中で特に、CXCL13(注3)の高発現細胞集団とインターフェロン誘導遺伝子(注4)の低発現細胞集団が、生体内におけるウイルスの感染拡大に寄与している可能性を見出した。
- 本研究成果は、生体内におけるHIV-1感染細胞の特徴を網羅的に描出したものであり、エイズ根治療法の確立に必要な潜伏感染細胞の手がかりを探す上で基礎となる重要な成果である。
発表概要
東京大学医科学研究所附属感染症国際研究センターシステムウイルス学分野の佐藤准教授らは、小動物モデルである「ヒト化マウス」を用いたHIV-1感染動物モデルを作りました。このモデル動物から取得された検体のマルチオミクス解析によって、生体内におけるHIV-1感染細胞の特徴を多角的かつ網羅的に描き出しました。
ヒト免疫不全ウイルス1型(HIV-1)(注5)は、後天性免疫不全症候群(エイズ)の原因ウイルスです。抗レトロウイルス薬多剤併用療法(注6)が確立された現在、エイズは不治の病ではなくなりました。しかし、現在においても、エイズを根治する療法はいまだ確立されていません。その原因は、感染細胞の一部でHIV-1プロウイルス(逆転写されたHIV-1のDNA)がヒトのゲノムに組み込まれ、ウイルス産生をしない「潜伏感染」の状態を保持するためであると考えられています。どのような感染細胞が潜伏感染化するかについては未解明な点が多く、感染細胞の特徴のさらなる解明が求められています。しかし、HIV-1感染細胞を特異的に検出することはきわめて困難であるため、感染者検体からHIV-1感染細胞のみを検出して分離することはきわめて困難でした。そこで本研究では、HIV-1にGFP遺伝子を組込んだウイルス(HIV1-GFP)を用い、このウイルスを感染させたヒト化マウス感染動物モデルを作出しました。これにより、蛍光タンパク質であるGFPを指標として、生体内におけるHIV-1感染細胞の検出と、その高純度な分離が可能となりました。本研究では、HIV-1感染ヒト化マウスモデルを用いたウイルス感染細胞のマルチオミクス解析によって、既存の手法では解析が困難な、生体内における「真の」HIV-1感染細胞の特徴を多角的に描出することに成功しました。本研究成果は、ウイルスと宿主の相互作用のさらなる解明や、エイズを含めたウイルス感染症の制圧法の開発に向けた基礎学術基盤の形成に直結する研究であると言えます。
本研究成果は2020年7月14日、米国科学雑誌「Cell Reports」オンライン版に公開されます。
発表内容
エイズは、HIV-1の感染を原因とする疾患です。抗レトロウイルス薬多剤併用療法の発展により、エイズの治療は可能となりましたが、それを根治する療法は未だ確立していません。その原因として、薬剤投与でも取り除くことができない、長期間生存する潜伏感染細胞が生体内に存在する可能性が考えられています。しかし、すべてのHIV-1感染細胞が潜伏感染化するわけではないため、生体内におけるウイルス感染細胞を特徴づける因子についての幅広い理解が必要となっています。
HIV-1は、人間の免疫の指令塔の役割を果たすリンパ球であるCD4T細胞を主たる感染標的とします。しかし、HIV-1感染者の体内でウイルスに感染しているCD4T細胞はごく一部です。エイズの根治を目指すにあたり、生体内におけるウイルス感染細胞の性状を理解することは重要ですが、HIV-1感染細胞に特異的なマーカー分子が未同定であるため、HIV-1感染者から、ウイルス感染細胞のみを特異的に単離して解析することはきわめて困難です。
この問題点に対して、本研究グループは、CD4T細胞を含むヒトの免疫システムを再構築した「ヒト化マウス」という小動物モデルを用い、また、HIV-1のゲノムにgreen fluorescent protein(GFP_遺伝子と呼ばれる緑色の蛍光を発するタンパク質)を組み込んだレポーターウイルスHIV1-GFPを用いることで、生体内におけるHIV-1感染細胞を捕捉できる感染実験モデルを確立しました。このモデル系から得られた検体と、セルソーターという技術を活用することにより、生体内におけるHIV-1感染細胞を、GFPを指標として、高純度に分離することが可能となりました。
本研究では、近年発展した様々な解析手法を駆使して、生体内におけるHIV-1感染細胞(図1:a)の性状の多角的な解析に取り組みました。まず、極少量の検体における、標的DNAの絶対量を測る技術droplet digital PCR(ddPCR)法による解析によって、GFPが陰性のCD4T細胞、すなわち、ウイルス非産生細胞においても、ウイルス由来のDNAが存在することが確認されました(図1:b)。このことは、ヒトのゲノムに組み込まれたウイルスDNAは保持しているが、ウイルスを産生しない細胞、すなわち、潜伏感染細胞になりうる細胞が、ヒト化マウスモデルを用いた再構築実験においても再現されたことを示唆しています。
次に、ligation mediated PCR(LM-PCR)法(注7)による解析により、ウイルス感染細胞において、HIV-1のDNAが、転写が活発なヒトゲノムの領域に多く挿入されていることが示されました(図1:e)。このことは、ウイルスのヒトゲノム内の組み込み部位によって、感染細胞のウイルス産生能力が規定される可能性を示唆しています。
また、digital RNA-sequencing法(注8)による解析の結果、ウイルス産生細胞において、ウイルス由来のmRNAは、全遺伝子の中でも5番目に高い発現量であることが示されました(図1:c)。発現量はGAPDHなどのハウスキーピング遺伝子と同等か、それ以上の発現レベルであり、きわめて多量なウイルス由来のmRNAが転写されていることが明らかとなりました。
そして、1細胞レベルの解析の結果、生体内におけるHIV-1産生細胞が不均質な細胞の集団であること、そして特に、CXCL13を高発現する細胞亜集団(図1:d、"cluster 3")と、インターフェロン誘導遺伝子が低発現である細胞亜集団(図1:d、"cluster 5")におけるHIV-1の高発現が示されました(図1:d)。このことは、これらの細胞集団が、生体内におけるウイルスの感染拡大に寄与している可能性を示唆しています。
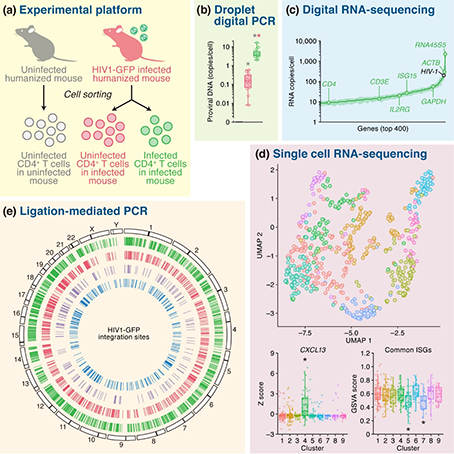
・(a)、(b)、(c)の灰色は非感染マウス由来のCD4T細胞、赤色はHIV1-GFP感染マウス由来のウイルス非産生CD4T細胞、緑色はHIV1-GFP感染マウス由来のウイルス産生CD4T細胞を示す。
・(d)は、1細胞RNA-Seq結果を基に分類した9つの異なる細胞亜集団 (cluster)を各色で示したもの。(上):1細胞RNA-Seq結果の次元圧縮結果(左下):9つの異なる細胞亜集団(cluster)におけるCXCL13の発現量 (右):9つの異なる細胞亜集団(cluster)におけるインターフェロン誘導遺伝子の発現量。
以上のように、本研究では、ヒト化マウスモデルを用いたHIV-1感染細胞のマルチオミクス解析によって、既存の手法では解析がきわめて困難な、生体内における「真の」HIV-1感染細胞の特徴を多角的に描き出すことに成功しました。また、本研究で用いた研究手法(マルチオミクス解析)は、きわめて汎用的であり、さまざまなシーケンスデータに適用可能であることから、あらゆるウイルス研究への応用が可能です。
つまり、本研究は、エイズ根治に向けて必須であるHIV-1感染細胞の特徴の理解を深め、ウイルスと宿主の新たな関係性の一端を明らかにした研究であり、また、ウイルスと宿主の相互作用のさらなる解明や、エイズの制圧法の開発に向けた基礎学術基盤の形成に直結する研究であると言えます。
本研究への支援
佐藤佳准教授に対する日本医療研究開発機構 感染症研究革新イニシアティブ(J-PRIDE)(19fm0208006h0003)、科学研究費補助金 基盤研究B(18H02662)、新学術領域研究「ネオウイルス学」(16H06429, 16K21723, 17H05813, 19H04826)、科学技術振興機構 CREST、先進ゲノム支援(16H06279);佐藤佳准教授と小柳義夫教授に対する日本医療研究開発機構エイズ対策実用化研究事業(19fk0410014, 19fk0410019);伊東潤平博士研究員(学振PD)に対する日本学術振興会 特別研究員奨励費(PD 19J01713)などの支援の下で実施されました。
発表雑誌
- 雑誌名
- 「Cell Reports」7月14日オンライン版
- 論文タイトル
- Multiomics investigation revealing the characteristics of HIV-1-infected cells in vivo
- 著 者
- 麻生啓文#、長岡峻平#、川上英良#、伊東 潤平、Saiful Islam、Benjy Jek Yang Tan、
中岡慎治、芦崎晃一、城口克之、鈴木穣、佐藤賢文、小柳義夫、佐藤 佳*
(#Equal contribution) - DOI番号
- 10.1016/j.celrep.2020.107887
用語解説
- (注1)ヒト化マウス
- 実験動物中央研究所(川崎市)が開発した超免疫不全マウスであるNOGマウスをレシピエントマウスとして、ヒト造血幹細胞を移植することにより、ヒト免疫細胞を再構築したマウス。
- (注2)マルチオミクス解析
- さまざまなオミクス[omics;すべての遺伝情報(ゲノム;genome)やすべての遺伝子発現情報(トランスクリプトーム;transcriptome)などの、網羅的な情報(-ome)を取得・解析する研究手法]情報を、複合的に解析する研究手法。
- (注3)CXCL13
- 細胞遊走因子であるケモカインの一種。細胞が、生体内のある場所からリンパ節の胚中心へ移動する遊走を誘導することが知られている。
- (注4)インターフェロン誘導遺伝子
- サイトカインの一種であるI型インターフェロンの刺激によって発現誘導される遺伝子。インターフェロン誘導遺伝子には、ウイルス複製を阻害する機能を持つ遺伝子が多く存在する。特に、APOBEC3GやtetherinなどHIV-1の複製を強力に阻害する遺伝子がある。
- (注5)ヒト免疫不全ウイルス1型(HIV-1)
- エイズの原因ウイルス。レトロウイルスの一種であり、逆転写によってウイルスDNAを合成し、ヒトのゲノムに組み込む。世界三大感染症(エイズ、結核、マラリア)の原因ウイルスのひとつであり、2020年現在において、世界に約3,000万人以上の感染者がいると推定されている。
- (注6)抗レトロウイルス薬多剤併用療法
- 1990年代後半に確立された、HIV-1感染症に対する治療法。複数の作用機序を持つウイルス複製阻害剤を併用することにより、HIV-1感染症の進展や、エイズ発症を抑える効果がある。薬の組み合わせは複数あり、HIV-1感染症に対する治療法のグローバルスタンダードとなっている。
- (注7)ligation-mediated PCR(LM-PCR)法
- 共同研究者である佐藤賢文博士(熊本大学)が開発した、次世代シークエンス技術を活用した、HIV-1のヒトゲノムへの組み込み部位を網羅的に同定する研究手法(Satou et al, Scientific Reports, 7(1):6913, 2017)。
- (注8)digital RNA-sequencing法
- 共同研究者である城口 克之博士(理化学研究所)が開発した、約100個程度の極少量の細胞のトランスクリプトーム解析を可能とする解析手法(Shiroguchi et al, Proc. Natl. Acad. Sci. USA, 109, 1347-1352, 2012)。
お問い合わせ先
東京大学医科学研究所 附属感染症国際研究センター システムウイルス学分野
准教授 佐藤佳(さとうけい)
電話番号:03-5449-5268 FAX:03-6409-2213
E-mail:ksato“AT”ims.u-tokyo.ac.jp
報道に関すること
東京大学医科学研究所 国際学術連携室(広報)
電話番号:090-9832-9760
E-mail:koho“AT”ims.u-tokyo.ac.jp
AMEDの事業に関すること
日本医療研究開発機構 疾患基礎研究事業部 疾患基礎研究課
〒100-0004 東京都千代田区大手町1-7-1
電話番号:03-6870-2225
E-mail:jprogram“AT”amed.go.jp
※E-mailは上記アドレス“AT”の部分を@に変えてください。
関連リンク
掲載日 令和2年7月15日
最終更新日 令和2年7月15日


