プレスリリース 精神疾患に神経細胞のアンバランスな運命付けが関連―iPS細胞由来脳オルガノイドの研究から―
プレスリリース
理化学研究所
日本医療研究開発機構
理化学研究所(理研)脳神経科学研究センター精神疾患動態研究チームの澤田知世研究員(研究当時)、加藤忠史チームリーダーらの国際共同研究グループ※は、1人だけが精神疾患を発症した不一致な一卵性双生児[1]のペア(罹患双生児と健常双生児)のiPS細胞[2]由来脳オルガノイド[3]を用い、ヒト脳の発達過程における興奮性神経細胞[4]と抑制性神経細胞[5]の不均衡が精神疾患の発症に関連することを発見しました。
本研究成果は、統合失調症[6]や双極性障害(躁うつ病)[7]をはじめとする精神疾患の病態解明や予防法・治療法の開発に貢献すると期待できます。
精神疾患の発症に関わる分子・細胞レベルの詳しいメカニズムについては、患者それぞれが持つ遺伝的背景に多様性があること、生きている患者の疾患発症前の脳を直接分子・細胞レベルで調べる方法がないことから、まだ不明な点が多く残っています。
今回、国際共同研究グループは、統合失調感情障害双極型[8]または統合失調症に関して不一致な一卵性双生児3組から樹立したiPS細胞を用いて、脳オルガノイドや神経前駆細胞[9]を作製し、患者と健常者の脳発達期における違いを調べました。遺伝子発現解析および形態解析の結果、健常者と比べ、患者では、脳発達の初期段階において抑制性神経細胞(GABA作動性神経細胞[5])への分化が亢進していることを見いだしました。一卵性双生児を比較することにより、遺伝的多様性の影響を最小限に抑えた本研究で得られた結果は、神経細胞のアンバランスな運命付け[10]が精神疾患の発症に関連することを強く示唆しています。
本研究は、科学雑誌『Molecular Psychiatry』の掲載に先立ち、オンライン版(2020年8月7日付:日本時間2020年8月7日)に掲載されます。
※国際共同研究グループ
理化学研究所
脳神経科学研究センター
精神疾患動態研究チーム
研究員(研究当時)澤田知世(さわだともよ)
(現 リーバー脳発達研究所/ジョンズ・ホプキンス大学 医学部)
テクニカルスタッフ(研究当時)藤森典子(ふじもりのりこ)
(現 理化学研究所脳神経科学研究センター 研究基盤開発部門)
チームリーダー 加藤忠史(かとうただふみ)
(現 順天堂大学医学部精神医学講座 主任教授)
シナプス可塑性・回路制御研究チーム
研究員 トーマス・チェイター(Thomas E. Chater)
チームリーダー 合田裕紀子(ごうだゆきこ)
生命機能科学研究センター
バイオインフォマティクス研究開発チーム
上級研究員 笹川洋平(ささがわようへい)
テクニカルスタッフ 芳村美佳(よしむらみか)
テクニカルスタッフ(研究当時) 田中かおり(たなかかおり)
チームリーダー 二階堂愛(にかいどういとし)
リーバー脳発達研究所/ジョンズ・ホプキンス大学 医学部
研究員 カイノン・ベンジャミン(Kynon J. M. Benjamin)
助教 アプア・パクウォラ(Apuã C. M. Paquola)
助教 ジェニファー・エルウィン(Jennifer A. Erwin)
研究支援
本研究は、日本学術振興会(JSPS)科学研究費補助金若手研究B「一卵性双生児不一致例のiPS細胞由来神経細胞を用いた双極性障害の分子病態解明(研究代表者:澤田知世)」、「一卵性双生児不一致例iPS細胞由来脳オルガノイドを用いた精神疾患の病態解明(研究代表者:澤田知世)」、科学技術振興機構(JST)戦略的創造研究推進事業(CREST)「[1細胞]統合1細胞解析のための革新的技術基盤(研究統括:菅野純夫)」の研究課題「臓器・組織内未知細胞の命運・機能の1細胞オミクス同時計測(研究代表者:二階堂愛)」、JSTおよび日本医療研究開発機構(AMED)再生医療実現拠点ネットワークプログラム「iPS・分化細胞集団の不均質性を1細胞・全遺伝子解像度で高速に測定する技術の開発(研究代表者:二階堂愛)」、AMEDゲノム医療実現推進プラットフォーム事業「精神疾患のゲノム医療実現に向けた統合的研究(代表者:加藤忠史)」およびJSPS科学研究費補助金新学術領域「マルチスケール精神病態の構成的理解(領域代表者:林朗子)」の研究課題「双極性障害・統合失調症のトランスオミックス・モデリングによる構成的理解(研究代表者:加藤忠史)」などによる支援を受けて行われました。
背景
統合失調症や双極性障害(躁うつ病)をはじめとする精神疾患は、患者の生活の質を低下させるため、病態解明や新たな診断・治療法の開発が強く求められる脳の疾患です。大規模なゲノムワイド関連解析[11]や網羅的遺伝子発現解析[12]、患者の死後脳や患者由来iPS細胞から分化誘導した神経細胞を用いた研究を通して、疾患リスクの同定や病態解明が精力的に進められています。
しかし、疾患の発症に関わる分子・細胞レベルの詳細なメカニズムについては、まだ不明な点が多く残っています。その理由として、患者それぞれが持つ遺伝的背景に多様性があること、生きている患者の疾患発症前の脳を直接分子・細胞レベルで調べる方法がないことが挙げられます。
研究手法と成果
国際共同研究グループは、遺伝的多様性の影響を最小限に抑えるために、1人だけが精神疾患を発症した一卵性双生児のペア(一卵性双生児不一致例)に注目しました。まず、双極性障害の重症型である統合失調感情障害双極型(幻聴・妄想などの精神病症状を呈する時期がある)を発症した一卵性双生児不一致のペア(罹患双生児と健常双生児)からiPS細胞を樹立し、脳オルガノイドを作製することにより培養皿上でヒト脳の発達過程を再現しました(図1)。
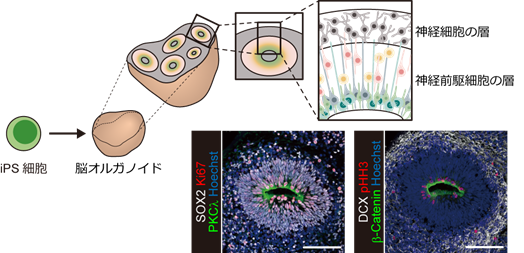
次に、国際共同研究グループのメンバーである笹川洋平上級研究員や二階堂愛チームリーダーらが2018年に開発し、本年の国際的な性能比較研究において世界最高成績を収めた高出力型1細胞RNAシーケンス法Quartz-Seq2[13]、注1、2)を用いて、培養開始35日目の脳オルガノイドの網羅的1細胞遺伝子発現解析を行いました。
その結果、患者(罹患双生児)由来の脳オルガノイドでは、健常双生児と比較して、抑制性神経細胞(GABA作動性神経細胞)への分化亢進が認められ(図2)、その背景として、脳の発達段階において多岐にわたり重要な役割を担うシグナル伝達系(Wntシグナル経路[14])の機能低下が示唆されました。患者由来脳オルガノイドの分化誘導初期にWntシグナル経路を活性化させると、健常双生児との間で抑制性神経細胞への分化能に差は認められなくなりました(図2)。このことから、患者の脳発達過程では初期のWntシグナル経路の機能低下により、神経前駆細胞の運命付けが変化することが分かりました。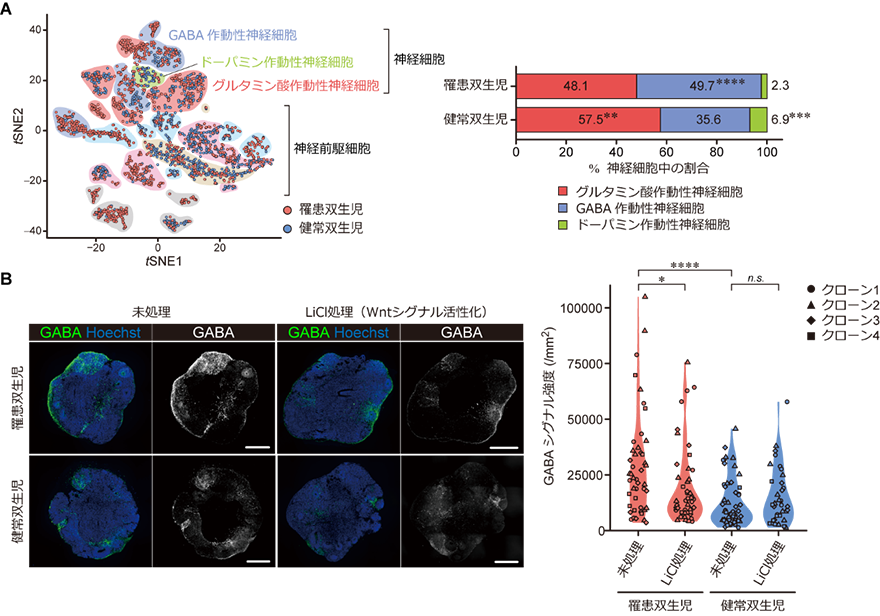
B:脳オルガノイドの抗GABA抗体を用いた蛍光免疫染色像(左)とGABA抗体のシグナル強度を定量したグラフ(右)。罹患双生児(患者)由来のオルガノイドは、健常双生児と比較してGABAを発現している細胞が多かったが、オルガノイド分化誘導初期にLiCl処理によりWntシグナルを活性化すると、未処理の場合と比較して明らかにGABAシグナル強度が低下(GABAを発現している細胞が減少)し、健常双生児との間に差は認められなくなった。解析には罹患双生児、健常双生児それぞれ4クローンのiPS細胞を用いた。(*p<0.05、****p<0.0001、n.s.、統計学的有意差なし)
次に、同じ一卵性双生児不一致例由来iPS細胞から2次元培養法[15]を用いて、成熟神経細胞を分化誘導し、培養開始120日目の細胞を用いて、患者と健常双生児の比較を行いました。その結果、患者由来の成熟神経細胞では、GABA作動性神経細胞の割合および抑制性シナプス[16]密度の増加と、興奮性シナプス[17]密度の減少が観察されました(図3)。また、脳オルガノイド同様、神経分化誘導初期にWntシグナル経路を活性化させると、これらの異常は改善されました。このことから、脳発達初期段階に生じた細胞運命付けの異常が、患者由来成熟神経回路における興奮性・抑制性神経細胞バランスの不均衡を引き起こすことが分かりました(図3)。
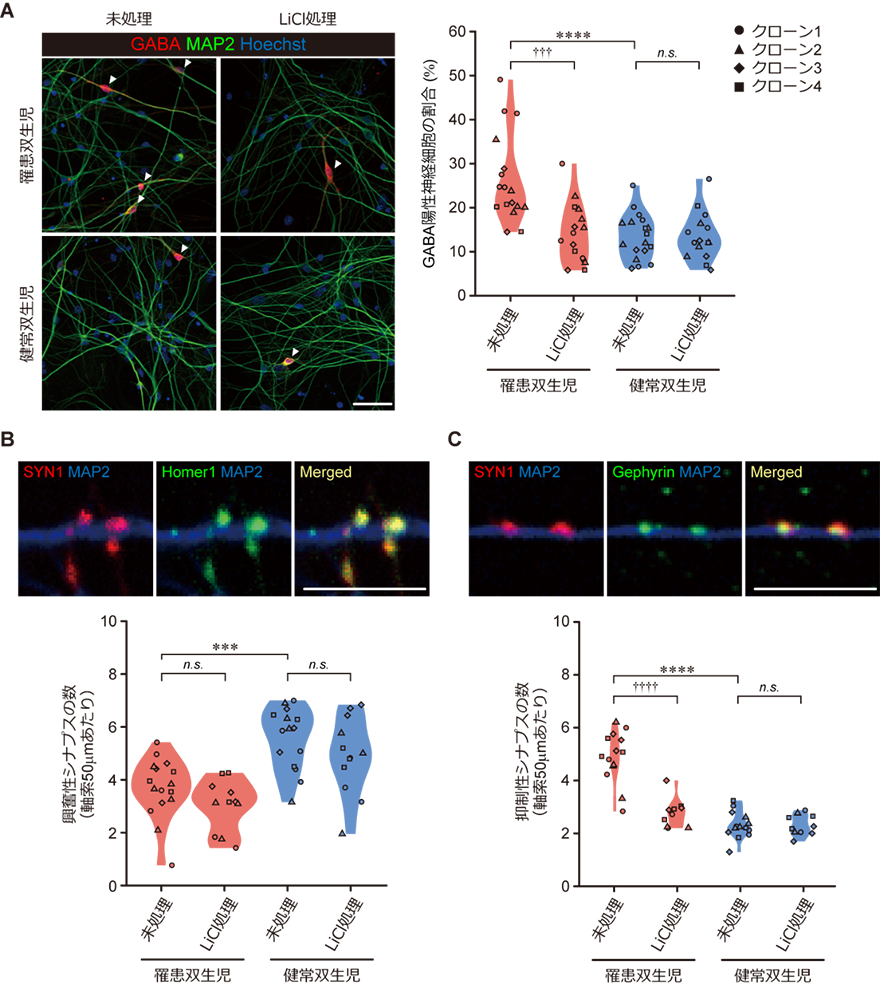
B:iPS細胞から2次元培養法を用いて分化誘導した、成熟神経細胞における興奮性シナプスの蛍光免疫染色像(SYN1はシナプス前細胞が発現するタンパク質、Homer1は興奮性シナプス後細胞が特異的に発現するタンパク質、MAP2は神経軸索を示す)(上)とSYN1陽性/Homer1陽性興奮性シナプス密度を定量したグラフ(下)。罹患双生児(患者)由来の成熟神経細胞では、健常双生児と比較して興奮性シナプスの密度が低下しており、分化誘導初期にLiCl処理によるWntシグナル活性化を行っても効果はなかった。(***p<0.001、n.s.、統計学的有意差なし)
C:抑制性シナプスの蛍光免疫染色像(Gephyrinは抑制性シナプス後細胞が特異的に発現するタンパク質)(上)とSYN1陽性/Gephyrin陽性興奮性シナプス密度を定量したグラフ(下)。罹患双生児(患者)由来の成熟神経細胞では、健常双生児と比較して抑制性シナプス密度が著しく増加していた。分化誘導初期にWntシグナルを活性化すると、密度は明らかに減少し、健常双生児との間に差は認められなくなった。(****p<0.0001、††††p<0.0001、n.s.、統計学的有意差なし)
さらに、統合失調症に関して不一致な2組の一卵性双生児から樹立したiPS細胞を用い、先の1組と合わせて計3組の一卵性双生児由来神経前駆細胞(培養開始24日目)の遺伝子発現解析を行い、GABA作動性神経細胞への分化・運命付けに関わる遺伝子の発現レベルを調べました。その結果、患者由来の細胞では、これらの遺伝子発現が健常双生児と比較して有意に増加していることを見いだしました。
これらの所見から、統合失調症や双極性障害などの精神疾患の発症には、脳の発達過程において抑制性神経細胞への分化を促進する神経前駆細胞のアンバランスな運命付けが関与していることが示されました。
注1)Sasagawa Y, et al., Quartz-Seq2: a high-throughput single-cell RNA-sequencing method that effectively uses limited sequence reads. Genome Biol. 2018. doi: 10.1186/s13059-018-1407-3.
注2)Mereu E, et al., Benchmarking Single-Cell RNA Sequencing Protocols for Cell Atlas Projects. Nat Biotechnol. 2020. doi: 10.1038/s41587-020-0469-4.
今後の期待
本研究では、脳発達初期における抑制性神経細胞の過剰分化が、精神疾患の発症に関与することを見いだしました。
これまで、統合失調症や双極性障害の患者の死後脳では、健常者と比較して抑制性神経細胞の数が減少していることが報告されており注3)、患者の脳内では、抑制性神経回路がうまく機能していない可能性が示唆されてきました。しかし、このような組織学的変化が疾患を引き起こす原因なのか、疾患や薬物治療による結果なのかは明らかになっていませんでした。
今回の研究結果から、統合失調症や双極性障害の患者脳内では、初期発達段階においてはむしろ抑制性神経細胞が過剰であり、疾患発症後の患者(死後脳)に認められる抑制性神経細胞の減少は、脳の発達過程において神経回路の興奮/抑制バランスを保つための代償性変化の結果である可能性が示唆されました。
一卵性双生児を比較することにより遺伝的多様性の影響を最小限に抑えた今回の研究を通して得られた結果は、神経細胞のアンバランスな運命付けが精神疾患の発症に関連することを強く示唆するものです。また、本研究は1細胞遺伝子発現解析の精神疾患研究への初の応用例であり、これらの成果は、精神疾患の分子・細胞レベルの病態解明やiPS細胞由来神経細胞を用いた治療法の開発などに貢献すると期待できます。
注3)Benes FM and Berretta S. GABAergic interneurons: implications for understanding schizophrenia and bipolar disorder. Neuropsychopharmacology. 2001. doi: 10.1016/S0893-133X(01)00225-1.
論文情報
- タイトル
- Developmental Excitation-Inhibition Imbalance Underlying Psychoses Revealed by Single-Cell Analyses of Discordant Twins-Derived Cerebral Organoids
- 著者名
- Tomoyo Sawada, Thomas E. Chater, Yohei Sasagawa, Mika Yoshimura, Noriko Fujimori-Tonou, Kaori Tanaka, Kynon J. M. Benjamin, Apuã C. M. Paquola, Jennifer A. Erwin, Yukiko Goda, Itoshi Nikaido, Tadafumi Kato
- 雑誌
- Molecular Psychiatry
- DOI
- 10.1038/s41380-020-0844-z
補足説明
- [1]一卵性双生児
- 基本的に全く同じ遺伝情報(遺伝子型)を持っている双子(ふたご)。
- [2]iPS細胞
- 脊椎動物の初期胚が持つ、全ての種類の体細胞へ分化する能力を多能性という。多能性を持ち、試験管内で培養して無限に増やすことができる細胞を多能性幹細胞という。iPS細胞は、皮膚や血液などの体細胞・組織から採取した細胞にOct3/4、Sox2、Klf4遺伝子などを導入して初期化し、人工的に多能性を獲得させた幹細胞である。
- [3]脳オルガノイド
- オルガノイドとは、生体内で存在する器官に類似した培養環境で生み出す組織構造体のことであり、近年盛んに研究が進んでいる技術領域である。脳オルガノイドは、ES(胚性幹)細胞やiPS細胞から3次元で分化誘導した脳組織を指し、2013年に理研CDBの笹井芳樹博士(当時)やオーストラリアIMBAのJürgen Knoblich博士らのグループによって開発された。2次元培養法を用いた神経分化誘導と比べて、より生体内に近い細胞同士の相互作用を再現できる。小頭症や滑脳症、自閉症などの疾患モデルが報告されている。
- [4]興奮性神経細胞
- 神経細胞のうち神経伝達物質としてグルタミン酸などを持ち、他の神経細胞を興奮させる機能を持つもの。グルタミン作動性の興奮性神経細胞は大脳皮質や海馬などに多数存在し、投射ニューロンとして速い興奮性伝達を担う。
- [5]抑制性神経細胞、GABA作動性神経細胞
- 抑制性神経細胞は、神経細胞のうち神経伝達物質としてGABAあるいはグリシンを持つ細胞で、興奮性神経細胞からの出力を調整したり、同期性を制御したり、過剰興奮を防ぐなど重要な機能を持つ。大脳皮質では約20%の神経細胞が、GABAを神経伝達物質として持つGABA作動性神経細胞である。
- [6]統合失調症
- 幻覚や妄想、意欲の低下、感情の平板化などを主要な症状とする主要な精神疾患の一つ。発症後には社会的機能の低下を伴うことが多い。ドーパミンと呼ばれる神経伝達物質の作用を抑える薬剤の投与が治療の中心となるが、その治療効果は不十分であったり、再燃を繰り返すうちに次第に重篤化したりすることも多い。生涯罹患率は人口の約1%と比較的高い。
- [7]双極性障害(躁うつ病)
- 躁状態・うつ状態を繰り返す主要な精神疾患の一つ。リチウムなどの治療が再発予防に有効だが、副作用のため中断し、再発を繰り返す患者も少なくない。躁状態について本人や周囲が知識不足のために、治療が遅れることもある。統合失調症同様、生涯罹患率は人口の約1%と比較的高い。
- [8]統合失調感情障害双極型
- 統合失調感情障害は、統合失調症の症状と気分障害(うつ状態や躁状態)の症状の両方を認める精神疾患。躁病エピソード(および大うつ病エピソード)を呈する双極型と大うつ病エピソードのみを呈する抑うつ型に分かれ、双極型は、家族歴、治療反応など多くの面で双極性障害に類似した特徴を持つ。
- [9]神経前駆細胞
- 神経系の未分化細胞であり、限られた分裂回数の後に分化を遂げるように運命付けられた細胞。
- [10]運命付け
- 細胞内外からの刺激によって、未分化な細胞のある特定の細胞種への分化が決定されること。発達初期段階の脳では、Wntをはじめとするさまざまな液性因子が濃度勾配を形成し、これによって細胞の運命付けが行われる。
- [11]ゲノムワイド関連解析
- ゲノム中の数十万から数百万の一塩基多型(single nucleotide polymorphism:SNP)を網羅的に調べ上げ、疾患の有無や身長・体重などの形質との関連するゲノム領域を同定する研究手法。統合失調症に関しては145ゲノム領域、双極性障害に関しては30ゲノム領域が同定されている。
- [12]網羅的遺伝子発現解析
- 細胞集団や組織サンプルを用いて、DNAから転写されるRNAをシーケンサーで配列決定し、網羅的かつ定量的にその量や種類を決定する方法。
- [13]高出力型1細胞RNAシーケンス法Quartz-Seq2
- 1細胞中に含まれるRNAをDNAシーケンサーで配列決定し、網羅的かつ定量的にその量や種類を決定する方法。微量なRNAを用いるため、微量RNAからcDNAを合成する「逆転写反応」と、シーケンス可能な量までcDNAを増幅させる「全cDNA増幅法」の二つのステップからなる。大量の1細胞由来のRNAをシーケンスできる技術を高出力型1細胞RNAシーケンスと呼ぶ。Quartz-Seq2(クォーツ・セックツー)は、数千から数万個の1細胞由来のRNAをシーケンスすることで、細胞の機能や特徴を明らかにできる計測手法。
- [14]Wntシグナル経路
- Wntは分泌性のタンパク質であり、受容体と結合して細胞内の3種類のシグナル伝達経路を活性化させる。なかでもb-カテニン経路は、増殖や分化を制御することによりさまざまな細胞の運命決定に関わることが知られている。双極性障害の治療薬であるリチウムは、GSK3b(リン酸化酵素)を阻害することで、このb-カテニン経路を活性化することが知られている。
- [15]2次元培養法
- 一般的な細胞培養方法。培養皿などを用いて、細胞を培地中で2次元的に増殖させる。外的な刺激や薬剤処理などに対する反応を評価する上で簡便な方法であるが、3次元的に増殖し組織や臓器を形成する生体内の細胞とは異なる点も多い。
- [16]抑制性シナプス
- シナプスとは、神経情報を出力する側と入力される側の間に発達した、情報伝達のための接触構造である。出力する側の細胞をシナプス前細胞、入力される側の細胞をシナプス後細胞といい、情報伝達に神経伝達物質を用いるシナプスを化学シナプスという。伝達される情報の種類により、化学シナプスは興奮性シナプスと抑制性シナプスに大別される。抑制性シナプスでは、シナプス前細胞の発火がシナプス後細胞の発火を抑制(過分極)する。抑制性シナプスの神経伝達物質としてはGABAやグリシンが知られている。
- [17]興奮性シナプス
- シナプス前細胞の発火がシナプス後細胞の興奮(脱分極)を促す化学シナプスの一つ。神経伝達物質としてはグルタミン酸が有名である。
発表者・機関窓口
発表者
理化学研究所 脳神経科学研究センター 精神疾患動態研究チーム
研究員(研究当時) 澤田知世(さわだともよ)
チームリーダー 加藤忠史(かとうただふみ)
機関窓口
理化学研究所 広報室 報道担当
E-mail:ex-press“AT”riken.jp
*今般の新型コロナウイルス感染症対策として、理化学研究所では在宅勤務を実施しておりますので、メールにてお問い合わせ願います。
AMED事業に関するお問い合せ
日本医療研究開発機構(AMED)
ゲノム・データ基盤事業部 ゲノム医療基盤研究開発課
ゲノム医療実現推進プラットフォーム事業(先端ゲノム研究:GRIFIN)担当
E-mail:genome-platform“AT”amed.go.jp
※E-mailは上記アドレス“AT”の部分を@に変えてください。
掲載日 令和2年8月7日
最終更新日 令和2年8月7日


