プレスリリース ピロリ菌が胃炎を引き起こすメカニズムを解明―抗生物質による除菌に代わる治療法開発に期待―
プレスリリース
大阪大学
日本医療研究開発機構
研究成果のポイント
- ピロリ菌は全世界人口の50%が感染し、胃炎※1・胃がんを起こすことが知られていたが、その分子機構はよく分かっていなかった
- ピロリ菌が宿主の脂質(コレステロール)を修飾し、胃炎を増強する糖脂質を作り出すことを発見
- ピロリ菌によるコレステロールの修飾を抑えることで、抗生物質に代わる胃炎、胃がんの治療法に繋がることが期待される
概要
大阪大学微生物病研究所山崎晶教授らの研究グループは、ヘリコバクター・ピロリ(いわゆるピロリ菌)※2が胃炎を引き起こすメカニズムを明らかにしました。本研究グループは、ピロリ菌が宿主のコレステロールを取り込んだ後、菌内で糖と脂質を付加することで、胃炎を誘導する化合物を作り出していることを発見しました。この修飾経路を阻害することで、ピロリ菌による胃炎を防ぐことが可能になり、抗生物質による除菌に代わる治療法に繋がることが期待されます。本研究成果は、米国科学誌「Journal of Experimental Medicine」に2020年9月29日(火)に公開されます。
研究の背景
ヘリコバクター・ピロリ(ピロリ菌)は、世界人口の約50%に感染している病原体です。ピロリ菌が感染すると、胃炎、胃がんの発症リスクが高まることから、抗生物質による除菌が推奨されています。ところが、近年、除菌による耐性菌の出現や、細菌叢バランスの破綻が問題となっており、併用や代替可能な新たな治療法が望まれていました。さらに、ピロリ菌が胃炎を発症する機構も不明でした。
研究の内容
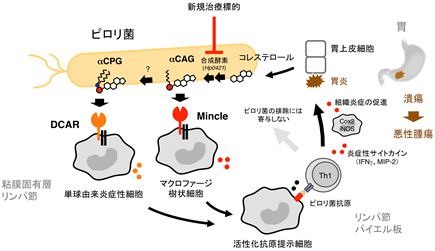
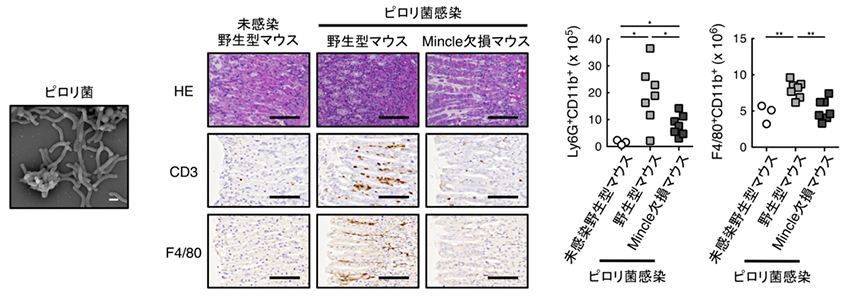
本研究グループはまず、胃炎にT細胞活性化が必要なことに注目しました。T細胞活性化には、樹状細胞活性化が必要ですが、ピロリ菌は、樹状細胞を活性化させる自然免疫受容体(TLR)のリガンドの形を巧妙に変えて、この受容体から逃れる能力を持っていることから、どのようにして樹状細胞を活性化させているのかは不明でした。本研究グループは、ピロリ菌が持つ樹状細胞を活性化する物質を生化学的に分離、精製することに成功しました(図1)。
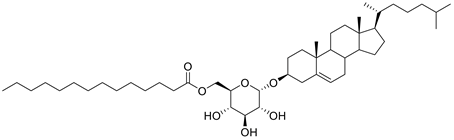
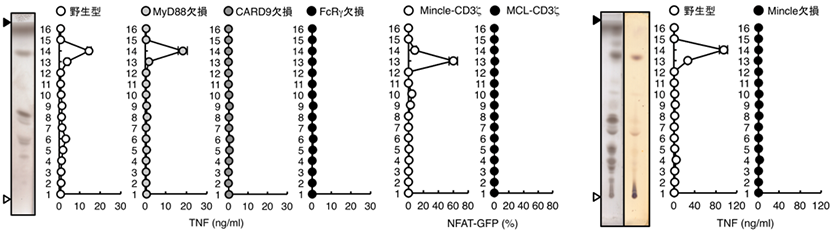
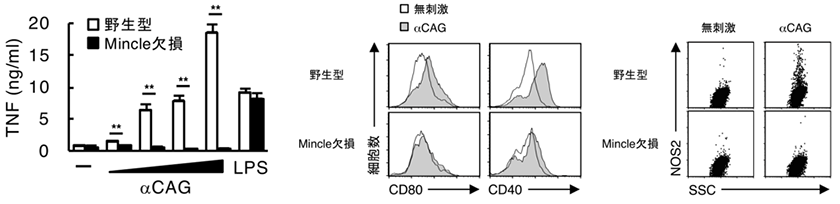
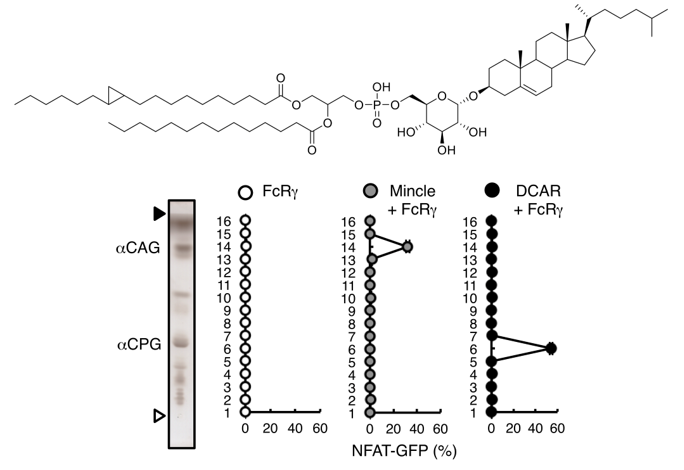
単離された活性化物質は、ピロリ菌が宿主のコレステロールを改変して産生するピロリ菌特有の糖脂質、α-コレステリルグルコシド(α-cholesterylglucoside, αCAG)で(下図)、宿主の免疫受容体Mincle※3に認識されて免疫系を活性化することも分かりました(図2)。さらにMincleを欠損するマウスにピロリ菌を感染させると、抗原特異的T細胞活性化及び胃炎が抑制されることが判明しました(図3)。
この胃炎抑制効果は、野生型マウスに抗Mincle抗体を投与することでも観察されたことから、Mincleの阻害が治療に繋がることも示されました。
また、αCAGと構造が類似するものの、これまで機能が全く分かっていなかったピロリ菌糖脂質、α-コレステリルホスファチジルグルコシド(α-cholesteryl phosphatidylglucosides, αCPG)が、Mincleと同じファミリーに属する免疫受容体DCAR※4に認識され、同様に免疫系を活性化することが判明しました(図4)。αCAGとαCPGの両方を合成できないコレステリルグルコシルトランスフェラーゼ※5欠損ピロリ菌を感染させたマウスでは、胃炎が軽減されたことから、これらの糖脂質が胃炎を引き起こす原因物質であることが明らかになりました。
すなわち、ピロリ菌が宿主のコレステロールを取り込み、菌体内でαCAGとαCPGといった炎症誘導化合物に変換することで胃炎を引き起こす、という一連の分子メカニズムが初めて明らかになりました。
宿主側でこれらの受容体の働きをブロックすることや、ピロリ菌でこの糖脂質の生成に必要な酵素(コレステリルグルコシルトランスフェラーゼ)を阻害することが、抗生物質と併用可能な、或いは抗生物質に取って代わる、新たな胃炎・胃がん発症を抑える治療標的として期待されます。
特記事項
本研究成果は、2020年9月29日(火)に米国科学誌「Journal of Experimental Medicine」(オンライン)に掲載されます。
- タイトル:
- “Helicobacter pylori metabolites exacerbate gastritis through C-type lectin receptors”
- 著者名:
- M Nagata, K Toyonaga, E Ishikawa, S Haji, N Okahashi, M Takahashi, Y Izumi, A Imamura, K Takato, H Ishida, S Nagai, P Illarionov, B Stocker, M Timmer, D Smith, S Williams, T Bamba, T Miyamoto, M Arita, B Appelmelk and S Yamasaki
なお、本研究は、科学研究費補助金、日本医療研究開発機構(AMED)革新的先端研究開発支援事業(AMED-CREST)『画期的医薬品等の創出をめざす脂質の生理活性と機能の解明』研究開発領域(研究開発総括:横山信治)における研究開発課題「病原体糖脂質を介する新たな宿主免疫賦活機構の解明と感染症治療への応用(研究開発代表者:山崎晶)」の支援を受け、九州大学、理化学研究所、岐阜大学、慶應大学、オランダ、オーストラリア、ニュージーランド、イギリスの共同研究チームによって実施されました。
用語説明
- ※1 胃炎
- 胃の粘膜で起こる炎症のことを指し、過度な飲酒や喫煙、ストレスなどが原因となる「急性胃炎」と、ピロリ菌感染などに伴って起こる「慢性胃炎」に分けられる。特に、ピロリ菌感染による胃炎の場合、そのまま放っておくと、胃潰瘍や十二指腸潰瘍、萎縮性胃炎を引き起こし、その一部は胃がんに進展することが知られている。
- ※2 ヘリコバクター・ピロリ Helicobacter pylori
- 一般にピロリ菌と呼ばれる。胃の酸性環境下で生息することができる。世界人口の約50%の胃に生息しており、胃炎や胃がんの原因の一つとされ、抗生物質による除菌治療が推奨されている。オーストラリアのJohn Robin WarrenとBarry James Marshallによって1983年に発見され、両氏は 2005年にノーベル医学・生理学賞を受賞している。
- ※3 Mincle
- 様々な刺激やストレスによって、マクロファージに発現が誘導される活性化型C型レクチン受容体(macrophage-inducible C-type lectin)。アダプター分子であるFcRγと会合し、細胞内にシグナルを伝達する。樹状細胞にも発現しており、病原体や死細胞由来の糖脂質を認識し、免疫応答を活性化する。
- ※4 DCAR
- 単球由来炎症性細胞や一部の樹状細胞に発現している活性化型C型レクチン受容体。FcRγと会合して、細胞内に活性化シグナルを伝達する。これまで知られていたリガンドは結核菌由来のホスファチジルイノシトールマンノシドのみであった。
- ※5 コレステリルグルコシルトランスフェラーゼ Hp0421
- ピロリ菌、および一部のヘリコバクター属のみに存在するユニークな糖転移酵素であり、宿主から奪ったコレステロールにグルコースを付加することで、αCAGやαCPGの生合成において必須の役割を担う。
お問い合わせ先
本件に関する問い合わせ先
大阪大学微生物病研究所 教授 山崎晶(やまさきしょう)
TEL:06-6879-8306 FAX:06-6879-8308
E-mail:yamasaki“AT”biken.osaka-u.ac.jp
日本医療研究開発機構に関するお問い合わせ
日本医療研究開発機構(AMED)
シーズ開発・研究基盤事業部 革新的先端研究開発課
E-mail:kenkyuk-ask“AT”amed.go.jp
※E-mailは上記アドレス“AT”の部分を@に変えてください。
関連リンク
掲載日 令和2年9月30日
最終更新日 令和2年9月30日


