タンパク質を増やすSINEUPのメカニズムを解明―核酸医薬品への応用にさらなる期待―
プレスリリース
理化学研究所
横浜市立大学
日本医療研究開発機構
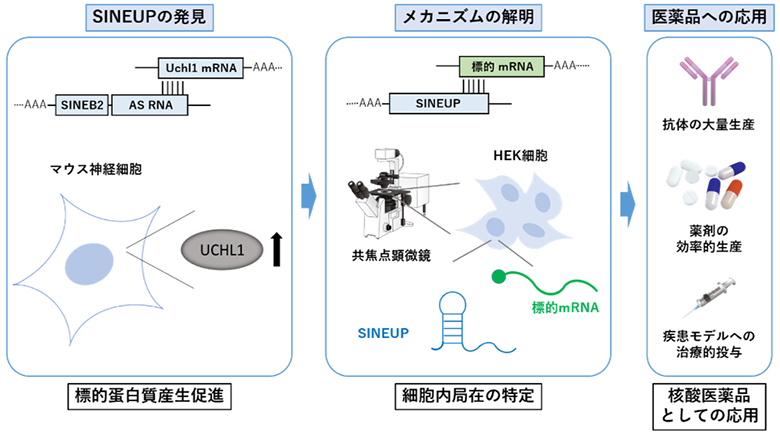
理化学研究所(理研)生命医科学研究センタートランスクリプトーム研究チームの土岐直子研究パートタイマー(横浜市立大学大学院生命医科学研究科博士後期課程)、高橋葉月特別任期制研究員(同客員研究員)、ピエロ・カルニンチチームリーダー(同客員教授)らの国際共同研究グループ※は、タンパク質合成を促進するアンチセンスRNAとして発見された機能性ノンコーディングRNA[1]「SINEUP[2]」が、標的メッセンジャーRNA(mRNA)[3]の翻訳を促進する際、SINEUP結合タンパク質とともに細胞内を移動し、翻訳開始複合体に働きかけていることを発見しました。
本研究成果は、ハプロ不全[4]が原因とされる疾患の遺伝子治療に応用が期待されているSINEUPの細胞内挙動の確認、さらには抗体医薬[5]の生産性の向上に役立ち、医薬品開発に貢献すると期待できます。
今回、国際共同研究グループは、標的mRNAとSINEUPの細胞内局在、およびそれらと結合するタンパク質との相互関係を調べました。細胞核内、細胞質内での詳細な調査の結果、標的mRNAとSINEUPが細胞質で共局在することが必須であることが分かりました。さらに、SINEUPにRNA結合タンパク質であるPTBP1タンパク質とHNRNPKタンパク質が結合して3者複合体を形成することで、SINEUPの細胞核から細胞質への移動が可能となり、それらの結合体が標的mRNAの翻訳開始を促進していることを明らかにしました。
本研究は、科学雑誌『Nucleic Acids Research』オンライン版(2020年11月2日付)に掲載されます。
- ※国際共同研究グループ
- 理化学研究所 生命医科学研究センター トランスクリプトーム研究チーム
チームリーダー ピエロ・カルニンチ(Piero Carninci)(横浜市立大学 大学院生命医科学研究科 機能ゲノム科学研究室 客員教授)
特別任期制研究員 高橋葉月(たかはしはづき)(横浜市立大学 大学院生命医科学研究科 機能ゲノム科学研究室 客員研究員)
研究パートタイマー 土岐直子(ときなおこ)(横浜市立大学 大学院生命医科学研究科 機能ゲノム科学研究室 博士後期課程)
研究員 ハルシタ・シャルマ(Harshita Sharma)
研究員 マシュー・バレンタイン(Matthew NZ Valentine)
特別研究員(研究当時) フェルドス・ラマン(M Ferdous-Ur Rahman)
ピエモンテ大学 Health science部門(研究当時) 准教授 シルビア・ズッケリ(Silvia Zucchelli)
イタリア工科大学 Central RNA Laboratory部門 部門長 ステファノ・グスティンチッチ(Stefano Gustincich) - 研究支援
- 本研究の一部は、日本学術振興会(JSPS)科学研究費補助金若手研究「タンパク質の翻訳を促進するレトロトランスポゾンSINEの作用機序の解明(研究代表者:高橋葉月)」、日本医療研究開発機構(AMED)革新的バイオ医薬品創出基盤技術開発事業「タンパク質翻訳を促進する新規ノンコーディングRNAを用いた革新的創薬プラットフォームの構築(研究代表者:カルニンチ・ピエロ)」による支援を受けて行われました。
背景
通常、ノンコーディングRNAはタンパク質には翻訳されず、主にDNAやRNAの発現を調節する役割を果たすと考えられています。また、ヒトゲノムの半分以上のRNAがノンコーディングRNAとして発現していますが、その大部分はどのような機能を果たしているのか解明されていません。ピエロ・カルニンチチームリーダーらは、長鎖ノンコーディングRNA[1]の一つである「SINEUP」がタンパク質への翻訳機能を調整していることを2012年に発見し注1)、現在までその機能について詳しく調べてきました注2-4)。
SINEUPはその名にもあるように、内部に含まれるレトロトランスポゾン[6]の一種であるSINE[7]が翻訳を促進(UP)することから名付けられました。SINEUPはその一部にSINEを含んでいますが、SINE以外の部分に存在するアンチセンス領域[3]の役割も、標的メッセンジャーRNA(mRNA)の翻訳機能を調節するために重要と考えられます。また、SINEは細胞核内に局在することが知られていますが、翻訳は細胞質で行われるため、核から細胞質へ移動する必要があります。RNAの細胞内移動のメカニズムは、主としてRNAそれ自体が単独で動くというよりも、移動を手助けするタンパク質と複合体を形成して動くことが多く報告されています。
そこで、国際共同研究グループは、SINEUPがいかにして細胞核から細胞質へ移動し、翻訳を促進する相手であるmRNAを見つけ出し、その翻訳に働きかけているのか調べました。
注1)2012年10月25日理化学研究所プレスリリース「タンパク質合成を促進するアンチセンスRNAを初めて発見」
注2)2016年10月28日理化学研究所プレスリリース「タンパク質合成を促進する「ジャンク」と呼ばれていたRNA」
注3)2018年3月15日理化学研究所プレスリリース「翻訳を促進するアンチセンスRNAの機能解析」
注4)2020年8月6日理化学研究所プレスリリース「タンパク質を増やす秘訣に迫る」
研究手法と成果
国際共同研究グループはまず、SINEUPおよび標的mRNAが細胞内のどの場所に局在するのかを、RNA FISH法[8]を用いて調べました。その結果、SINEUPは細胞核と細胞質の両方に、標的mRNAは主に細胞質に局在していることが判明しました。さらに細胞質では、SINEUPと標的mRNAが共局在していることが分かりました(図1右、標的mRNA、SINEUPの細胞質での共局在)。続いてSINEUPの機能を確認した結果、SINEUPと標的mRNAが細胞質で共局在する割合が高いほど、SINEUPは標的mRNAの翻訳を促進していることが分かりました。
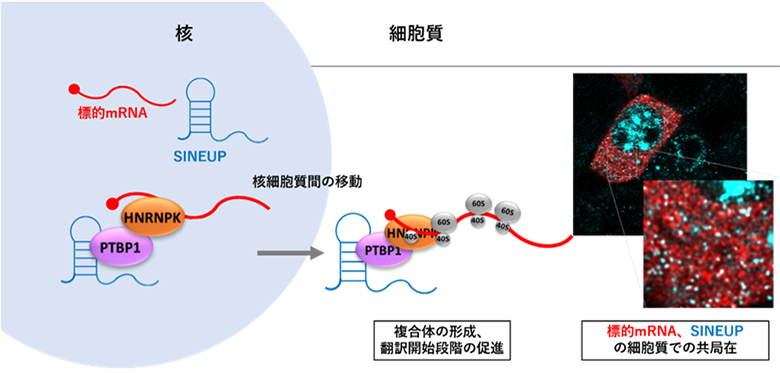
次に、SINEUPおよび標的mRNAに結合するタンパク質をChIRP-MS法[9]で解析したところ、共局在している場所では、HNRNPKタンパク質とPTBP1タンパク質が結合し、複合体を形成していることが分かりました。また、その複合体が核から細胞質に移動することで、SINEUPと標的mRNAが細胞質で共局在し、翻訳を促進していることが明らかになりました(図1左、核細胞質間の移動)。
さらに、PTBP1タンパク質とHNRNPKタンパク質をそれぞれ過剰発現させた条件下で、翻訳に関与するポリソーム[10]分画を解析したところ、SINEUPが存在する細胞では、存在していない細胞に比べ、重いポリソーム分画に標的mRNAが移行していることが観察されました。また、SINEUPに関しても、翻訳開始段階のポリソーム分画に存在していることが観察されました(図1左、複合体の形成、翻訳開始段階の促進)。
また、HNRNPKタンパク質、PTBP1タンパク質がSINEUPのどの領域に結合しているかをeCLIP解析法[11]で確認したところ、両タンパク質ともに、SINEUPが標的mRNAに結合するアンチセンス領域に結合していることが分かりました。この結果は、「SINEUPが標的mRNAとアンチセンス領域で結合すること」だけでなく、「SINEUPが結合タンパク質ともアンチセンス領域で結合し、三者で複合体を形成すること」が翻訳を促進するためには重要という、新たな知見につながりました。
今後の期待
SINEUPは核酸医薬[12]としての応用開発が行われている分子であり、主に疾病原因タンパク質の生産量が少ないという理由で発症する、ハプロ不全などが原因で引き起こされる希少疾患への治療応用が期待されています。
SINEUPが細胞質内で、結合タンパク質とアンチセンス領域で複合体を形成し、標的mRNAの翻訳を加速している、という今回の発見は、核酸医薬(医薬品)として、SINEUPのアンチセンス領域をデザインする上で重要な知見につながりました。
SINEUPは、大量生産が難しいとされている抗体医薬の生産を増加できる可能性を秘めています。今回得られた、HNRNPKタンパク質およびPTBP1タンパク質を細胞内で増加させるとSINEUPの効果が増加するという結果は、抗体医薬の生産性の向上だけでなく、今後核酸医薬(医薬品)として、SINEUPを開発するうえで重要な足掛かりになると考えられます。
論文情報
- タイトル
- SINEUP long non-coding RNA acts via PTBP1 and HNRNPK to promote translational initiation assemblies
- 著者名
- Toki Naoko, Takahashi Hazuki, Sharma Harshita, Valentine NZ Matthew, Rahman M Ferdous-Ur, Zucchelli Silvia, Gustincich Stefano and Carninci Piero Carninci
- 雑誌
- Nucleic Acids Research
- DOI
- 10.1093/nar/gkaa814
補足説明
- [1]ノンコーディングRNA、長鎖ノンコーディングRNA
- ノンコーディングRNAは、遺伝子をコードしていないRNA全般を指す。転位RNA(tRNA)やリボソームRNA(rRNA)もノンコーディングRNAの一種である。トランスクリプトーム解析により、ヒト細胞中に存在するRNAの7割がノンコーディングRNAであること、ヒトゲノムの9割以上のノンコーディング領域がRNAに転写されることが近年になって示された。転写、RNAプロセッシング、RNA分解、翻訳などの遺伝子発現のさまざまな段階に影響を与える。ノンコーディングRNAのうち、200塩基以上のものを長鎖ノンコーディングRNAという。
- [2]SINEUP
- SINEUPは、マウスのUchl1遺伝子のアンチセンスRNAがUchl1タンパク質の合成を促進する現象の発見をきっかけに見いだされた新しいタイプの長鎖ノンコーディングRNA。SINE因子の配列を持ち、タンパク質翻訳を促進する「機能ドメイン」と、標的mRNAと相補的な配列を持つ「結合ドメイン」の二つで構成される。任意の標的mRNAからのタンパク質翻訳を促進することができるツールとして使うことができるため、研究用試薬やタンパク質製造ツールから核酸医薬まで、幅広い応用が進んでいる。SINEUPはSINE element-containing translation UP-regulatorの略。
- [3]メッセンジャーRNA(mRNA)、アンチセンス領域
- DNAの配列として書かれた遺伝情報はRNAに転写される。タンパク質をコードするメッセンジャーRNA(mRNA)のように、意味を持つ配列として転写されたRNAをセンスRNAと呼ぶのに対し、それと相補的な配列を持つRNAをアンチセンスRNA(アンチセンス領域)と呼ぶ。
- [4]ハプロ不全
- 2倍体の生物であるヒトは、二つある対立遺伝子のうち一つが正常であれば十分量のタンパク質が作られ、多くの場合は表現型として影響が現れない。これに対し、正常な遺伝子が一つだけでは十分なタンパク質量が生産できず、機能を維持できない現象をハプロ不全と呼ぶ。このとき、正常な遺伝子から転写されるmRNAを標的とするSINEUPを細胞に導入すれば、タンパク質の合成量が増加し機能を回復できると期待される。
- [5]抗体医薬
- 抗体は、抗原に対して非常に強く結合するタンパク質である。疾患と関連した抗原に特異的に結合する抗体は治療効果を示す。抗体医薬は、がんやリウマチなどの治療に用いられるが、副作用の少ない効果的な治療薬として注目されており、病気と関連する抗原の探索も行われている。
- [6]レトロトランスポゾン
- HIVなどのレトロウイルスのように、DNA→RNAへの転写と、RNA→DNAへの逆転写によって増殖する性質を持つ遺伝因子。ゲノム上のレトロトランスポゾンが転写されてRNAになり、さらに逆転写酵素によりDNAに戻ることでゲノム中を移動しコピー数を増やす。ヒトゲノムの進化の過程で、ほとんどのレトロトランスポゾンは不活性化され、その残骸は機能しない「ジャンク」配列と長らく考えられていた。
- [7]SINE
- 短鎖散在反復配列とも呼ばれる。ゲノムの特定の塩基配列がコピーされ、これが再びゲノムに挿入されたもの。生物進化の過程において、ある生物のゲノムの特定の場所にSINEが挿入されると、これが子孫に受け継がれる。このことから、多数の生物のSINEを分析すると系統関係が分かる。SINEは、short interspersed nuclear elementの略。
- [8]RNA FISH法
- 調査対象のRNA配列に蛍光を発する核酸プローブをハイブリダイズすることで、RNAの発現している位置の分布を調べる方法。FISHはFluorescent In Situ Hybridizationの略。
- [9]ChIRP-MS法
- 細胞内に発現する、調査対象のRNAに結合するタンパク質を網羅的に調べる技術。まず、RNA配列に細胞内で核酸プローブをハイブリダイズし、結合するタンパク質を抽出する。その後、Mass Spectrometry(質量分析装置)にて結合タンパク質を分析し、解析する。ChIRP-MSはComprehensive identification of RNA-binding proteins by mass spectrometryの略。
- [10]ポリソーム
- 翻訳が行われる場であるリボソームがmRNAに集合した状態をいう。通常、タンパク質のもとであるペプチド鎖がmRNAから翻訳され、伸長を開始する段階からのリボソーム集合体をポリソームと呼ぶ。
- [11]eCLIP解析法
- eCLIP解析法はRNA結合タンパク質がRNAに結合する領域を網羅的に決定する技術。バイオインフォマティクスの解析技術を使用することで、タンパク質が結合するRNAを一塩基ごとに決定できる。eCLIPはenhanced version of the crosslinking and immunoprecipitationの略。
- [12]核酸医薬
- DNAやRNAを用いた医薬品。塩基の相補性を利用して特定の配列を持つDNAやRNAに作用させたり、2本鎖DNAや折り畳まれた核酸がとる立体構造を利用して特定のタンパク質と結合させるなど、核酸の持つ性質を応用したもの。
発表者・機関窓口
発表者
理化学研究所 生命医科学研究センター トランスクリプトーム研究チーム
研究パートタイマー 土岐直子(ときなおこ)
(横浜市立大学 大学院生命医科学研究科 機能ゲノム科学研究室 博士後期課程)
特別任期制研究員 高橋葉月(たかはしはづき)
(横浜市立大学 大学院生命医科学研究科 機能ゲノム科学研究室 客員研究員)
チームリーダー ピエロ・カルニンチ(Piero Carninci)
(横浜市立大学 大学院生命医科学研究科 機能ゲノム科学研究室 客員教授)
機関窓口
理化学研究所 広報室 報道担当
E-mail:ex-press“AT”riken.jp
*今般の新型コロナウイルス感染症対策として、理化学研究所では在宅勤務を実施しておりますので、メールにてお問い合わせ願います。
横浜市立大学 広報室
E-mail:koho“AT”yokohama-cu.ac.jp
AMED事業に関するお問い合わせ
国立研究開発法人日本医療研究開発機構(AMED)
創薬事業部 医薬品研究開発課 先端的バイオ創薬等基盤技術開発事業担当
TEL:03-6870-2219
E-mail:sentan-bio“AT”amed.go.jp
※E-mailは上記アドレス“AT”の部分を@に変えてください。
関連リンク
掲載日 令和2年11月2日
最終更新日 令和2年11月2日


