ドナー細胞のキメリズムを異種キメラ体内にて飛躍的に上昇させることに成功
プレスリリース
東京大学
スタンフォード大学
日本医療研究開発機構
発表者
西村俊哉(東京大学医科学研究所 附属幹細胞治療研究センター 日本学術振興会 特別研究員)
中内啓光(東京大学医科学研究所 幹細胞治療部門 特任教授)
発表のポイント
- ドナー細胞のキメリズム(注1)を飛躍的に上昇させることに、げっ歯類にて成功した。
- 胎生致死(注2)を誘導することなくドナー細胞のキメリズムを異種キメラ体内にて上昇させることもできた。
- 異種体内でドナー細胞由来臓器を作製する研究への応用が期待される。
発表概要
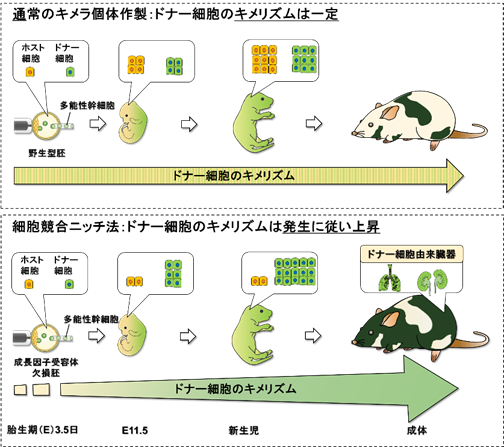
東京大学医科学研究所東京大学特任教授部門幹細胞治療部門の中内啓光特任教授(スタンフォード大学教授兼任)、東京大学医科学研究所附属幹細胞治療研究センターの西村俊哉日本学術振興会特別研究員らの研究グループは、多能性幹細胞(ドナー細胞、注3)を着床前胚(ホスト胚、注4)に移植することで作製したキメラ胚(注5)において、ホスト胚の成長因子受容体を欠損させることでドナー細胞のキメリズムを飛躍的に上昇させる手法(細胞競合ニッチ法)を開発し、本手法を用いて、ほとんどドナー細胞で構成された臓器を作製することに成功しました。
これまでは異種間のキメラ作出において、高いドナーキメリズムは初期胚発生の段階で異種キメラ胚の胎生致死を誘導することから、高いドナーキメリズムを持つキメラを得ることができませんでした。本研究により開発した手法は、胚発生後期からドナーキメリズムを上昇させることから、胎生致死を誘導することなく異種キメラ体内にてドナー細胞のキメリズムを上昇させることを可能にしました。今回の成果により、これまで問題とされていたドナー細胞の異種組織への低寄与率を改善できる可能性が示され、中内特任教授らのグループが目指す胚盤胞補完法(注6)を利用した臓器再生における問題が解決できるのではないかと考えられます。
本研究は、国立研究開発法人日本医療研究開発機構(AMED)の革新的先端研究開発支援事業インキュベートタイプ(LEAP)における研究開発課題「発生原理に基づく機能的立体臓器再生技術の開発」(研究開発代表者:中内啓光)、同AMED再生医療実現拠点ネットワークプログラム疾患・組織別実用化研究拠点(拠点C)における研究開発課題「動物生体内環境を利用した移植用ヒト臓器の開発」(研究開発代表者:中内啓光)ならびに日本学術振興会特別研究員制度の一環として行われました。
本研究成果は2020年12月28日付の米科学雑誌「Cell Stem Cell」オンライン版に掲載されます。
発表内容
中内特任教授らのグループは、これまでに多能性幹細胞のキメラ形成能を利用した「胚盤胞補完法」により、膵臓欠損マウスの体内にラット多能性幹細胞由来の膵臓を作製することに成功しています1、2。しかしながら遺伝的距離が離れた動物種間では、臓器作製に至っておりませんでした。近年、同グループは、ドナー細胞由来の臓器を異種体内で作製するには、ある一定以上のドナー細胞のキメリズム(ドナーキメリズム)が必要である一方、高すぎるドナーキメリズムは異種キメラ胚の初期発生を妨げ、これが遺伝的距離の離れた動物種間での臓器作製を困難としている一因であることを明らかにしました3。
本研究では、初期発生を妨げずにドナーキメリズムを上昇させる手法の開発を目的とし、胚発生後期から細胞の増殖・分化に重要な役割を持つインスリン様成長因子1受容体(Igf1r)に着目し、同種マウスキメラ胚においてホスト細胞のIgf1rを欠損させることでドナー細胞が優位に増殖・分化できるような微小環境(ニッチ)の誘導を試みました(図1)。その結果、本キメラ胚において胎生期10日頃から複数の臓器でドナーキメリズムの上昇がみられました。また、本キメラマウスを成体にて解析したところ、腎臓をはじめとして肺、脳がほとんどドナー細胞で構成されていることをいくつかの個体で確認しました(図2)。さらに、同様の手法を用いて、Igf1r欠損マウス胚にラット多能性幹細胞を移植し異種キメラ胚を作製したところ、ドナーキメリズムの上昇が異種キメラ胚においても確認され、その胚発生率に変化は見られませんでした(図3)。この結果から、ホスト胚のIgf1r欠損は、同種および異種キメラ胚の両方においてドナー細胞優位な微小環境(細胞競合ニッチ)を誘導することが明らかとなりました。また、細胞競合ニッチはドナーキメリズムを胚発生後期から上昇させることから、異種キメラ胚の初期発生を妨げないことがわかりました。
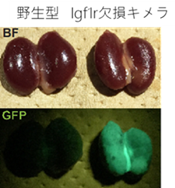
上:明視野、下:蛍光顕微鏡下(緑:ドナー細胞)
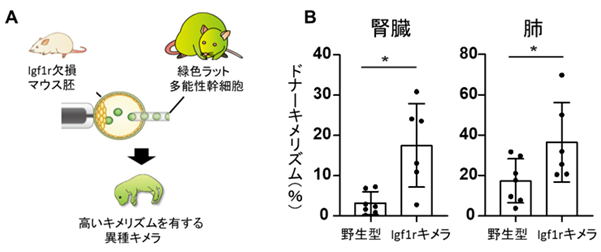
中内特任教授らのグループは胚盤胞補完法により異種動物体内にヒトの臓器を作製し、移植治療に用いることを目指しています。今回、臓器作製に足るドナーキメリズムを得ることが難しい動物種間においてもドナーキメリズムを上昇させうる手法を開発したことにより、異種体内でドナー細胞由来臓器を作製する研究への応用が期待されます。
- 引用文献
-
- Kobayashi, T., Yamaguchi, T., Hamanaka, S., Kato-Itoh, M., Yamazaki, Y., Ibata, M., Sato, H., Lee, Y.-S., Usui, J.-I., Knisely, A.S., et al. (2010). Generation of rat pancreas in mouse by interspecific blastocyst injection of pluripotent stem cells. Cell 142, 787-799.
- Goto, T., Hara, H., Sanbo, M., Masaki, H., Sato, H., Yamaguchi, T., Hochi, S., Kobayashi, T., Nakauchi, H., and Hirabayashi, M. (2019). Generation of pluripotent stem cell-derived mouse kidneys in Sall1-targeted anephric rats. Nat Commun 10, 451.
- Yamaguchi, T., Sato, H., Kobayashi, T., Kato-Itoh, M., Goto, T., Hara, H., Mizuno, N., Yanagida, A., Umino, A., Hamanaka, S., et al. (2018). An interspecies barrier to tetraploid complementation and chimera formation. Sci Rep 8, 15289-15289.
発表雑誌
- 雑誌名
- Cell Stem Cell オンライン版(米国東部時間2020年12月28日)
- 論文タイトル
- Generation of Functional Organs Using a Cell Competitive Niche in Intra-and Inter-species Rodent Chimeras
- 著者
- Toshiya Nishimura, Fabian P. Suchy, Joydeep Bhadury, Kyomi J. Igarashi, Carsten T. Charlesworth, Hiromitsu Nakauchi*(*corresponding author)
- DOI
- 10.1016/j.stem.2020.11.019
- URL
- https://www.cell.com/cell-stem-cell/fulltext/S1934-5909(20)30583-X
用語解説
- (注1)キメリズム
- 2つ以上の遺伝的背景の異なる細胞によって構成された生物(キメラ)体内での遺伝的背景の異なる細胞の割合。例、ドナー細胞のキメリズム:ドナー細胞のキメラ体内での割合。
- (注2)胎生致死
- 胚発生過程において、何らかの異常が起こり胚または胎子が死に至ること。
- (注3)多能性幹細胞(ドナー細胞)
- 胎盤などの組織(胚体外組織)を除く体中の様々な組織に分化する能力を持つ細胞。多能性幹細胞には2種類あり、受精卵に含まれる細胞を培養した細胞は「胚性幹細胞(ES細胞)」、体細胞に遺伝子を導入して人工的に樹立した細胞を「人工多能性幹細胞(iPS細胞)」という。
- (注4)着床前胚(ホスト胚)
- 母体子宮に着床する前の発生段階にある受精卵の総称。
- (注5)キメラ胚
- 2つ以上の遺伝的背景の異なる細胞によって構成された胚。1つの受精卵から異なる遺伝形質をもった細胞が出現するモザイク胚や、異なる遺伝形質を持つ動物同士の交配でできるハイブリッド胚とは異なる。キメラ胚は胚と胚の融合、胚への多能性幹細胞の注入により作製できる。
- (注6)胚盤胞補完法
- 遺伝的に臓器が欠損する動物の受精卵(胚盤胞)に正常な多能性幹細胞を注入しキメラ動物を形成することで、欠損していた臓器を注入した多能性幹細胞が補完し、臓器欠損動物の体内に完全に多能性幹細胞由来の臓器を再生させる方法。
お問い合わせ先
研究に関すること
東京大学医科学研究所 東京大学特任教授部門 幹細胞治療部門
特任教授 中内啓光(なかうちひろみつ)
Tel:03-5449-5330
E-mail:nakauchi“AT”g.ecc.u-tokyo.ac.jp
東京大学医科学研究所 附属幹細胞治療研究センター
日本学術振興会特別研究員 西村俊哉(にしむらとしや)
Tel:03-5449-5331
E-mail:sr205027“AT”g.ecc.u-tokyo.ac.jp
報道に関すること
東京大学医科学研究所 国際学術連携室(広報)
清水麻子
E-mail:koho“AT”ims.u-tokyo.ac.jp
AMED事業に関すること
国立研究開発法人日本医療研究開発機構(AMED)
再生・細胞医療・遺伝子治療事業部再生医療研究開発課
Tel:03-6870-2220
E-mail:saiseinw“AT”amed.go.jp
シーズ開発・研究基盤事業部 革新的先端研究開発課
Tel:03-6870-2224
E-mail:kenkyuk-ask“AT”amed.go.jp
※E-mailは上記アドレス“AT”の部分を@に変えてください。
掲載日 令和2年12月29日
最終更新日 令和2年12月29日


