プレスリリース 関節リウマチの骨破壊の新しいメカニズムを解明―自己抗体をつくる細胞が傍関節性骨粗鬆症を誘導する―
プレスリリース
東京大学
日本医療研究開発機構
発表者
小松紀子(東京大学大学院医学系研究科 病因・病理学専攻 免疫学 助教)
高柳広(東京大学大学院医学系研究科 病因・病理学専攻 免疫学 教授)
発表のポイント
- 関節リウマチでは炎症関節の近傍の骨の骨髄中で抗体を産生する形質細胞が増加し、破骨細胞分化誘導因子RANKLを発現することで傍関節性骨粗鬆症がおきることを明らかにしました。
- 関節リウマチの発症に先行して、自己抗体の産生や傍関節性骨粗鬆症がみられることが知られていましたが、本研究により自己抗体をつくる細胞(形質細胞)がその原因となっていることが明らかとなりました。
- 関節リウマチ患者の骨折リスクや生活レベルの低下をもたらす傍関節性骨粗鬆症は従来の製剤では抑えることが困難でしたが、本研究により形質細胞が治療標的になりうることが分かりました。
発表概要
関節リウマチ(注1)は炎症に伴って骨破壊が誘導される自己免疫疾患です。関節リウマチでは関節破壊だけでなく、炎症関節の近傍や全身性に骨粗鬆症がおき、骨折リスクを上げ生活の質を下げます。傍関節性骨粗鬆症(注2)は関節リウマチの臨床所見が現れる前に発症することが知られていましたが、そのメカニズムはよくわかっておらず、新しい治療法の確立が喫緊の課題となっています。
東京大学大学院医学系研究科の小松紀子助教、高柳広教授らは、関節リウマチのマウスモデルを用いた解析により炎症関節近傍の骨の骨髄に存在する抗体を産生する形質細胞(注3)が破骨細胞分化誘導因子RANKL(注4)を発現することで破骨細胞(注5)を誘導し、傍関節性骨粗鬆症をひきおこすことを明らかにしました。さらに関節においては滑膜線維芽細胞(注6)が主要なRANKL発現細胞として関節破壊に関わることを生体レベルで実証することに成功しました。本研究により関節リウマチにおける傍関節性骨粗鬆症の新しいメカニズムを解明するとともに形質細胞が治療標的になりうることがわかりました。
本研究は日本学術振興会科学研究費補助金(15H05703、18H02636、18K19438、20K21515、19K18943)、国立研究開発法人日本医療研究開発機構(AMED)免疫アレルギー疾患実用化研究事業における研究開発課題「関節リウマチの病原性間葉系細胞サブセットを標的とした骨破壊治療法の開発」(研究開発代表者:高柳広)、革新的先端研究開発支援事業(AMED-CREST)「生体組織の適応・修復機構の時空間的解析による生命現象の理解と医療技術シーズの創出」研究開発領域における研究開発課題「組織修復型免疫細胞の解明とその制御による疾患治療の開発」(研究開発代表者:高柳広)などの支援を受けて行われました。
発表内容
研究の背景
関節リウマチは炎症に伴って骨破壊が誘導される最も頻度の高い自己免疫疾患の一つです。関節リウマチの骨破壊には、①関節破壊(骨びらん)②関節近傍の骨粗鬆症(傍関節性骨粗鬆症)③全身性骨粗鬆症の3種類があるとされています(図1)。破骨細胞は破骨細胞誘導因子RANKLによって分化誘導され関節リウマチの3つすべてのタイプの骨破壊を引き起こす原因細胞です。したがって、それぞれの骨破壊においてRANKL発現細胞を同定することは、関節リウマチの骨破壊のメカニズムと治療法の開発に重要な知見をもたらすと考えられます。関節リウマチでは、自己抗原の提示を受け活性化したT細胞がB細胞から形質細胞への分化を誘導して自己抗体が産生されます。炎症関節では、活性化T細胞やマクロファージなどから産生された炎症性サイトカインが滑膜線維芽細胞のRANKL発現を上昇させ破骨細胞を誘導すると考えられています。
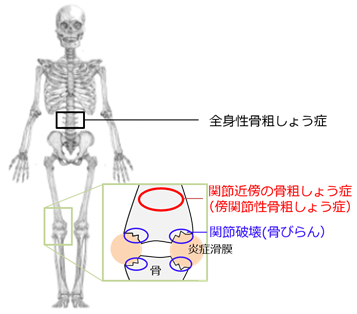
骨粗鬆症は、関節リウマチ患者の骨折リスクを上げ、生活の質を下げますが、これまでの治療法では関節破壊の進行を抑制できても骨粗鬆症は十分に抑制できず、新しい治療法の確立が望まれています。自己抗体のひとつである抗シトルリン化ペプチド抗体は関節リウマチの診断マーカーですが、関節リウマチの発症に先行し、抗シトルリン化ペプチド抗体の産生や傍関節性骨粗鬆症がみられることが知られています。しかしながら傍関節性骨粗鬆症のメカニズムは不明な点が多く、骨破壊を誘導するRANKL発現細胞も同定されていませんでした。
研究成果の概要
本研究では、RANKLを発現した細胞が蛍光標識されるRANKLレポーターマウスを新たに作成し、関節リウマチのマウスモデルとして汎用されるコラーゲン誘導性関節炎を誘導しました。その結果、骨髄中では形質細胞で、炎症関節の滑膜では滑膜線維芽細胞に高いRANKL発現がみられることがわかりました。
形質細胞による破骨細胞誘導能を検討するため破骨細胞の前駆細胞と共培養すると、試験管内で形質細胞は破骨細胞誘導能をもつこと、RANKLの発現を欠損した形質細胞は破骨細胞を誘導できないことから、形質細胞はRANKLを発現することで破骨細胞を分化誘導できることが明らかとなりました(図2)。
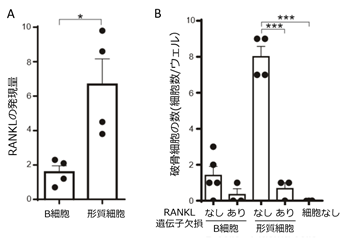
- 形質細胞はB細胞と比較して高いRANKL発現を有した。(*p<0.05)
- 形質細胞は破骨細胞の分化を誘導したがRANKL遺伝子を欠損した形質細胞は破骨細胞の分化を誘導しなかった。(***p<0.005)
炎症関節近傍の骨の骨量と骨髄中の形質細胞の細胞数の関連を経時的に検討したところ、関節炎の炎症が起きる前から関節近傍の骨の骨量が減少する一方で骨の骨髄中の形質細胞の細胞数が増えていることがわかりました。炎症関節から離れた脊椎では関節炎が進行してから骨量減少が認められ形質細胞の増加も認められませんでした。このことは形質細胞が関節炎の発症に先立って関節近傍の骨で増え骨粗鬆症を誘導することを示唆しています。
次に形質細胞が発現するRANKLの傍関節性骨粗鬆症における役割を生体レベルで検討するため、RANKLをB細胞系列特異的に欠損するマウスをコラーゲン誘導性関節炎感受性のDBA1/Jの系統にて作製し、関節炎を誘導しました。興味深いことにB細胞系列でRANKLを欠損したマウスでは関節炎を誘導しても破骨細胞の数が増加せず、野生型マウスと比較して関節近傍の骨の骨量減少が小さいことが分かりました。完全に骨量減少が防げなかったことからは関節近傍の骨の骨量減少には破骨細胞の数以外の要因も絡むことがうかがえます。一方で、B細胞系列でRANKLが欠損したマウスでは全身性骨粗鬆症の指標である脊椎の骨量減少は抑制されませんでした。これらのことから、B細胞系列のRANKLが傍関節性骨粗鬆症に重要であることが示されました(図3)。
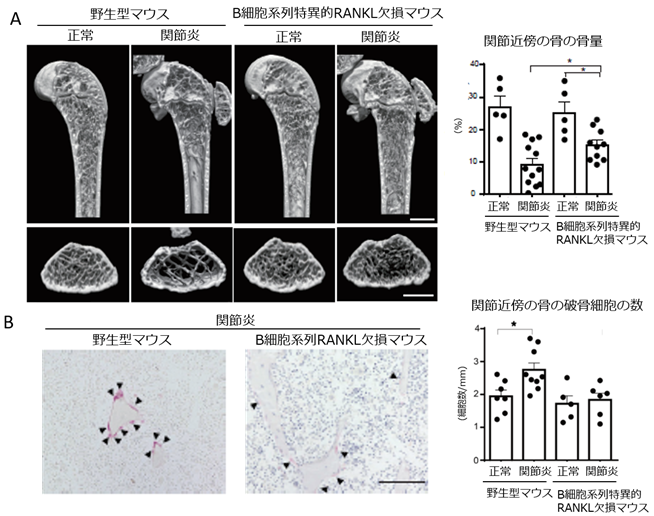
- 野生型マウスでは関節炎誘導時に関節近傍の骨の骨量の低下がみられたが、B細胞系列でRANKLが発現できないマウスでは骨量の低下が抑えられた。左に代表的なマイクロCT画像を示す。(*p<0.05)
- 野生型マウスでは関節炎誘導時に関節近傍の骨において破骨細胞の数の増加がみられたがB細胞系列でRANKLが発現できないマウスでは破骨細胞の数は増加しなかった。左に代表的な破骨細胞の組織染色像を示す。(破骨細胞:黒い矢印で示された細胞)(*p<0.05)
さらに生体内において関節破壊を引き起こす主要なRANKL発現細胞を同定するためRANKLを滑膜線維芽細胞、T細胞、B細胞系列特異的に欠損するマウスをDBA1/Jの系統にて作製し関節炎を誘導しました。その結果、関節では滑膜線維芽細胞にRANKLを欠損させたマウスでのみ関節破壊の抑制が認められました。したがって関節破壊では滑膜線維芽細胞が主要なRANKL発現細胞であることが生体レベルで明らかとなりました(図4)。
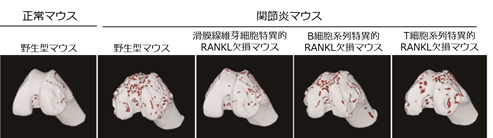
以上の研究結果より、関節近傍の骨では骨髄中の形質細胞の細胞数が増加してRANKLを介して破骨細胞を誘導し、傍関節性骨粗鬆症を引き起こすことが明らかとなりました。また滑膜線維芽細胞が産生するRANKLが関節破壊に重要であることが実証されました。
研究成果の意義
本研究では形質細胞がRANKLを介して傍関節性骨粗鬆症を誘導することを明らかにしました。形質細胞は骨髄中に存在し、炎症時に大量に産生される抗体や炎症性サイトカインは炎症や骨破壊に働くことが知られています。本研究から形質細胞が関節リウマチの発症に先立って関節近傍の骨の骨髄に集積し、RANKL、抗体、炎症性サイトカインをいう3つの武器を駆使することで傍関節性骨粗鬆症を引き起こすことが考えられます。傍関節性骨粗鬆症は関節リウマチの臨床所見に先立つことからも、本研究は関節リウマチの新しいメカニズムの解明につながる知見を提供し、形質細胞を標的とした傍関節性骨粗鬆症の治療法を提唱するものとして意義があると考えられます。
さらに、本研究は関節破壊における滑膜線維芽細胞の重要性を生体レベルで実証することに成功しました。近年、滑膜線維芽細胞はさまざまな異なる機能を有する亜集団から構成されることが報告されています。本研究に基づいて今後はRANKLを発現する悪玉の滑膜線維芽細胞を標的とした関節破壊の治療法のさらなる開発が期待されます。
以上により本研究成果は今後の関節リウマチの骨破壊のメカニズムの解明や治療法の開発に大きく貢献すると考えられます。
発表雑誌
- 雑誌名
- 「The Journal of Clinical Investigation」(オンライン版の場合:2021年3月15日)
- 論文タイトル
- Plasma cells promote osteoclastogenesis and periarticular bone loss in autoimmune arthritis
- 著者
- Noriko Komatsu, Stephanie Win, Minglu Yan, Nam Cong-Nhat Huynh, Shinichiro Sawa, Masayuki Tsukasaki, Asuka Terashima, Warunee Pluemsakunthai, George Kollias, Tomoki Nakashima and Hiroshi Takayanagi*(*責任著者(Corresponding author))
- DOI番号
- 10.1172/JCI143060
- アブストラクトURL
- https://www.jci.org/articles/view/143060
用語解説
- (注1)関節リウマチ
- 関節を中心とした持続的な炎症と骨破壊をおもな症状とする自己免疫疾患の一つ。環境要因と遺伝要因が複合的にからみあって発症すると考えられているが詳細な発症メカニズムは不明である。免疫抑制薬であるメトトレキサートが治療の第一選択薬であり、効果が低い場合は炎症性サイトカインなどを標的とした生物学的製剤が使用される。生物学的製剤は関節リウマチの関節の腫れや痛みだけでなく関節破壊の進行に対して高い抑制効果をもつ。
- (注2)傍関節性骨粗鬆症
- 関節リウマチでみとめられる骨破壊の一つ。炎症や痛みがある関節の近傍の骨において骨密度が低下する病態を指す。関節リウマチ患者の骨折のリスクをあげ、関節リウマチの関節の腫れや痛みが現れる前から発症することが知られているがメカニズムは不明な点が多い。関節破壊の進行を抑制する製剤でも傍関節性骨粗鬆症の抑制効果は低いことから新たな治療法の開発が必要である。
- (注3)形質細胞
- 骨髄でつくられる免疫細胞の一つであるBリンパ球(B細胞)が分化・成熟することによってできる、高い抗体産生能力をもつ細胞である。骨髄中に豊富に存在する。抗体には病原体由来の抗原に反応する抗体のほか自己抗原に反応する自己抗体も含まれる。
- (注4)RANKL
- Receptor activator of NF-kB ligandの略で、破骨細胞の分化を誘導するタンパク質であり、生体内の破骨細胞形成に必須である。リンパ節や胸腺などの免疫組織の形成においても必須な役割をもつ。RANKL遺伝子を欠損するマウスでは破骨細胞ができないため骨破壊がおこらず大理石骨病が発症する。定常時の骨組織においては骨芽細胞や骨細胞(骨芽細胞から分化し骨に埋没した細胞)がRANKLを発現することで破骨細胞を形成する。抗RANKL抗体製剤は関節リウマチに伴う関節破壊の進行を抑制する薬剤として本邦で承認されている。
- (注5)破骨細胞
- 血球系の細胞である破骨細胞の前駆細胞がRANKL刺激を受けることで分化した、生体において骨破壊を担う唯一の細胞である。骨表面に接着し、タンパク質分解酵素と酸を放出することで骨基質を分解する。骨の恒常性は、破骨細胞による骨破壊と、骨芽細胞や骨細胞による骨形成の均衡により維持されている。破骨細胞が欠損するマウスでは関節の炎症が起きても骨破壊が誘導されない。
- (注6)滑膜線維芽細胞
- 関節の滑膜に存在する間葉系細胞(結合組織や筋肉、脂肪などを構成する非上皮系の細胞)の一種。関節リウマチの炎症滑膜のおもな構成細胞のひとつで、炎症環境下において活性化・増殖し、炎症性サイトカインやRANKLの発現が高く誘導されることで関節リウマチの関節の炎症や骨破壊を増悪化する。
お問い合わせ先
東京大学大学院医学系研究科 病因・病理学専攻 免疫学
教授 高柳広(たかやなぎひろし)
TEL:03-5841-3373 FAX:03-5841-3450
E-mail:takayana“AT”m.u-tokyo.ac.jp
AMED事業に関すること
国立研究開発法人日本医療研究開発機構(AMED)
疾患基礎研究事業部 疾患基礎研究課
免疫アレルギー疾患実用化研究事業
TEL:03-6870-2286
E-mail:nambyo-i“AT”amed.go.jp
シーズ開発・研究基盤事業部 革新的先端研究開発課
革新的先端研究開発支援事業
TEL:03-6870-2224
E-mail:kenkyuk-ask“AT”amed.go.jp
※E-mailは上記アドレス“AT”の部分を@に変えてください。
掲載日 令和3年3月16日
最終更新日 令和3年3月16日


