成熟膵島細胞を増やすことに成功―糖尿病の根治に向け、新たな再生治療法の可能性を発表―
プレスリリース
東京大学
日本医療研究開発機構
発表者
山田 泰広(東京大学医科学研究所 附属システム疾患モデル研究センター 先進病態モデル研究分野 教授)
平野 利忠(東京大学医科学研究所 先進病態モデル研究分野 大学院生)
発表のポイント
- 成熟した膵島細胞(注1)は自己複製能を持たず、その機能低下が糖尿病の原因となっています。本研究は、出生前後に増殖する膵島細胞でMYCL遺伝子(注2)が発現し、MYCLを働かせると成熟した膵島β細胞(注3)に活発な自己増殖が誘発できることを見出しました。
- 体内でMYCLを発現誘導する、あるいはMYCLにより試験管内で増幅させた膵島細胞を移植することで、モデルマウスの糖尿病を治療できることを示しました。
- 本研究成果による試験管内での膵島細胞の増幅や、遺伝子治療(注4)による生体内での膵島細胞の増殖誘導は、糖尿病の根治を目指した新たな再生治療法となることが期待されます。
発表概要
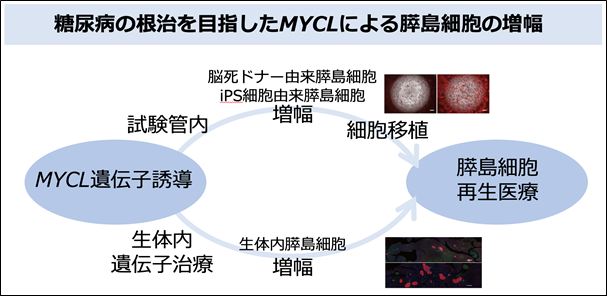
平野利忠大学院生(東京大学医科学研究所 先進病態モデル研究分野)、山田泰広教授(同分野)、京都大学、愛知医科大学らの研究グループは、出生前後に増殖する膵島細胞で高発現するMYCLに着目し、MYCLを働かせることで生体内外の成熟膵島細胞に活発な自己増殖を誘発できることを明らかにしました。また、MYCLによる自己増殖の誘導には、遺伝子発現状態の若返りが関与することを示しました(図1)。さらにMYCLの発現により増殖した膵島β細胞は糖に応答してインスリン(注5)を分泌し、モデルマウスの糖尿病を治療できることを示しました。
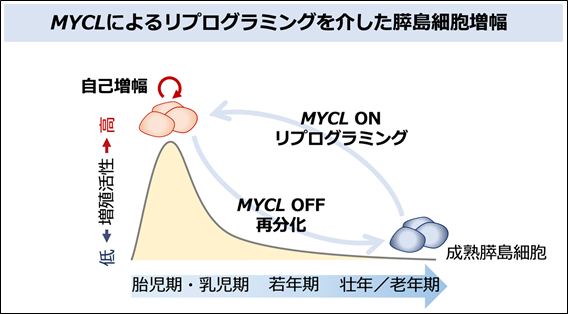
本研究は、MYCL遺伝子により体外で増幅させた膵島細胞を再び体の中に戻す細胞移植療法や、MYCL遺伝子治療による体内での膵島細胞増幅技術の開発といった、膵島細胞の再生医療開発への応用が期待されます。本研究成果は2022年2月10日(英国時間)、英国医学誌「Nature Metabolism」(オンライン版)に掲載されました。
発表内容
研究の背景
世界の糖尿病患者数は生活習慣や社会環境の変化により急速に増え続けており、現在の糖尿病人口は4億人を超えると推定されます。糖尿病は網膜症、神経障害に加えて腎障害等の合併症を引き起こし、人工透析が必要となることもあります。また、世界における糖尿病およびその合併症に対する医療費は年間90兆円とされており、糖尿病による医療費圧迫が大きな社会問題となっています。
糖尿病は膵臓に存在する膵島β細胞から分泌されるインスリンの絶対的もしくは相対的不足により発症します。成人膵島細胞には自己複製能がほとんどないことから、膵島細胞の機能は再生しません。現在の糖尿病に対する治療法は、糖の吸収を抑える薬剤やインスリン製剤の投与等の対症療法が主流であり、そのほとんどが糖尿病そのものを治療するものではありません。糖尿病の根治を目指してiPS細胞などの多能性幹細胞(注6)からインスリン産生細胞を作製し、細胞移植による再生医療に応用する取り組みも進められていますが、多能性幹細胞由来のインスリン産生細胞は、機能的に未熟であることが大きな問題となっており、医療応用に至っていません。研究チームは、出生前後の膵島細胞が自己複製能を持つことに着目し、成熟した膵島細胞の自己増幅技術の開発を目指しました。
研究結果
(1)MYCL遺伝子は出生前後の膵島細胞の増殖を制御する
膵島細胞は出生前後において活発に増殖する一方で、発生とともにその増殖能は急激に失われ、成熟した膵島細胞には自己複製能がほとんどないことが分かっています。そこで、増殖する膵島細胞の特性を理解し、成熟膵島細胞の増殖誘導に応用するために、胎生期のマウス膵臓における1細胞遺伝子発現解析を行いました。増殖誘導活性を持つMYCファミリー遺伝子群(MYC、MYCN、MYCL)(注2)に着目したところ、膵島細胞に限局してMYCLが発現していることが分かりました。また、ヒトiPS細胞から膵島細胞様細胞への分化過程においても、膵島前駆細胞(注7)でMYCLが一過性に発現していることが分かりました(図2)。さらにMYCL遺伝子を破壊したマウスでは出生前後の膵島細胞で増殖活性が低下することを見出しました。このことから、MYCLが発生・分化過程における膵島細胞の増殖を制御することが明らかとなりました。
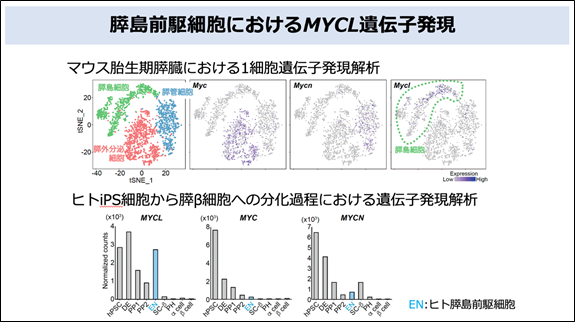
(下)増殖するヒト膵島前駆細胞でMYCL遺伝子の発現が高い。
(2)MYCLの発現は成熟膵島細胞の増殖を誘導する
次にMYCLを膵島細胞へ発現させることで、成熟膵島の自己増殖の誘導を試みました。まず、成体マウスより単離した膵島細胞に、試験管内でMYCLの発現誘導を行ったところ、活発な細胞増殖が誘導されました(図3左上)。また、加齢したマウスの膵島細胞(図3右上)や、ヒト脳死ドナー由来膵島細胞(図3右下)、さらには、マウスの生体内の膵島細胞(図3左下)においても同様の自己複製の誘導が確認されました。MYCLを発現誘導させたマウスおよびヒト膵島細胞の1細胞遺伝子発現解析を行ったところ、MYCLの発現により遺伝子発現状態が胎生期に類似した状態に変化していることが分かりました。
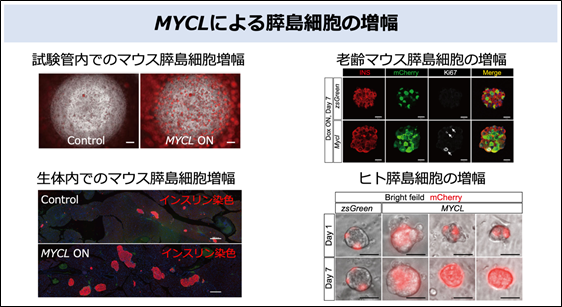
右上図と左下図:赤色はインスリンの発現を示す。
右上図:Ki67は増殖している細胞に染色される。
これらの結果から、MYCLが成熟膵島細胞の遺伝子発現状態を胎生期様の状態へと「リプログラミング」させ、増殖活性を付与していることが示唆されました。
(3)成熟膵島細胞増幅による糖尿病モデルマウスの治療
最後に、MYCLにより増幅させた膵島細胞の機能性を評価しました。まず、マウスにストレプトゾトシン(STZ;膵島β細胞を特異的に破壊する薬剤)を投与することで糖尿病にさせ、その後生体内においてMYCLの発現誘導を行いました(図4左)。
その結果、MYCL発現誘導後に速やかに血糖値の改善が認められました。また、MYCLにより単離した膵島細胞を試験管内で増幅させたのちに、糖尿病マウスに移植したところ、血糖値の改善が認められました(図4右)。
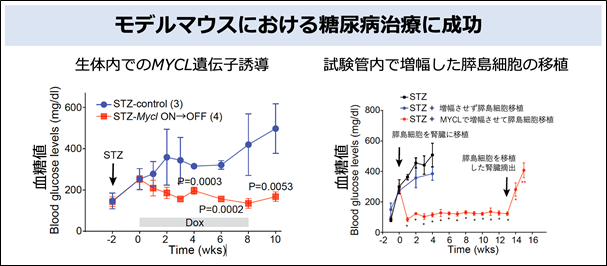
これらの結果から、MYCLの発現により生体内外で増幅させた膵島細胞が高い機能性を持ち、糖尿病マウスを治療できることが示されました。
まとめ
糖尿病を根治させるためには、生体内の膵島β細胞量を増やす必要があります。現在の細胞移植治療は、脳死ドナー由来の膵島細胞を使用しますが、ドナー不足が問題となっています。この問題点を改善するために、多能性幹細胞からの分化誘導による膵島細胞の作製による細胞移植治療の開発が盛んに行われています。しかしながら、成熟した機能性の高い膵島細胞の作製はハードルが高く、未だ医療応用に至っていません。
本研究では、マウス膵島細胞の発生過程にMYCL遺伝子が発現上昇することを見出し、出生前後の膵島細胞の増殖にMYCL遺伝子が重要な役割を果たすことを示しました。さらに、成体マウス生体内において一時的なMYCL遺伝子の発現誘導を行うことで、現在まで不可能であると考えられてきた成熟膵島細胞の増幅に成功しました。また生体内で増殖させた膵島細胞は高い機能性を持ち、糖尿病モデルマウスの治療が可能であることを確認しました。試験管内においても成熟膵島細胞の自己増殖誘導は可能であり、試験管内で増幅させた膵島細胞の移植によりマウス糖尿病を治療可能であることを示しました。さらに、ヒト膵島細胞の分化過程でもMYCL遺伝子が発現上昇すること、MYCL遺伝子の誘導により、脳死ドナー由来のヒト膵島細胞に自己増殖活性を付与できることを示しました。
本研究成果は、MYCL遺伝子により体外で増幅させた膵島細胞を再び体の中に戻す細胞移植療法や、MYCL遺伝子治療による体内での膵島細胞増幅技術の開発といった、膵島細胞の再生医療開発への応用が期待されます(図5)。
本研究は、日本医療研究開発機構(AMED)の革新的先端研究開発支援事業(AMED-CREST)「全ライフコースを対象とした個体の機能低下機構の解明」研究開発領域における研究開発課題「時空間老化制御マウスを用いた細胞老化が及ぼす個体生命機能の理解(研究開発代表者:山田泰広)」、次世代がん医療創生研究事業(P-CREATE)、および日本学術振興会(JSPS)科学研究費助成事業(課題番号:18H04026, 20H05384)の研究助成により実施されました。
発表雑誌
- 雑誌名
- Nature Metabolism(2022年2月10日オンライン版)
- 論文タイトル
- MYCL-mediated reprogramming expands pancreatic insulin-producing cells
- 著者
- 平野利忠1#、宋裕成1、恒川新2、蒲田未央3、太田翔1、相良洋4、三小田直1、田口純平1、山田洋介5、鵜飼智代1、加藤誠2、中村二郎2、小沢学6、山本拓也3,7,8,9、山田泰広1,7*
(#:筆頭著者、*:責任著者) - 所属
-
- 東京大学医科学研究所 先進病態モデル研究分野
- 愛知医科大学医学部内科学講座 糖尿病内科
- 京都大学iPS細胞研究所(CiRA)
- 東京大学医科学研究所 疾患プロテオミクスラボラトリー
- 京都大学医学部附属病院 病理診断科
- 東京大学医科学研究所 生殖システム研究分野
- 日本医療研究開発機構 革新的先端研究開発支援事業(AMED-CREST)
- 京都大学高等研究院ヒト生物学高等研究拠点(ASHBi)
- 理化学研究所 革新知能統合研究センター(AIP)iPS細胞連携医学的リスク回避チーム
- DOI
- 10.1038/s42255-022-00530-y
- URL
- https://www.nature.com/articles/s42255-022-00530-y<./dd>
用語解説
- (注1)膵島細胞
- 膵島に存在する細胞。主にα細胞、β細胞、δ細胞、PP細胞の4種類の細胞で構成される。膵島は、糖代謝に関連するホルモンを血液中に分泌して、血糖値の調節を制御する膵臓の組織。ランゲルハンス島とも呼ばれる。
- (注2)MYCL遺伝子
- MYCファミリー遺伝子の一つ。MYCファミリー遺伝子には、c-Myc遺伝子、N-Myc遺伝子、L-Myc遺伝子がある。いずれも核内のDNAに結合して働く転写因子で、細胞増殖を活性化させるなど多彩な機能を持つ。iPS細胞作製過程でも重要な役割を持つ。
- (注3)膵島β細胞
- 膵島に存在する、血糖に応じてインスリンを血中に分泌する細胞。
- (注4)遺伝子治療
- 患者の細胞の遺伝子発現を強めたり、細胞に新たな機能を持たせたりすることで、患者の疾患を根本的に治療する医療。
- (注5)インスリン
- 血糖値を低下させるホルモン。膵島に存在する膵島β細胞から血中に分泌され、肝臓・筋肉・脂肪などの組織で、細胞内への糖の取り込みを促進する。
- (注6)多能性幹細胞
- さまざまな細胞に分化する能力を持つ幹細胞であり、胚性幹細胞(ES細胞)や人工多能性幹細胞(iPS細胞)を含む。
- (注7)膵島前駆細胞
- 発生過程において、膵島に存在する各種細胞の起源となる細胞。
お問い合わせ先
本研究に関すること
東京大学 医科学研究所 附属システム疾患モデル研究センター 先進病態モデル研究分野
教授 山田 泰広(やまだ やすひろ)
電話:03-5449-5301
E-mail:koho”AT”ims.u-tokyo.ac.jp
報道に関すること
東京大学 医科学研究所 国際学術連携室(広報)担当:清水
E-mail:koho”AT”ims.u-tokyo.ac.jp
AMEDの事業に関すること
革新的先端研究開発支援事業(AMED-CREST)について
日本医療研究開発機構 シーズ開発・研究基盤事業部 革新的先端研究開発課
電話:03-6870-2224
E-mail:kenkyuk-ask”AT”amed.go.jp
次世代がん医療創生研究事業(P-CREATE)について
日本医療研究開発機構 創薬事業部 医薬品研究開発課
電話:03-6870-2311
E-mail:cancer"AT"amed.go.jp
※E-mailは上記アドレス“AT”の部分を@に変えてください。
関連リンク
掲載日 令和4年2月14日
最終更新日 令和4年2月14日


