プレスリリース 白血病患者由来異種移植マウスモデルによる難治性急性骨髄性白血病クローンの解明―新たな予後層別化因子、治療標的の同定から治療成績の向上へとつながる期待―
プレスリリース
名古屋大学
日本医療研究開発機構
名古屋大学大学院医学系研究科血液・腫瘍内科学の清井 仁教授、川島 直実助教、名古屋大学医学部附属病院血液内科の石川 裕一病院講師らの研究グループは、急性骨髄性白血病(AML)※1患者の白血病細胞を免疫不全マウス※2へ移植する患者由来異種移植(Patient Derived Xenotransplant: PDX)マウスモデルの作製により、実際の患者での再発や治療抵抗性に関わる難治性クローン※3の同定が可能であることを見出しました。
AMLの発症・進行にはさまざまな染色体異常や遺伝子異常が関与し、それらの異常により治療成績が異なります。しかし、AML診断時の白血病細胞は遺伝子変異の観点からみると様々な変異を持つ複数の集団から構成されており、その中からどのような特徴を持つ集団が治療後も残存するのか、再発の原因となるのか見極めるのは困難なのが現状です。
本研究では、名古屋大学医学部附属病院および関連施設でAMLと診断された160症例の白血病細胞を免疫不全マウスに移植し、AML細胞の生着※4の有無および生着が認められた場合には、生着したAML細胞の遺伝子変異についての解析を行いました。さらに、実際の患者での治療効果、再発時の細胞の遺伝子変異の特徴との比較検討を行いました。
その結果、診断時のAML細胞が免疫不全マウスに生着した症例は、生着しなかった症例と比べて治療成績が劣ること、免疫不全マウスに生着・増殖する細胞は、実際の患者で再発に関わった治療抵抗性AML細胞と同様の遺伝子変異を持つクローンであることを見出しました。また、生着した細胞を新たな免疫不全マウスに移植する(継代と呼びます)と、継代するごとにそのような難治性クローンの割合が増加し、難治性クローンが選択されていくことが明らかになりました。これらの結果より、免疫不全マウスに患者由来のAML細胞を移植する、AML-PDXマウスモデルを用いた白血病研究は、白血病治療薬の有効性の評価のみならず、難治性AMLクローン出現過程の解明、治療抵抗性に関わる分子の同定や新たな新薬の開発に有用であると考えられ、これらの研究を通じた難治性AMLの克服が期待されます。
本研究は、日本医療研究開発機構(AMED)革新的がん医療実用化研究事業「急性骨髄性白血病におけるPDXモデルで意義づけられた分子層別化システムの確立と臨床的実効性と有用性の検証」「PDX治療モデルを併用した治療抵抗性急性骨髄性白血病クローンの成立過程に生じる分子病態に基づく層別化システムの確立と標的治療薬開発に関する研究」、次世代がん医療創生研究事業「骨髄系腫瘍における難治性クローンへの進展・選択過程に生じる分子病態の解明」「シングルセルバーコードラベル化PDXモデルによる難治性造血器腫瘍クローンの選択・進展過程に関与する分子病態の解明に関する研究」の支援を受けて実施され、「Nature Communications」電子版(英国標準時間2022年3月25日)に掲載されました。
ポイント
- 急性骨髄性白血病患者の白血病細胞を免疫不全マウスへ移植する患者由来異種移植マウスモデルの作製により、実際の患者での再発や治療抵抗性に関わる難治性クローンを同定できました。
- AML細胞が免疫不全マウスに生着した患者は、生着しなかった症例と比べて、治療成績が劣り、免疫不全マウスに生着した難治性クローンは、マウスの生体内での継代で更に選択的に増殖することが明らかになりました。
- AML異種移植マウスモデルを用いた白血病研究は、難治性AMLクローン出現過程の解明、治療抵抗性に関わる分子の同定に有用であり、これらの研究を通じたAMLの治療成績向上が期待されます。
背景
急性骨髄性白血病(AML)の発症・進行にはさまざまな染色体異常や遺伝子変異が深く関わり、一つのみならず複数の遺伝子異常の獲得が、AMLの病態形成には必要と考えられています。また、AMLでは染色体異常や遺伝子異常に基づく予後の予測、治療方針の選択が行われていますが、AML診断時の白血病細胞は、様々な染色体異常、遺伝子異常を持つ複数のクローンから構成されており、その中からどのような特徴を持つクローンが治療後も残存するのか、再発の原因となるのか見極めるのは困難です。AMLの治療成績向上のためには、そのような治療過程でのAMLのクローン性変化、難治性クローンの特徴、その治療抵抗性にかかわるメカニズムを明らかにする必要があります。
研究成果
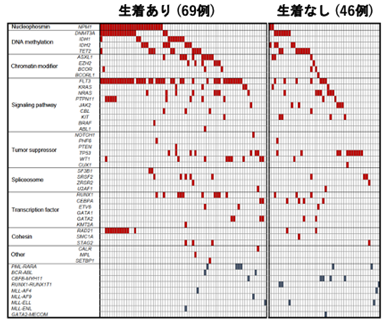
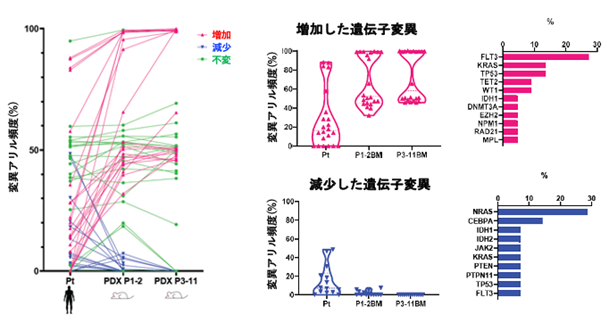
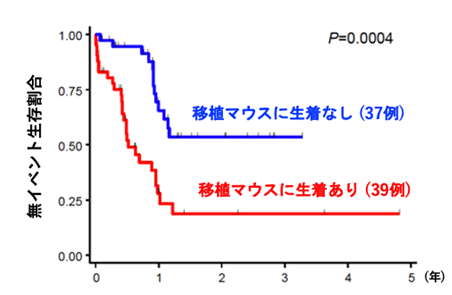
本研究では、160例にもおよぶAML患者の白血病細胞を免疫不全マウスへ移植するPDXモデルの作製を通じて、マウス生体内でのクローン変化と実際の患者での難治性クローンの選択過程について、検討を行いました。160例のうち、105例(66%)で免疫不全マウスへの生着が認められ、AMLの分類と生着についての検討では、AMLの形態学的分類であるFAB分類※5、AMLの予後リスク分類との関連が認められ、AML診断時の細胞よりも、再発・治療抵抗期の細胞の方が高い生着率を示しました。また、生着の有無でAML細胞における遺伝子変異を比較すると、生着したAML細胞ではFLT3※6、NPM1※7、IDH1※8、WT1※9遺伝子変異が高頻度に認められました(図1)。さらに、マウスに生着したAML細胞を、免疫不全マウスで繰り返し継代を行ったところ、FLT3、WT1、TP53※10、TET2※11、KRAS※12遺伝子変異を持つAML細胞の割合は徐々に増加し、逆にNRAS※13、CEBPA※14遺伝子変異を持つAML細胞の割合は徐々に減少しました(図2)。次いで、診断時AML細胞の免疫不全マウスへの生着の有無と化学療法の治療効果を76名の患者で検討したところ、AML細胞が生着した患者は、生着しなかった患者と比較して、明らかに治療成績が劣っていました(図3)。
今後の展開
免疫不全マウスに患者由来AML細胞を移植する、AML異種移植マウスモデルを用いた白血病研究は、白血病治療薬の有効性の評価のみならず、難治性AMLクローン出現過程の解明、治療抵抗性に関わる分子の同定に有用であることが、本研究により新たに明らかになりました。これらの研究を通じたAMLの難治性クローンの同定、背後にある病態の解明、それを克服するための治療開発が期待されます。
用語説明
- ※1 急性骨髄性白血病(AML)
- AMLは血液がんの一種であり、血球を作る幼若造血細胞ががん化し、がん化した白血病細胞が 骨髄中で無秩序に増殖するために、正常の血液細胞を作ることが出来なくなった結果、感染、出 血、貧血などの症状を引き起こす難治性の疾患です。
- ※2 免疫不全マウス
- 突然変異または人工的に遺伝子の一部に手を加えたことにより、免疫を担当する細胞の一部に欠 陥や欠失が生じたマウス。 これにより異種であるヒト患者由来のがん細胞が、免疫の働きに よって排除されることなく、移植が可能となります。数多くの免疫不全マウスが開発され、免疫 学、腫瘍学などの研究において重要な役割を担っています。
- ※3 クローン
- 均一な遺伝子変異などの遺伝情報を持つ細胞の集団。
- ※4 生着
- 移植した細胞や組織、臓器が、移植した生体において機能している状態。
- ※5 FAB分類
- 1976年にフランス・アメリカ・イギリスの研究者からなる研究グループから提唱された急性白血病の分類法。骨髄中の細胞全体の中で白血病細胞(芽球)が30%以上を占めるものを急性白血病とし、急性骨髄性白血病は細胞の形態、特殊染色での特徴によってM0からM7までの8型に 分類されます。
- ※6 FLT3遺伝子
- 造血幹細胞・前駆細胞の細胞膜上に発現し、血液細胞の分化・増殖に関与しているチロシンキナーゼという酵素をつくる遺伝子です。 FLT3遺伝子はAMLのうち約30%でその遺伝子異常が認められ、AMLで最も高頻度に変異が見られる遺伝子の一つです。
- ※7 NPM1遺伝子
- 核小体に局在し、リボソーム生合成等に関わるリン酸化タンパクをつくる遺伝子です。その機能については様々な報告があり、成人AMLの約30%で遺伝子変異が見つかっています。
- ※8 IDH1遺伝子
- イソクエン酸脱水素酵素という酵素を作る遺伝子で、その酵素は遺伝子の発現の調節に関わると考えられています。AMLの10%前後で、その遺伝子異常が報告されています。
- ※9 WT1遺伝子
- 遺伝子の発現を調整する転写因子で泌尿器・生殖細胞での発達に重要な役割を果たす遺伝子です。AMLのうち約10%で、その遺伝子異常が報告されています。
- ※10 TP53遺伝子
- 多機能な癌抑制遺伝子で、様々な癌での遺伝子変異が報告されています。AMLのうち約10%でその遺伝子異常が報告され、TP53遺伝子変異をもつAMLは予後不良と報告されています。
- ※11 TET2遺伝子
- 遺伝子の発現の調節に関わる酵素をつくる遺伝子です。AMLの10~15%で、その遺伝子異常が報告されています。
- ※12 KRAS遺伝子、※13 NRAS遺伝子、
- 細胞内で細胞増殖を促進するシグナルを伝達するRASタンパク、KRAS およびNRASを作り出す遺伝子です。KRAS 遺伝子およびNRAS遺伝子の変異は、様々な癌で報告されています。
- ※14 CEBPA遺伝子
- 造血細胞の顆粒球系への分化に関わる遺伝子の発現調節を担う転写因子をつくる遺伝子です。 AMLのうち約10%で、その遺伝子異常が報告されています。
発表雑誌
- 掲雑誌名
- Nature Communications
- 論文タイトル
- Comparison of clonal architecture between primary and immunodeficient mouse engrafted acute myeloid leukemia cells
- 著者
- Naomi Kawashima1, Yuichi Ishikawa1, Jeong Hui Kim1, Yoko Ushijima1, Akimi Akashi1 , Yohei Yamaguchi1, Hikaru Hattori1, Marie Nakashima1, Seara Ikeno1, Rika Kihara2 , Takahiro Nishiyama3, Takanobu Morishita4, Koichi Watamoto2, Yukiyasu Ozawa4 , Kunio Kitamura3, Hitoshi Kiyoi1
- 所属名
- 1 Department of Hematology and Oncology, Nagoya University Graduate School of Medicine, Nagoya, Japan; 2Department of Hematology, Komaki City Hospital, Komaki, Japan; 3Division of Hematology, Ichinomiya Municipal Hospital, Ichinomiya, Japan; 4Department of Hematology, Japanese Red Cross Nagoya First Hospital, Nagoya, Japan
- DOI
- 10.1038/s41467-022-29304-6
お問い合わせ先
研究内容
名古屋大学医学部・医学系研究科
血液・腫瘍内科学 教授 清井 仁
TEL:052-744-2136 FAX:052-744-2157
E-mail:kiyoi”AT”med.nagoya-u.ac.jp
広報担当
名古屋大学医学部・医学系研究科 総務課総務係
TEL:052-744-2228 FAX:052-744-2785
E-mail:iga-sous”AT”adm.nagoya-u.ac.jp
AMED事業
日本医療研究開発機構(AMED)
疾患基礎研究事業部 疾患基礎研究課 革新的がん医療実用化研究事業
TEL:03-6870-2286 FAX:03-6870-2243
E-mail:cancer”AT”amed.go.jp
創薬事業部 医薬品研究開発課 次世代がん医療創生研究事業
TEL:03-6870-2219 FAX:03-6870-2244
E-mail:cancer”AT”amed.go.jp
※E-mailは上記アドレス“AT”の部分を@に変えてください。
掲載日 令和4年3月28日
最終更新日 令和4年3月28日


