慢性便秘治療薬ルビプロストンの腎保護作用を世界で初めて臨床試験で確認―腸内細菌叢の改善でミトコンドリア機能が向上―
プレスリリース
国立大学法人東北大学
国家公務員共済組合連合会虎の門病院
国立大学法人山形大学医学部
国立研究開発法人日本医療研究開発機構
発表のポイント
- 慢性便秘治療薬ルビプロストン(注1)が慢性腎臓病(CKD)(注2)患者の腎機能の悪化を抑制することを世界で初めて確認しました。
- 患者検体の網羅的解析(注3)から、ルビプロストンは腸内細菌叢(注4)を変化させることで、ミトコンドリア(注5)機能を改善するスペルミジン(注6)の産生を促進し、腎臓のミトコンドリア機能を改善することが明らかとなりました。
- 本成果は、腸内環境を変化させることによりミトコンドリア機能を改善し、腎機能低下を抑制できる新しい治療戦略の可能性を示します。今後はCKDのみならずミトコンドリア異常疾患の治療開発への応用が期待されます。
概要
CKDは世界の主要な健康問題の一つです。腎不全が進行すると透析に至るため、その治療法の開発が急務ですが、腎機能を改善する薬はありませんでした。
東北大学大学院医学系研究科および医工学研究科の阿部高明教授らの研究グループは、CKD患者では合併する便秘によって腸内細菌叢の乱れが生じ腎機能の悪化につながると考えました。そこで国内9つの医療機関で中程度のCKD患者118名を集め、ルビプロストンの腎機能に対する効果を検証する第Ⅱ相臨床試験(注7)の多施設共同臨床試験(LUBI-CKD TRIAL)を実施しました。その結果、ルビプロストン8µgおよび16 μgを投与した患者群では、プラセボ群と比較して腎機能(eGFR)(注8)の低下が用量依存的に抑制されました。そのメカニズムとして、ルビプロストンによってミトコンドリア機能を改善するスペルミジンを産生する菌が腸内で増え、血中のスペルミジン濃度が上昇して腎臓のミトコンドリア機能を改善することで腎保護効果をもたらすことを明らかにしました(図1)。本成果は、下剤が腸内環境を変化させることでミトコンドリアを介して腎機能低下を抑制できるという新しい治療戦略の可能性を示すものであり、今後CKDのみならずミトコンドリア異常疾患の治療開発への応用が期待されます。本研究成果は、2025年8月30日付で、科学誌Science Advancesに掲載されました。
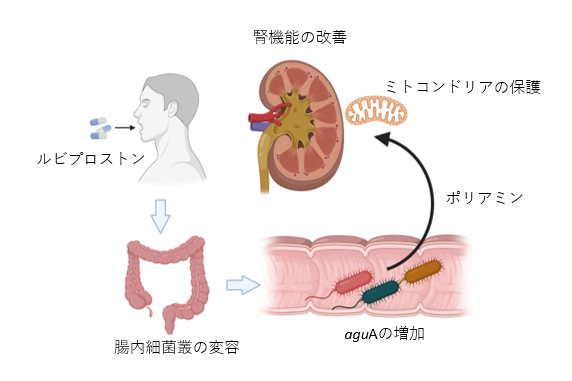
詳細な説明
研究の背景
慢性腎臓病(CKD)は成人の有病率が高く、効果的な治療法が限られています。そのため末期腎不全や透析に至る患者数は年々増加傾向にあります。近年CKD患者に多い便秘やそれに伴う腸内細菌叢の乱れが尿毒症毒素の蓄積や全身の炎症を引き起こし、腎機能低下を加速させる一因と考えられてきました。研究チームはこれまでの動物実験で慢性便秘治療薬(ルビプロストンやリナクロチドなど)が尿毒症毒素を減少させ、腎機能を改善することを報告してきました(参考文献1、2)。しかし、ヒトのCKD患者におけるルビプロストンの有効性と安全性、特に腎機能への直接的な影響は明らかになっていませんでした。
今回の取り組み
東北大学大学院医学系研究科病態液性制御学分野および医工学研究科分子病態医工学分野教授の阿部 高明(あべ たかあき)、東北大学病院腎臓・高血圧内科医師の渡邉 駿(わたなべ しゅん)らの研究グループは、ルビプロストンによる腎不全進行抑制効果の検証のため、2016年から2019年にかけて日本の9つの医療機関(東北大学病院、東京慈恵会医科大学附属病院、地域医療機能推進機構仙台病院、虎の門病院(分院腎センター内科/リウマチ膠原病科)、秋田大学医学部附属病院、千葉大学医学部附属病院、順天堂大学医学部附属順天堂医院、山形大学医学部附属病院、福島県立医科大学附属病院)で多施設共同臨床試験(LUBI-CKD TRIAL)を実施しました。本研究ではCKDステージIIIb-IVの患者118名を対象に、ルビプロストン(8μgまたは16μg/日:国内未承認用量)あるいはプラセボを24週間投与しその有効性と安全性を評価しました。
その結果、主要評価項目の尿毒症毒素(インドキシル硫酸)の血中濃度に有意な変化は見られませんでした。一方、副次評価項目である腎機能においてルビプロストン16μg群ではeGFRの低下がプラセボ群と比較して有意に抑制されました(p = 0.0457)。この効果は特に中等度の腎機能障害(eGFR 36-45 ml/min/1.73m2)を持つ患者で8μg、16μgの両群で顕著でした(図2)。安全性については主な副作用(薬との関係がわかっていないものも含みます)は軽度から中等度の消化器症状であり全体として良好な忍容性が確認されました。
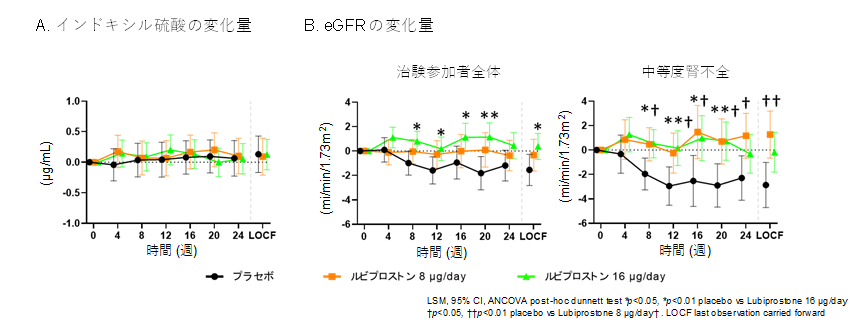
- 主要評価項目であるインドキシル硫酸の変化量。ルビプロストンの投与で変化は生じなかった。
- eGFRの変化量。ルビプロストン16µg投与群で有意に腎機能の低下が抑制された。この効果は中等度腎不全群でより顕著であった。
治験参加者全体(プラセボ n = 34, ルビプロストン 8µg/day n = 33, ルビプロストン 16µg/day n = 49)、中等度腎不全(プラセボ n = 17,ルビプロストン 8µg/day n = 16, ルビプロストン 16µg/day n = 22)
次にルビプロストンの腎保護効果のメカニズムを解明するため、臨床試験の患者検体 (血液、尿、便)を用いたマルチオミクス解析を実施しました。その結果、ルビプロストン投与群では短鎖脂肪酸を産生する善玉菌であるBlautia属やRoseburia属などが増加していました。さらにこれらの細菌が持つポリアミン合成酵素遺伝子(agmatine deiminase, aguA)DNA量が増加し、それに応じてポリアミンの一種である血中のスペルミジンの濃度が上昇していることが分かりました (図3)。
。
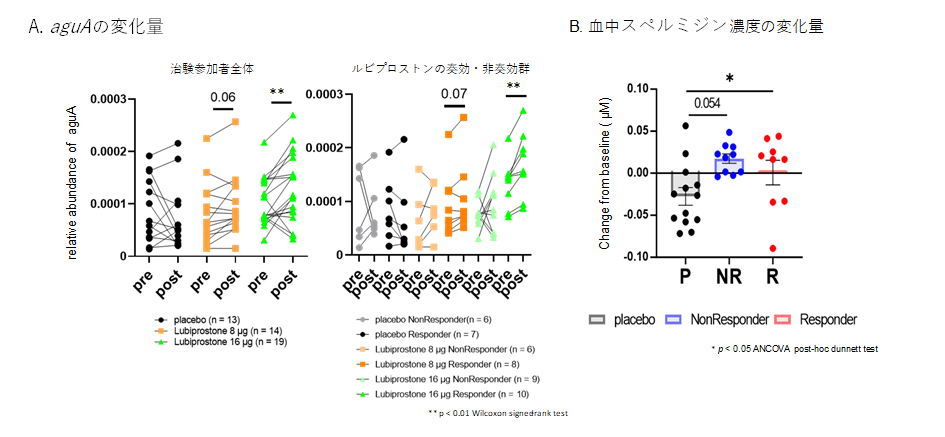
- ルビプロストン投与による便中のaguA DNA量の増加を認めた。この効果はルビプロストン投与で腎機能が改善した群に強くみられた(A右図、ルビプロストンの効果が現れた群(奏功群)と現れなかった群(非奏功群)に分けた分析)。
- aguAの下流で生成されるスペルミジンはルビプロストン投与群の血中で増加した。
プラセボ群(P)、ルビプロストンの効果が現れなかった群(NR)、ルビプロストンの効果が現れた群(R)。
腎不全モデルマウスにスペルミジンを経口投与したところ腎機能が改善し、ミトコンドリアの形態異常と機能不全が回復することが確認されました(図4)。加えてヒト腎尿細管細胞を用いた実験でもスペルミジンがミトコンドリアのATP産生能を高めることが示されました。
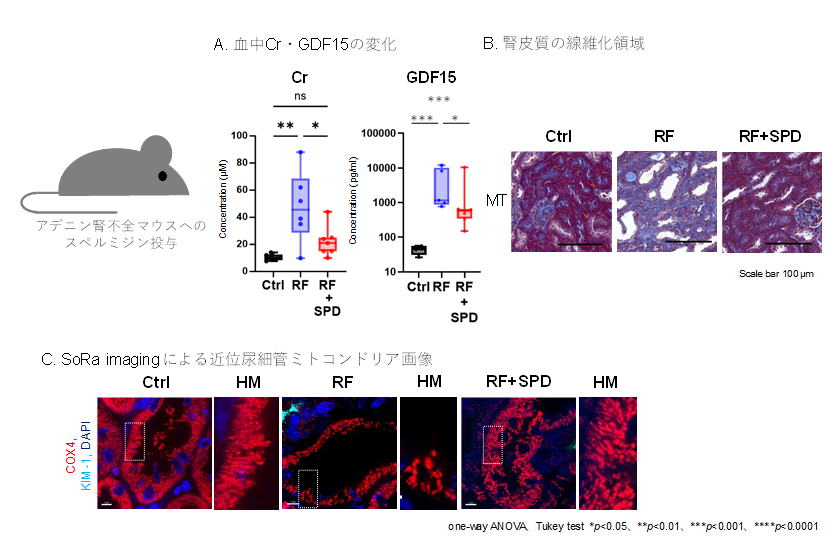
- スペルミジンの投与で腎機能(クレアチニン,Cr)の改善とミトコンドリア障害マーカー(GDF15)の低下を認めた。
- マウスの腎皮質のMasson-Trichrome(MT)染色。スペルミジン投与により尿細管線維化領域の縮小化を認めた。
- 超解像共焦点画像SoRa imagingを用いて尿細管のミトコンドリアを観察した。腎不全で断片化したミトコンドリアのスペルミジンによる改善を認めた。
コントロール群(Ctrl)、腎不全群(RF)、スペルミジン群(RF+SPD).
HM: Ctrl, RF, RF+SPDの画像の□の部分を拡大した画像
これらの結果からルビプロストンは腸内細菌叢を介してスペルミジン産生を促し、腎臓のミトコンドリア機能を改善することで腎保護効果を発揮するというこれまで知られていなかった作用機序が強く示唆されました。
今後の展開
本研究は、慢性便秘治療薬ルビプロストンが「腸内細菌-ポリアミン-ミトコンドリア」という新たな経路を介して腎保護作用を発揮することをヒト臨床試験の解析から世界で初めて示した点で画期的です。この発見はこれまで尿毒症毒素の低減を主目的としてきた従来のCKD治療の考え方を大きく転換させる可能性があります。
今後はより大規模な集団で本試験結果の検証を行うとともに(臨床第Ⅲ相試験)、治療効果を予測するバイオマーカー(注9)の探索を進めることでCKD患者一人ひとりに最適な治療法の提供を目指します。さらにCKDのみならずミトコンドリア異常疾患の治療開発への応用が期待されます。
謝辞
本研究は文部科学省科学研究費補助金(JSPS KAKENHI)21H02932、18H02822、日本医療研究開発機構(AMED)橋渡し研究戦略的推進プログラム「慢性便秘薬ルビプロストンの慢性腎不全治療薬としての適応拡大を目指す臨床研究」、創薬基盤推進研究事業「腎不全患者治療コホートを用いた腸内細菌および代謝物解析による新規腎不全治療に関する研究開発」、ムーンショット型研究開発事業「ミトコンドリア先制医療」の支援を受けて行われました。
また本臨床試験はスキャンポファーマ合同会社より薬剤の提供を受けて行われました。
本論文は「東北大学2025年度オープンアクセス推進のためのAPC支援事業」 の支援を受け、Open Accessとなっています。
用語説明
- (注1)ルビプロストン
- 小腸のクロライドチャネルを活性化させて腸管内への水分泌を促し、便を柔らかくすることで排便を促進する慢性便秘症治療薬。
- (注2)慢性腎臓病(CKD)
- 腎臓の働きが健康な人の60%未満に低下するか、あるいはタンパク尿など腎臓の異常が3カ月以上続く状態。進行すると透析や腎移植が必要になります。
- (注3)網羅的解析(マルチオミクス解析)
- 遺伝子やタンパク質、代謝物など、体の中の様々な物質を一度に大量に測定し、生命現象を全体像として捉える研究アプローチ。
- (注4)腸内細菌叢
- 私たちの腸内に生息する、多種多様な細菌の集まり。『腸内フローラ』とも呼ばれます。
- (注5)ミトコンドリア
- 細胞内に存在する小器官で、酸素を使って生命活動に必要なエネルギーの大部分を作り出すため、「細胞のエネルギー工場」と呼ばれています。
- (注6)スペルミジン
- 体内のほぼすべての細胞に存在するポリアミンの一種。細胞の成長や機能維持に必須で、近年、ミトコンドリア機能の改善や抗炎症作用、長寿への関与などが報告され注目されています。
- (注7)第Ⅱ相臨床試験
- 新しい薬や治療法を開発する過程で行われる臨床試験(治験)の段階の一つ。少数の患者さんを対象に、薬の有効性(効果があるか)、安全性、そして最適な投与量などを調べることを目的とします。
- (注8)推算糸球体濾過量(eGFR)
- 血清クレアチニン値などから、腎臓が老廃物を排泄する能力(糸球体濾過量)を推算した値。腎機能の重要な指標です
- (注9)バイオマーカー
- 体の状態の変化や病気の進行度、薬の効果などを客観的に評価するための、血液や尿などから得られる指標。
- 参考文献1、2
-
- Mishima E. et al. Alteration of the Intestinal Environment by Lubiprostone Is Associated with Amelioration of Adenine-Induced CKD.
J Am Soc Nephrol 2015 Aug;26(8):1787-94 - Nanto-Hara F. et al. The guanylate cyclase C agonist linaclotide ameliorates the gut-cardio-renal axis in an adenine-induced mouse model of chronic kidney disease.
Nephrol Dial Transplant. 2020 Feb 1;35(2):250-264
- Mishima E. et al. Alteration of the Intestinal Environment by Lubiprostone Is Associated with Amelioration of Adenine-Induced CKD.
論文情報
- タイトル
- Lubiprostone in Chronic Kidney Disease: Insights into Mitochondrial Function and Polyamines from a Randomized Phase 2 Clinical Trial
- 著者
- Shun Watanabe, Masaaki Nakayama, Takashi Yokoo, Satoru Sanada, Yoshifumi Ubara, Atsushi Komatsuda, Katsuhiko Asanuma, Yusuke Suzuki, Tsuneo Konta, Junichiro J Kazama, Takehiro Suzuki, Shinji Fukuda, Tomoyoshi Soga, Takuji Yamada, Sayaka Mizutani, Mitsuharu Matsumoto, Yuji Naito, Kensei Taguchi, Kei Fukami, Hitomi Kashiwagi, Koichi Kikuchi, Chitose Suzuki, Hidetaka Tokuno, Marina Urasato, Ryota Kujirai, Yotaro Matsumoto, Yasutoshi Akiyama, Yoshihisa Tomioka, Shun Itai, Yoshiyasu Tongu, Eikan Mishima, Chiharu Kawabe, Tomoko Kasahara, Yoshiaki Ogata, Takafumi Toyohara, Takeya Sato, Tetsuhiro Tanaka, Takaaki Abe* and the LUBI-CKD TRIAL Investigators
*責任著者:東北大学大学院医学系研究科・医工学研究科 教授 阿部高明 - 掲載誌
- Science Advances
- DOI
- https://doi.org/10.1126/sciadv.adw3934
お問い合わせ先
研究に関すること
東北大学大学院医学系研究科病態液性制御学分野
大学院医工学研究科分子病態医工学分野
教授 阿部高明
Email:mitomoonshot”AT"grp.tohoku.ac.jp
報道に関すること
東北大学大学院医学系研究科・医学部広報室
TEL:022-717-8032
Email:press.med”AT”grp.tohoku.ac.jp
虎の門病院広報企画室
TEL:03-3588-1111(代表)
Email:kikakuka”AT”toranomon.gr.jp
山形大学医学部総務課庶務担当(広報)
Email:yu-isokoho”AT”jm.kj.yamagata-u.ac.jp
AMED事業に関すること
日本医療研究開発機構(AMED)
シーズ開発・基礎研究事業部挑戦的研究開発課
TEL:03-6870-6893
Email:[email protected]
※E-mailは上記アドレス“AT”の部分を@に変えてください。
掲載日 令和7年9月1日
最終更新日 令和7年9月1日


