脊髄損傷急性期に対する組換えヒトHGF製剤(KP-100IT)の国内第I/II相臨床試験結果について
成果情報
クリングルファーマ株式会社
国立研究開発法人日本医療研究開発機構
要旨
脊髄損傷急性期患者に対し、組換えヒトHGF製剤(KP-100IT)を脊髄腔内投与したときの安全性および有効性を確認する第I/II相臨床試験(多施設共同プラセボ対照二重盲検比較試験)をクリングルファーマ株式会社(本社:大阪府茨木市、以下 クリングルファーマ)の企業治験として実施しました。
まず安全性についての評価を行いましたが、KP-100IT投与後に治験薬と因果関係のある重篤な有害事象は認めませんでした。また、KP-100ITに対する抗体が検出されなかったことから、大きな問題はないと判断しました。
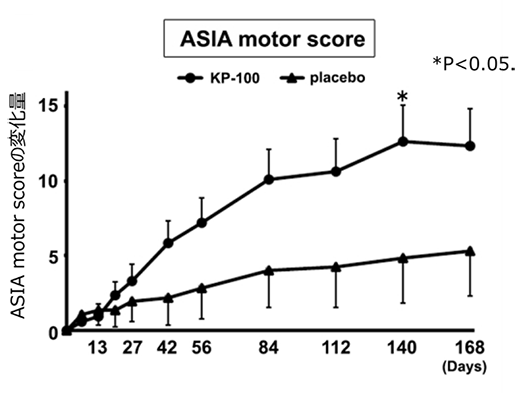
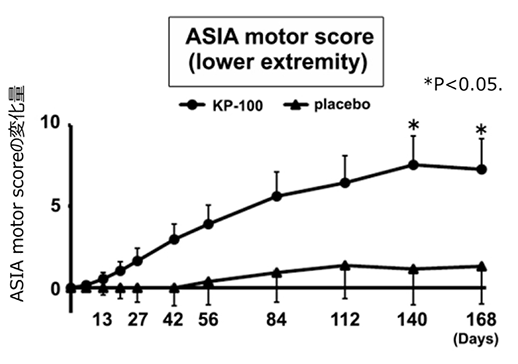
有効性については、主要評価項目のASIA motor score(*1)において、プラセボ群に比べてKP-100IT群で経時的に一貫して回復傾向が見られ、受傷後20週(Day140)時点で有意な改善が認められました。また、上肢/下肢別運動機能の評価では、下肢運動機能のDay140時点およびDay168時点において、KP-100IT群で有意な回復を認めました。さらに、受傷時に運動および感覚機能が完全に麻痺した患者を対象として解析を行ったところ、最終観察時において下肢運動機能を獲得した割合は、プラセボ群が6.3%(1/16例)に対してKP-100IT群が33.3%(5/15例)で回復患者の割合に違いがありました(p=0.083)。
以上の結果より、脊髄損傷急性期患者に対するKP-100IT投与は安全性に大きな問題がなく、また有効性も示唆されることから、今回の第I/II相臨床試験の結果についてJournal of Neurotrauma誌で報告いたしました(以下、原論文情報参照)。
本試験は、慶應義塾大学医学部生理学教室 岡野栄之教授、整形外科学教室 中村雅也教授らの研究成果を基に、中村雅也教授を治験調整医師として実施されました。
本研究は、平成23年度に国立研究開発法人科学技術振興機構(JST)研究成果展開事業・研究成果最適展開支援プログラム(A-STEP)・本格研究開発ステージ(実用化挑戦タイプ、創薬開発)に「組換えHGF蛋白質による脊髄損傷治療薬」(研究者:中村雅也、企業:クリングルファーマ株式会社、H23~26年度)として採択され、平成27年度に国立研究開発法人日本医療研究開発機構(AMED)に移管され医療分野研究成果展開事業・研究成果最適展開支援プログラム(AMED・A-STEP、H27~28年度)による支援を受け、第I/II相臨床試験を実施するために必要な非臨床試験および治験薬製造を行い、第I/II相臨床試験を開始しました。
その後、創薬支援推進事業・希少疾病用医薬品指定前実用化支援事業(H28~30年度)の支援を受けて、第I/II相臨床試験を実施しました。
背景
脊髄損傷とは
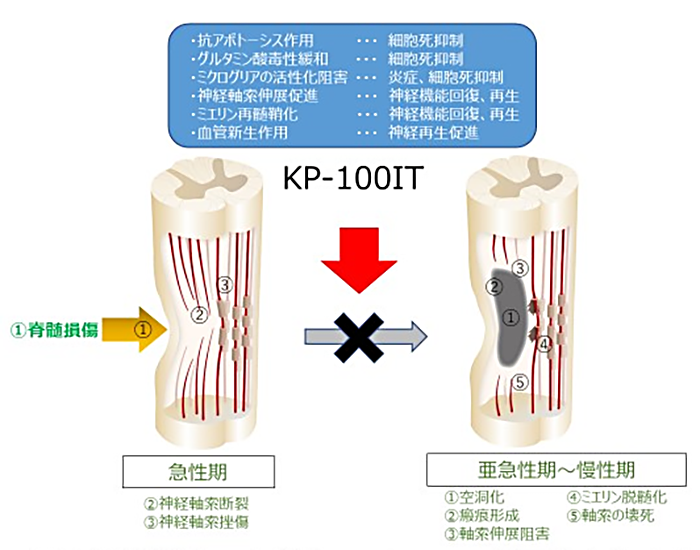
脊髄損傷は、交通事故や転倒などによって脊髄実質が損傷し、末梢の運動・感覚・自律神経系の麻痺をきたす難治性疾患です。国内の脊髄損傷患者の発生者数は5,000人/年と推定されており、近年は、交通事故やスポーツによる受傷者が減少する一方で、高齢化社会の進展に伴い高齢者の受傷が増加傾向にあります。病態では、最初の脊髄損傷受傷に続いて、急性期に炎症反応等によって損傷した部分が拡大する現象(二次損傷)が起こり、慢性期には脱落した神経細胞が空洞化し回復しにくくなります(図1)。このため、脊髄損傷治療では、二次損傷を抑制してできるだけ多くの脊髄を残存させることが最も重要です。二次損傷抑制は大きな運動機能回復に繋がり、患者やご家族のQOL(*2)の向上に貢献すると期待されます。現在、脊髄損傷急性期に使用できる有効かつ安全な治療薬はありません。
HGFとは
肝細胞増殖因子(HGF)は成熟肝細胞のDNA合成を促進する生体内物質として日本で発見されましたが、その後の研究によって、肝臓以外の多くの組織・臓器に対しても広く生物活性を示すことが明らかになりました。神経細胞および支持細胞に対しても作用する神経栄養因子としても多くの報告があり、様々な神経変性疾患の治療薬となることが期待されています。HGFは、脊髄損傷において、急性期の二次損傷による神経細胞死を抑制し、神経や血管の再生を促す多面的な治療効果が期待されています(図1)。これまで、ラットやマーモセットを用いた脊髄損傷動物モデルにおいて治療効果が報告されております(参考文献1-3)。 クリングルファーマでは、これまで組換えヒトHGFタンパク質(KP-100)の開発を進めており、中枢神経疾患に対する治療薬(*3)として脊髄腔内投与製剤(KP-100IT)を開発しました。
試験の概要(UMIN: 000014434、CrinicalTrials.gov: NCT02193334として登録)
本試験は、以下の3つの脊髄損傷専門病院の協力を得て実施いたしました。
- 独立行政法人 労働者健康安全機構 総合せき損センター
- 独立行政法人 労働者健康安全機構 北海道せき損センター
- 国立病院機構 村山医療センター
脊髄損傷では損傷の程度によって回復が異なると言われています。そこで、KP-100ITの効果が検出されやすくすることを目的として、本試験の対象患者は自然回復の少ない頚髄損傷(*4)で運動完全麻痺(改良Frankel分類 A/B1/B2)(*5)の重度の患者を対象としました。また、受傷直後の脊髄ショック(*6)から離脱する3日後を待って厳密に重症度評価を行いました。投与はKP-100ITまたはプラセボを受傷後3日後から開始し、週1回間隔で合計5回反復投与を行い、入院しながらリハビリテーションを継続し6か月間の観察を行いました。試験の期間は2014年6月から2018年5月までで、45例が登録されました(実薬群28例、プラセボ群17例)。
KP-100IT投与により、主要評価項目のASIA motor scoreの受傷後Day168時点の変化量ではプラセボ群に対して有意差はありませんでした。しかしながら、経時的な推移では両側P < 0.100で差が一貫しており、Day140時点では有意差が得られました(図2)。また、上肢/下肢別運動機能の評価では、下肢運動機能のDay140時点およびDay168時点で有意差が認められました(図3)。重度の頚髄損傷完全麻痺患者では、最終観察時において下肢運動機能を獲得した症例は僅か6.3%であり、殆ど回復は得られませんでした。しかしKP-100IT群では、33.3%の患者が終了時に下肢運動機能を獲得しました。
安全性については、軽度の副作用のみで治験薬と因果関係のある重篤な有害事象はなく、KP-100ITに対する抗体が検出されなかったことから、安全性に大きな問題はないと考えられます。
以上の結果より、脊髄損傷急性期患者の対するKP-100ITの投与は安全性に大きな問題はなく、機能回復効果を有する可能性があることが明らかとなりました。
今後の期待
脊髄損傷治療においては、炎症による二次損傷範囲拡大を抑制することが最も重要であり、多くの脊髄神経が残存することが運動機能回復に繋がり、患者やご家族の予後QOLに大きく貢献できると考えられます。KP-100ITによる治療は、安全性に加えて、受傷後に直ちに投与できる製剤の利便性からも急性期治療に適した薬剤と言えます。また、この二次損傷を早期に抑制する効果によって、将来的には亜急性期~慢性期治療として期待されるiPS細胞由来神経幹細胞等の細胞治療の効果を高めることも期待されます。
本試験は、重度の頚髄損傷急性期患者に対して実施したプラセボ対照二重盲検比較試験であり、安全性に大きな問題がないこと、および、有効性の示唆を確認しました。本試験結果を受け、KP-100ITは2019年9月に厚生労働省により希少疾病用医薬品(*7)指定を受けました。今後、第III相臨床試験開始を計画しており、国内での早期の薬事承認取得を目指します。日本発の創薬シーズである組換えヒトHGFタンパク質を産学官連携により神経難病の治療薬として社会実装する医学的・社会的意義は大きく、日本から世界に画期的な新薬を発信することが期待されます。
用語説明
- (*1)AISA motor score
- 米国脊髄障害学会による運動機能を評価する指標で、上肢(50点)と下肢(50点)の運動機能スコアの合計(100点)で構成される。
- (*2)QOL(Quality of Life)
- 治療や療養生活を送る患者の身体的、精神的、社会的、経済的にみた「生活の質」。
- (*3)中枢神経疾患に対する治療薬
- 中枢神経は脳(大脳、脳幹、小脳)と脊髄で構成される。これまでの基礎研究から、HGFはALS(筋萎縮性側索硬化症)、脳梗塞、パーキンソン病等の動物モデルで治療効果が確認されている。KP-100ITは脊髄損傷の他にALS患者に対する第II相臨床試験(医師主導治験)が進められている。
- (*4)頚髄損傷
- 首の部分に存在する脊髄の損傷で、頚髄を損傷された人は、手・足・体に障害(四肢麻痺)が起こる。
- (*5)改良Frankel分類
- 脊髄損傷の神経学的損傷高位を評価する指標で、総合せき損センターにより細分化された。
- (*6)脊髄ショック
- 重度頚髄損傷患者は、受傷直後から2、3日までは神経症状が不安定で、損傷部位以下の運動・知覚機能および脊髄反射も消失することがある。
- (*7)希少疾病用医薬品
- 患者数が国内において5万人未満、医療上の必要性(代替えする治療法がない等)、および開発の可能性(疾患に対して利用する理論的根拠がある等)の条件を満たすものとして厚生労働大臣が指定する。指定により、助成金の交付、指導・助言、優先審査、再審査期間の延長等の支援を受けることができる。
原論文情報
- 論文名:
- A phase I/II study for intrathecal administration of recombinant human hepatocyte growth factor in patients with acute spinal cord injury: a double-blind, randomized clinical trial of safety and efficacy
- 著者:
- Nagoshi N, Tsuji O, Kitamura K, Suda K, Maeda T, Yato Y, Abe T, Hayata D, Matsumto M, Okano H, Nakamura M.
- 掲載誌:
- Journal of Neurotrauma
- DOI:
- 10.1089/neu.2019.6854.
参考文献
- Kitamura K, Iwanami A, Nakamura M, Yamane J, Watanabe K, Suzuki Y, Miyazawa D, Shibata S, Funakoshi H, Miyatake S, Coffin R.S, Nakamura T, Toyama Y, Okano H. Hepatocyte growth factor promotes endogenous repair and functional recovery after spinal cord injury. J.Neurosci. Res. 2007; 85: 2332-2342.
- Kitamura K, Fujiyoshi K, Yamane J, Toyota F, Hikishima K, Nomura T, Funakoshi H, Nakamura T, Aoki M, Toyama Y, Okano H, Nakamura M. Human hepatocyte growth factor promotes functional recovery in primates after spinal cord injury. PLoS One. 2011; 6: e27706.
- Kitamura K, Iwanami A, Iwai H, Toyama Y, Matsumoto M, Okano H, Nakamura M. Therapeutic Time Window and Preclinical Efficacy of Intrathecal Administration of Recombinant Human Hepatocyte Growth Factor for Acute Spinal Cord Injury. J Spine Res. 2016;7: 934-93.
お問い合わせ先
KP-100に関するお問い合わせ先
クリングルファーマ株式会社 医薬開発部
〒567-0085 大阪府茨木市彩都あさぎ7-7-15 彩都バイオインキュベータ207
TEL:072-641-8739
E-mail:kpinfo“AT”kringle-pharma.com
AMED事業に関するお問い合わせ先
国立研究開発法人日本医療研究開発機構(AMED) 実用化推進部 研究成果展開推進課
〒100-0004 東京都千代田区大手町1-7-1
TEL:03-6870-2214
E-mail:amed-astep“AT”amed.go.jp
※E-mailは上記アドレス“AT”の部分を@に変えてください。
掲載日 令和2年6月19日
最終更新日 令和2年6月19日


