成果情報 老化細胞を選択的に死滅させる薬剤候補を同定
成果情報
大阪大学
日本医療研究開発機構
概要
大阪大学微生物病研究所の原英二教授(兼:大阪大学免疫学フロンティア研究センター)、脇田将裕特任助教らを中心とする研究グループは老化細胞を選択的に死滅させる薬剤候補を見出しました。本研究成果は老化細胞がなぜ、加齢とともに体内に蓄積するのかを明らかにすると同時に、生体にとって有害な老化細胞を体内から除去することでがんを含めた様々な加齢性疾患の発症を遅延させる治療薬の開発へと発展する可能性が期待されるものです。本研究成果は令和2年4月22日付けで英国の科学雑誌『Nature Communications』にオンライン掲載されました。
背景
正常な細胞は発がんの危険性がある修復不可能なDNA損傷が生じると、アポトーシス(注1)を起こして死滅するか、細胞老化(注2)を起こして細胞周期の進行を不可逆的に停止することが知られています。これらの現象は、異常細胞の増殖を防ぐ重要ながん抑制機構として働いていると考えられてきました。しかし、アポトーシスとは異なり、細胞老化を起こした細胞(以下、「老化細胞」と呼ぶ)は生存可能なため、加齢とともに老化細胞が体内に蓄積していくことが分かっています。さらに体内に蓄積した老化細胞は炎症性サイトカインやケモカインなどの炎症性物質を分泌するSASP(注3)と呼ばれる現象を引き起こすことで慢性炎症を惹起し、がんを含めた様々な炎症性疾患の発症を促進することがわかってきました。また、遺伝子改変マウスを用いて老化細胞を死滅させると、がんを含めた加齢性疾患の発症率が著しく低下し、加齢に伴う生体機能の低下もある程度遅延することが報告されるようになってきました。このため、体内に蓄積した老化細胞を選択的に死滅させる薬剤(セノリティックドラッグ)を開発することが出来れば、がんを含めた加齢性疾患の発症を抑え、健康寿命の延伸につながるのではないかと期待されています。
研究内容
大阪大学の原英二教授らのグループは武田薬品工業(株)のオープンイノベーションプラットフォーム(RINGO-T)を利用し、大規模低分子化合物ライブラリーを用いたハイスループットスクリーニングを行い、セノリティックドラッグの候補物質を15個同定しました。そのうち最も活性が高かった4化合物がBET(Bromodomain and extra-terminal family protein)(注4)inhibitorであることがわかりました。そこで、最近開発された強力なBET inhibitorであるBET degrader(従来のBET inhibitorにE3ユビキチンリガーゼに結合する化合物を付加することで、BET-family蛋白質を選択的かつ効果的に分解できる化合物)を、これまでに報告のあるセノリティックドラッグ候補薬剤と比較してみました。その結果、BET degraderの一つであるARV825がセノリティックドラッグとしての効果が最も高いことがわかりました。また、ARV825の作用機序を解析したところ、BET- family蛋白質の一つであるBRD4の分解促進を介して老化細胞で働く主なDNA二重鎖切断修復機構である非相同末端結合(non-homologous end-joining:NHEJ)(注5)を阻害すると同時に、オートファジー関連遺伝子群の発現上昇を促進することで老化細胞の細胞死(senolysis)を引き起こすことを明らかにしました(図1参照)。
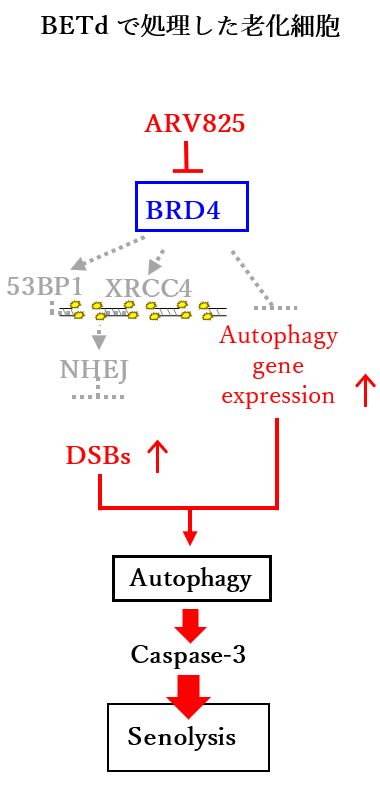
さらにARV825が生体内でもセノリティックドラッグとして働くかどうかを確認するために、細胞老化を起こした肝星細胞(伊東細胞)(注6)によって肝がんの発症が促進されることが知られている肥満マウスにARV825を投与したところ、細胞老化を起こした伊東細胞が減少し、肝がんの発症率も低下することがわかりました(図2参照)。また、ヒトのがん細胞を移植したヌードマウスにDNA損傷性薬剤であり抗がん剤として知られるDoxorubicinを投与した後にARV825を投与すると、Doxorubicinの投与により発生した老化細胞が減少し、Doxorubicinによる腫瘍抑制効果が増強されることがわかりました。最近、抗がん剤処理や放射線照射で生き残ったがん細胞の一部が細胞老化様の増殖停止を起こし、更にSASPを起こすことでがんの再発や悪性化を引き起こす可能性が指摘されており、BET degraderのようなセノリティックドラッグは抗がん剤の治療効果の向上にも貢献できる可能性が期待されます。
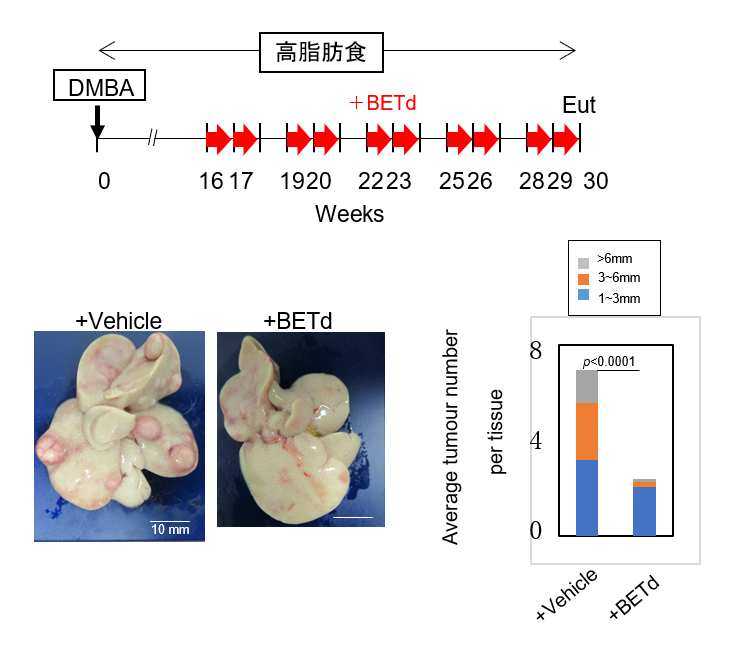
DMBA(7,12-dimethylbenz [a] anthracene)は、発がん物質。
肥満マウスは、30週目で安楽死させた(Eut)。
左下図:肥満マウスの肝臓。左側(+Vehicle)は対照、右側(+BETd)はARV825投与例。
右下図:肥満マウスの肝臓に見られた腫瘍の平均数。
将来の展望
上記の研究成果は、老化細胞の生存維持に関わる分子メカニズムの一端を明らかにすると同時に、そこに関わる分子を標的とすることで有害な老化細胞の蓄積を防ぐことが出来る可能性を示唆しています。今後、さらに研究を続けることで有害な老化細胞の蓄積を防ぎ、健康寿命の延伸に貢献できる可能性が期待されます。一方、老化細胞を死滅させた場合に生体にとって負の作用が起きる可能性についても検討が必要であり、今後さらなる研究により、安全かつ効果的な老化細胞制御方法の開発を目指していきたいと考えています。
研究組織、事業と成果の公表
本成果は大阪大学、公益財団法人がん研究会、武田薬品工業株式会社、大阪市立大学との共同研究によるものです。また本研究は、以下の研究費の支援によって行われました。
- 日本医療研究開発機構(AMED)老化メカニズムの解明・制御プロジェクト「老化機構・制御研究拠点」(研究代表者:原英二 大阪大学 微生物病研究所 教授)
- 日本医療研究開発機構(AMED)次世代がん医療創生研究事業「腸内細菌を指標とした大腸がんの早期診断方法の開発」(研究代表者:原英二 大阪大学 微生物病研究所 教授)
論文情報
- タイトル
- A BET family protein degrader provokes senolysis by targeting NHEJ and autophagy in senescent cells
- 著者
- Masahiro Wakita, Akiko Takahashi, Osamu Sano, Tze Mun Loo, Yoshinori Imai, Megumi Narukawa, Hidehisa Iwata, Tatsuyuki Matsudaira, Shimpei Kawamoto, Naoko Ohtani, Tamotsu Yoshimori, & Eiji Hara
- 雑誌
- Nature Communications (2020)11:1935
- DOI番号
- 10.1038/s41467-020-15719-6
用語解説
- (注1)アポトーシス
- 細胞が構成している組織をより良い状態に保つため、細胞自体に組み込まれた細胞死プログラムであり、あらかじめ予定されている細胞の死を指します。
- (注2)細胞老化
- 正常な哺乳動物の体細胞は細胞分裂を繰り返しながら増殖しますが、その多くはある一定の回数しか分裂することが出来ません。限界まで分裂した細胞は細胞分裂を不可逆的に停止し、もはや分裂を再開することはありません。この現象が「細胞老化」と呼ばれ、細胞の分裂回数を制限することで、細胞が過度に増殖してがん化することを防いでいると考えられています。また、分裂限界に達する前でも、がん遺伝子の活性化など、細胞に発がんの危険が生じると、速やかに細胞老化と同様な不可逆的な細胞分裂停止を起こすことも明らかになっています。
- (注3)SASP
- 細胞老化を起こした細胞は、単に細胞分裂を停止して増殖を抑えるだけではなく、炎症性サイトカインを含む様々な分泌性タンパク質を高発現します。この現象は、SASP(Senescence associated secretory phenotype)と呼ばれ、SASPにより分泌されるタンパク質をSASP因子と呼びます。
- (注4)Bromodomain and extra-terminal family protein(BET)
- 染色体を構成するヒストンの内、アセチル化したヒストンを認識し、転写因子を動員することで遺伝子の転写を調節する分子のことです。細胞において様々な遺伝子の発現制御に関与しています。
- (注5)非相同末端結合(NHEJ)
- DNA二重鎖切断のDNA修復メカニズムの一つ。DNA末端を直接繋ぎ合わせるため、鋳型となる姉妹染色分体を必要とする相同組換えと異なり、細胞周期のすべての時期において作用します。しかし、鋳型を用いないためDNA末端の接合部において変異が起こりやすくなります。
- (注6)肝星細胞(伊東細胞)
- 肝臓を構成する細胞のことです。肝障害時に活性化し、肝臓の創傷治癒に大きな役割を果たすことが知られています。
お問い合わせ先
研究に関すること
大阪大学 微生物病研究所 遺伝子生物学分野 教授 原英二
〒565-0871 大阪府吹田市山田丘3番1号
TEL:06-6879-4260 FAX:06-6105-5882
E-mail:ehara“AT”biken.osaka-u.ac.jp
AMED事業に関すること
日本医療研究開発機構(AMED)
老化メカニズムの解明・制御プロジェクト
疾患基礎研究事業部 疾患基礎研究課
TEL:03-6870-2286 FAX:03-6870-2243
E-mail:aging“AT”amed.go.jp
次世代がん医療創生研究事業(P-CREATE)
創薬事業部 医薬品研究開発課
TEL:03-6870-2311 FAX:03-6870-2244
E-mail:cancer“AT”amed.go.jp
※E-mailは上記アドレス“AT”の部分を@に変えてください。
掲載日 令和2年8月5日
最終更新日 令和2年8月5日


