成果情報 タンパク質リン酸化による液-液相分離制御のしくみを解明―細胞内非膜型オルガネラの構築原理の解明へ―
成果情報
京都大学
日本医療研究開発機構
概要
京都大学大学院生命科学研究科 吉村成弘 准教授、山﨑啓也 同博士課程学生(研究当時、現:東京大学大学院助教)、理化学研究所 平野達也 主任研究員、高木昌俊 同専任研究員、徳島大学先端酵素学研究所 小迫英尊教授らは、タンパク質の翻訳後修飾であるリン酸化が、核小体などの細胞内非膜型オルガネラ1の構造形成および機能発現で重要な役割を果たす「液-液相分離2」を制御する新たな仕組みを解明しました。リン酸化は、タンパク質の立体構造変化を介してその機能を調節することが知られていましたが、立体構造を持たない(天然変性)タンパク質の機能を制御するしくみは不明でした。本研究では、リン酸基による負電荷の付加が天然変性タンパク質の「電荷ブロック」を増減させることで、「液-液相分離」を正または負に制御していることを明らかにしました。本成果は「タンパク質の翻訳後修飾」と「液-液相分離」とを繋ぐ重要な知見です。核小体は、細胞増殖、ウイルス増殖、自然免疫反応、がん、ストレス応答に関係する非膜型オルガネラであり、今後、この知見に基づく作用機序の解明や新たな治療法の開発につながる研究成果が期待されます。
本成果は、2022年5月5日に英国の国際学術誌「Nature Cell Biology」に掲載されました。
背景
リン酸化をはじめとする翻訳後修飾は、細胞内でタンパク質のはたらきを制御する仕組みとして重要な役割を果たしています。立体構造をもつタンパク質分子の特定の場所にリン酸基が付加されると、タンパク質間相互作用や酵素活性などが変化することが知られています。しかし、近年の研究からは、リン酸化はむしろタンパク質の「立体構造を取らない領域(天然変性領域)」に多く生じることが明らかにされていましたが、その意義は不明でした。天然変性領域は、細胞内で液-液相分離を強く示す性質を持っており、核小体などの細胞内非膜型オルガネラの形成と崩壊に重要な役割を果たしています。そして、液-液相分離がリン酸化等の翻訳後修飾により制御される現象が報告されていたものの、そのメカニズムは明らかにされていませんでした。
そこで本研究では、タンパク質の天然変性領域のリン酸化が、そのタンパク質自体とその機能にどのような影響を与えるかを調べました。対象としたのは核小体タンパク質Ki-67とNPM1で、本研究グループの吉村、山﨑と小迫は、これまでにこれらのタンパク質が細胞分裂期への移行にともない多数のリン酸化を受けることを見いだしていました(参考文献) 。
研究手法・成果
Ki-67とNPM1のリン酸化部位とペプチド鎖上の電荷分布との関係を詳細に解析したところ、Ki-67ではリン酸化により「負の電荷ブロックが新たに生じる」こと、NPM1ではリン酸化により「正の電荷ブロックが消失する」ことを見いだしました。また、アミノ酸置換により電荷ブロックを変化させたタンパク質を用いた実験により、この「電荷ブロック」の増大と減少は液-液相分離の亢進と抑制に密接に関係していることを明らかにしました(図A)。さらに、これらの変異タンパク質の細胞内での機能を検証するために、内在性Ki-67を欠損させた細胞に変異タンパク質を発現させたところ、リン酸化に伴う電荷ブロックの変化と、核小体や染色体辺縁部の「非膜型オルガネラ」の形成および崩壊との間に強い相関を見いだしました(図B)。
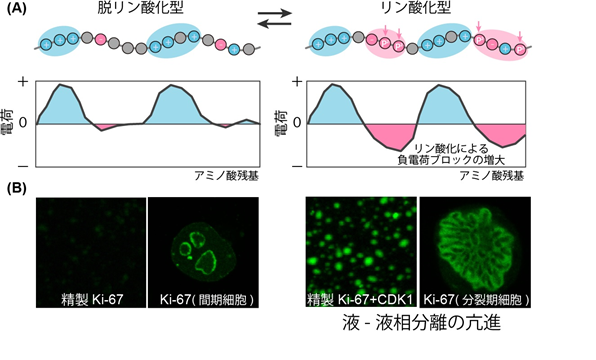
波及効果、今後の予定
本研究の成果は、「立体構造を持たないタンパク質領域に生じるリン酸化はいかにして液-液相分離を制御するか」という生物学の大きな問題にひとつの答えを与えるとともに、液-液相分離により形成される多くの非膜型オルガネラがリン酸化などの翻訳後修飾により制御される仕組みを新たに提示するものです。核小体は、細胞増殖、ウイルス増殖、自然免疫反応、がん、ストレス応答に関係する多機能な非膜型オルガネラであり、その構造と機能において液-液相分離は重要な役割を果たしています。本成果は、これらのメカニズム解明に繋がる重要な内容であり、今後の応用展開が核小体の機能解明や、その異常による疾患の新たな治療法確立へと繋がる大きな可能性を持っています。
研究プロジェクトについて
本研究は、日本医療研究開発機構(AMED)「新興・再興感染症研究基盤創生事業(多分野融合研究領域)」(JP20wm0325009)、「新興・再興感染症に対する革新的医薬品等開発推進研究事業」(JP20fk0108144)、日本学術振興会特別研究員制度(17J090020)、科学研究費助成事業(20K06649, 18H05276, 20H05938)および徳島大学先端酵素学研究所共同利用・共同研究拠点事業の支援を受けて行われました。
用語解説
- 1非膜型オルガネラ
- ミトコンドリアや小胞体などの脂質膜で囲まれた細胞内オルガネラとは異なる、核小体や核スペックルなど脂質膜に囲まれないオルガネラのこと。RNAや天然変性タンパク質が液-液相分離で集合した液状の構造と考えられている。
- 2 液-液相分離
- 系を構成する2種以上の物質(液体)が混じり合うことなく、別々の相に分離すること。タンパク質のような荷電ポリマー溶液の場合、系内のポリマー濃度が一定値を超えると、異なるポリマー濃度をもつ二相(濃厚相と希薄相)に分離する。これはポリマー間の弱い相互作用により生じることが多く、特定の立体構造を取らないタンパク質領域(天然変性領域)でよく見られる。細胞内非膜型オルガネラの構築原理と考えられている。
参考文献
H. Yamazaki, H. Kosako and S.H. Yoshimura (2020) “Quantitative proteomics indicate a strong correlation of mitotic phospho-/dephosphorylation with non-structured regions of substrates.” Biochim. Biophys. Acta. Proteins Proteom., 1868(1): 140295, doi: 10.1016/j.bbapap.2019.140295.
論文タイトルと著者
- タイトル
- Cell cycle-specific phase separation regulated by protein charge blockiness(日本語訳:分裂期リン酸化は電荷ブロック効果を介してタンパク質液-液相分離を制御する)
- 著者
- H. Yamazaki, M. Takagi, H. Kosako, T. Hirano, and S.H. Yoshimura
- 掲載誌
- Nature Cell Biology
- DOI
- 10.1038/s41556-022-00903-1
お問い合わせ先
吉村成弘(よしむら・しげひろ)
京都大学大学院生命科学研究科・准教授
FAX:075-753-7906
E-mail:yoshimura"AT"lif.kyoto-u.ac.jp
京都大学大学院生命科学研究科分子情報解析学分野
報道・取材に関するお問い合わせ先
京都大学 総務部広報課国際広報室
TEL:075-753-5729 FAX:075-753-2094
E-mail:comms"AT"mail2.adm.kyoto-u.ac.jp
AMED事業に関するお問い合わせ先
日本医療研究開発機構
疾患基礎研究部 疾患基礎研究課
新興・再興感染症研究基盤創生事業
TEL:03-6870-2225
E-mail: jprogram"AT"amed.go.jp
※E-mailは上記アドレス“AT”の部分を@に変えてください。
掲載日 令和4年5月27日
最終更新日 令和4年5月27日


