2019年度 研究事業成果集 脳機能を担うAMPA受容体をヒト生体脳で可視化
 世界初のAMPA受容体標識PETプローブを開発
世界初のAMPA受容体標識PETプローブを開発
横浜市立大学学術院医学群生理学 高橋琢哉教授、宮﨑智之准教授らの研究グループは、量子科学技術研究開発機構、慶應義塾大学らとの共同研究により、脳の機能を担う最重要分子であるAMPA受容体をヒトの生体脳で可視化する陽電子断層撮影(PET)用のトレーサー化合物の開発に成功しました。脳の働きを支える重要なAMPA受容体をヒトの生体脳で可視化することにより、これまでブラックボックスであった精神・神経疾患の病態解明や、その情報を根拠にした革新的な診断・治療法の開発が飛躍的に進むものと期待されます。
取り組み
脳には1,000億個以上の神経細胞が存在し、それらが電気信号を伝達することで情報をやりとりし、機能しています。伝達が行われる細胞と細胞の間には「シナプス」とよばれる構造があり、発信側の細胞から分泌された「神経伝達物質」が受け手の細胞の「受容体」に結合することで情報が伝わります。グルタミン酸は興奮性の情報を伝える神経伝達物質の一つであり、記憶や学習など脳の高次機能に重要な役割を果たしています。本研究の対象となっているAMPA受容体はこのグルタミン酸の主要な受容体の一つであり、中枢神経系(脳および脊髄)に広く分布しています(図1)。
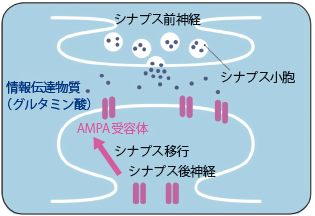
AMPA受容体の生理や機能、精神・神経疾患との関連については、実験動物を用いた基礎研究から多くの知見が得られていました。しかし、それらはヒトの病気のメカニズムの理解や、科学的な根拠に基づいた診断・治療に活かせず、精神・神経疾患の診断や治療効果の判定に際しては、症状の観察や心理検査・脳波検査などに頼るしかありませんでした。その最大の理由として、脳の機能を担う主役であるAMPA受容体を、ヒトの生体脳で観察することができず、病態の本質がブラックボックスであったことが挙げられます。本研究はこの問題を解決するための取り組みです。
成果
本研究グループは、ヒトの生体脳内でAMPA受容体を可視化する陽電子断層撮像(Positron Emission Tomography:PET)用のトレーサー(化合物:[11C]K-2)を世界で初めて開発しました。そして、この物質を動物に用いた前臨床研究と、健常者とてんかん患者に協力いただいた臨床研究により、[11C]K-2が生体内でAMPA受容体を特異的に認識していることを証明しました。更に、てんかん患者の病巣(焦点)においてAMPA受容体が多く集積することが観察されました(図2)。
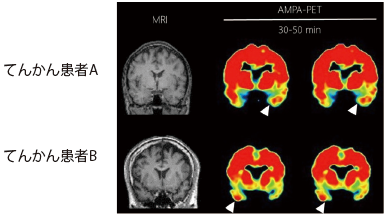
具体的には、前臨床研究において、1)AMPA受容体発現細胞を用いた実験により、[11C]K-2が高い親和性でAMPA受容体に結合すること、2)in vitroの実験により、中枢神経系に発現しているAMPA受容体以外の受容体に結合しないこと、3)ラット脳においてAMPA受容体の発現を生物工学的手法により低下させると、[11C]K-2画像値の低下が観察されること等を見出しました。
さらに、臨床研究により、1)[11C]K-2画像は受容体への結合が平衡に達した状態を反映したものであること、2)てんかん手術症例患者において、[11C]K-2画像値が、実際に存在するAMPA受容体量を反映したものであることを証明しました。
これらの結果により、[11C]K-2がヒト生体脳において、AMPA受容体を可視化・定量化できるPETプローブであることが明らかになりました。これは、シナプス最重要分子であるAMPA受容体をヒト生体脳で可視化・定量化できる世界初の技術です*1。
- *1
- Miyazaki et al. Nature Medicine 2020.
展望
AMPA受容体をヒトの生体脳で可視化できたことにより、精神・神経疾患の生物学的な基盤を分析し、その発症原因を説明することが可能になり、科学的根拠に基づいた革新的な診断・治療法の開発が格段に進むことが期待されます。開発したPET用のトレーサー[11C]K-2については、現在、てんかんの病巣(焦点)の診断薬として薬事承認を目指し、横浜市立大学附属病院を主機関として、多施設共同で医師主導治験を実施しています。また、本研究グループが昨年発表した脳卒中後のリハビリテーションの効果を促進する化合物(edonerpic maleate)*2の治験にも、[11C]K-2が機能回復のバイオマーカーとして応用されています*3。
- *2
- Abe et al. Science 2018.
- *3
- 参照URL:https://www.yokohama-cu.ac.jp/amedrc/news/20180406Takahashi.html
関連リンク
最終更新日 令和3年8月13日


