プレスリリース ヒトiPS細胞から別個に分化させた複数の腎前駆細胞から腎組織を再生する
プレスリリース
京都大学iPS細胞研究所(CiRA)
日本医療研究開発機構(AMED)
ポイント
- ヒトiPS細胞から血管や軟骨、そして腎臓の元になる複数種の中胚葉注1)を作り分けることに成功した。
- 培養皿上で後腎ネフロン前駆細胞(NP)と尿管芽(UB)を共培養させ、ネフロン注2)を構成する組織と集合管注3)を連結させたヒトの腎組織を作製することに初めて成功し、生体内において血管と繋がることを確認した。
要旨
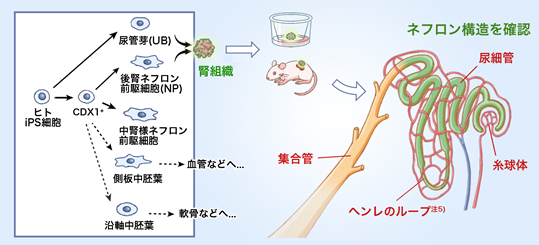
腎臓の主な働きは、血液をろ過し尿を作ることですが、その機能を担うのは腎臓の中のネフロンと呼ばれる組織です。ネフロンは、糸球体という毛細血管の塊から血液をろ過する構造とそこに繋がる尿細管で構成され、集合管と連結します(図1)。これまでの研究で、腎臓は主に2種類の腎前駆細胞注4)である後腎ネフロン前駆細胞(NP)と尿管芽(UB)の相互作用により形成されることが分かっていましたが、ヒトiPS細胞から別個に分化誘導されたそれぞれの腎前駆細胞から腎組織を作製することは難しく、分化培養システムを構築する必要がありました。
今回、辻󠄀本 啓 大学院生(CiRA増殖分化機構研究部門)、笠原 朋子元大学院生(元CiRA同部門)、末田 伸一元大学院生(元CiRA同部門)、および長船 健二教授(CiRA同部門)らの研究グループは、ヒトiPS細胞から後腎ネフロン前駆細胞(NP)と尿管芽(UB)それぞれに分化する培養システムを構築することに成功しました。その後、培養皿上で糸球体、尿細管などのネフロンの特徴を持った組織と集合管を連結させたヒトの腎組織を作製することに初めて成功しました。更に、生体内において移植した腎組織が血管と繋がることを確認しました。ヒトiPS細胞から選択的に分化させた複数の腎前駆細胞から腎組織を作製することに成功した本成果は、ヒト腎臓の発生生物学の新たな知見と腎臓疾患の仕組みの解明に繋がり、今後、腎臓の再生医療に向けた研究に大きく貢献できることが期待されます。
研究の背景
慢性腎臓病(chronic kidney disease; CKD)注6)の治療法の開発に向け、これまでiPS細胞から作製される腎前駆細胞を用いた再生医療の研究が盛んに行われています。近年、マウスのES細胞やヒトiPS細胞から後腎ネフロン前駆細胞(NP)または尿管芽(UB)を作製した報告がされましたが(Taguchi et al., 2014; Takasato et al., 2015; Morizane et al., 2015; Taguchi and Nishinakamura, 2017; Mae et al., 2018)、同一の分化システムの中でヒトiPS細胞から後腎注7)ネフロン前駆細胞(NP)、中腎注7)ネフロン前駆細胞、尿管芽(UB)を別個に作り分けた報告はなく、また、腎臓構造へと導くNPとUBの相互作用についても深く解明されていませんでした。
そこで本研究グループは、ヒトiPS細胞から複数の腎前駆細胞を別個に分化させる培養システムを構築することを試み、作製した腎前駆細胞を生体外で培養し、マウスに移植して調べました。
研究結果
- 1)ヒトiPS細胞からCDX1+細胞注8)を誘導し、血管や軟骨、そして腎臓の元になる複数種の中胚葉へと分化させる培養システムを構築した。一方で、これまでに開発した方法で、ヒトiPS細胞から尿管芽(UB)へ分化させた。
- これまでの研究で、CDX1を発現する胚盤葉上層注9)にある細胞が中胚葉の細胞を導くことが分かっており、CHIR99021、RA、BMP、FGFの4因子がCDX1の発現に重要ということも分かっていました。本研究では先ず、ヒトiPS細胞に4因子を加えてCDX1+細胞を誘導しました。次に、CDX1+細胞へステージごとに更に別個の因子を加えていき、後腎ネフロン前駆細胞(NP)、中腎様ネフロン前駆細胞、側板中胚葉注10)、沿軸中胚葉注11)を作り分けることに成功しました。
一方で、以前に構築した培養システム(CiRAニュース:2017年11月29日「ヒトiPS/ES細胞から効率良く尿管芽組織を作製することに成功」)で、ヒトiPS細胞から尿管芽(UB)に分化させました。興味深いことに、ヒトiPS細胞からCDX1+細胞を経由して誘導した場合、UBは全く分化誘導されず、UBを作製するには、ヒトiPS細胞からCDX1+細胞を経由せずに直接誘導させる必要があることが分かりました。このことは、UBが胚盤葉上層においてネフロン前駆細胞とは異なった部位の細胞から発生する可能性があることを示唆します。 - 2)後腎ネフロン前駆細胞(NP)と尿管芽(UB)を培養皿上で共培養させ、腎組織を作製した。
- 続いて、培養皿上において腎組織を作るため、1)で構築した培養システムを用いてヒトiPS細胞から作製したNPとUBを共培養させました。これまでの研究で、NPとUBは相互作用し、自己組織化することが分かっていたため、NPとUBの細胞をバラバラにした後に混ざり合うように培養させました(図2)。
20日後、培養した組織にネフロンの部位や集合管を特定するマーカーの発現を調べると、糸球体、尿細管、集合管が存在していることが確かめられました(図3)。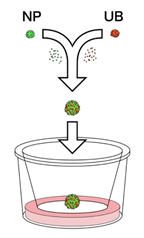
図2:培養皿上での共培養を示した概要図 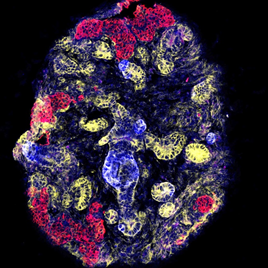
図3:培養皿上で作製した腎組織 赤色が糸球体、黄色が尿細管、青色が集合管を示す。尿細管の一部は集合管と連結していることが分かる。 - 3)マウスの生体内に腎組織を移植し、血管と結びつくことを確認した。
- 最後に、作製したヒト腎組織をヒト細胞に対して拒絶反応を示しにくい免疫不全マウスの腎臓被膜下のスペースに移植し、マウスの血管との結びつきを調べました(図4)。移植後20日経過したマウスの血管に赤色蛍光色素を流し、腎臓を調べると、移植した腎組織へ血管が結びつく様子が確認できました(図5(a))。なお、腎組織は培養皿上のときと同様に糸球体、尿細管、集合管などを含んでいることが分かり、尿細管と集合管は連結していることも確認できました。
更に、結びついた血管が実際に機能しているか調べるため、多光子励起顕微鏡注12)を用い、移植後10日経過した生きた状態のマウスの腎臓を観察すると、赤色蛍光色素で造影した血流が移植した腎組織に入り、糸球体を通っていることが動画で確認できました(図5(b))。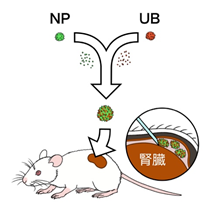
図4:マウス実験の概要図 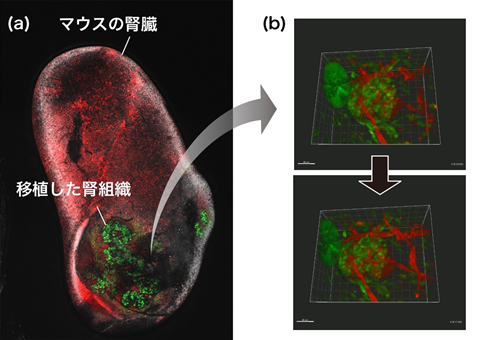
図5:マウスの腎臓に移植したヒト腎組織 (a)マウスの腎臓の全体像と移植したヒト腎組織(緑色)。
(b)多光子励起顕微鏡で捉えた移植したヒト腎組織(緑色)とマウスの血管(赤色)の様子。マウスの血液が腎組織の糸球体へ流れ込んでいる様子が分かる。
本研究の意義と今後の課題
ヒトiPS細胞から血管や軟骨、そして腎臓の元になる複数種の中胚葉を作り分けた本研究の培養システムの構築は、ヒト腎臓の発生生物学の新たな知見や腎臓疾患の仕組みの解明に繋がることが期待できます。また、今回初めて、ヒトiPS細胞からネフロンと集合管が連結されたヒトの腎組織を作製することに成功し、更に生体内で血管と繋がることが確認できました。作製した腎組織は小さく、構造も未熟なため、透析療法が必要になる患者の体内に移植して尿を作るなどの機能はまだありません。しかし、異なる腎前駆細胞から形成されるため、これまで困難であった糸球体と尿細管と集合管が繋がったヒト腎組織がヒトiPS細胞から作製できたことは、腎臓再生の大きな一歩と考えています。更に、本成果は腎臓の再生医療に必要となる細胞の供給法として、今後大きく期待できます。
論文名と著者
- 論文名
- “A modular differentiation system maps multiple human kidney lineages from pluripotent stem cells.”
- ジャーナル名
- Cell Reports
- 著者
- Hiraku Tsujimoto1*, Tomoko Kasahara1*, Shin-ichi Sueta1*, Toshikazu Araoka1, Satoko Sakamoto1, Chihiro Okada1, 2, Shin-ichi Mae1, Taiki Nakajima1, Natsumi Okamoto1, Daisuke Taura3, Makoto Nasu1, Tatsuya Shimizu1, Makoto Ryosaka1, Zhongwei Li4, Masakatsu Sone3, Makoto Ikeya1, Akira Watanabe1, Kenji Osafune1,**
- 著者の所属機関
-
- 京都大学iPS細胞研究所(CiRA)
- 三菱スペース・ソフトウェア株式会社
- 京都大学大学院医学研究科・医学部
- ケック医学校(Keck School of Medicine of USC)
本研究への支援
本研究は、下記機関より支援を受けて実施されました。
- 国立研究開発法人日本医療研究開発機構(AMED)再生医療実現拠点ネットワークプログラム
- 技術開発個別課題、iPS細胞研究中核拠点、疾患特異的iPS細胞の利活用促進・難病研究加速プログラム
- 国立研究開発法人日本医療研究開発機構(AMED)難治性疾患実用化研究事業
- 日本学術振興会(JSPS)科研費[18K15121][15K06921][17KT0108][18H02826]
用語説明
- 注1)中胚葉
- 受精後の胚からできる細胞の塊は先ず、内胚葉、中胚葉、外胚葉に分けられる。その後、内胚葉は、消化器官や呼吸器官を形成する。中胚葉は、さらに側板中胚葉注10)、中間中胚葉注13)、沿軸中胚葉注11)などに分かれる。外胚葉は、神経や感覚器官を形成する。
- 注2)ネフロン
- 腎臓の基本的な単位。ヒトの場合、左右の腎臓を合わせて約200万個のネフロンから成ると言われている。血液をろ過する糸球体と、尿の成分調節を行う尿細管を合わせた構造の名称。糸球体で生成された尿は、尿細管を通り集合管へと排泄される。
- 注3)集合管
- ネフロンは腎臓の中で、集合管と呼ばれる構造と連結している。集合管では尿細管から流れてきた尿から水分の再吸収が行われ、その後、尿が尿管から膀胱へと排泄される。ネフロンは後腎ネフロン前駆細胞(NP)から分化し、集合管、尿管および、膀胱の一部は尿管芽(UB)から分化する。
- 注4)腎前駆細胞
- ヒトやマウスでは発生期の腎臓にのみ存在する。糸球体と尿細管に分化して腎臓の機能の最小単位であるネフロンをつくる後腎ネフロン前駆細胞(NP)と、集合管や尿管、膀胱の一部へ分化する尿管芽(UB)が主に知られている。
- 注5)ヘンレのループ
- 尿細管がヘアピンのような構造をとることで、対向流輸送と呼ばれる効率の良い尿の濃縮機能を可能とする構造をもつ。今回の研究では、このヘアピン構造の作製までは至っていないが、ヘンレのループのもととなる尿細管の作製に成功した。
- 注6)慢性腎臓病(chronic kidney disease; CKD)
- 原因はさまざまであるが、腎臓の機能の低下が持続している状態のことを慢性腎臓病(Chronic Kidney Disease:CKD)と呼ぶ。日本に1330万人のCKD患者がいるとされ、成人の8人に1人はCKD患者であると推定される。治癒することはほとんどなく、多くの場合は原因疾患の持続や加齢により徐々に進行する。進行すると、透析療法や腎移植術が必要になる。進行を遅らせる治療の開発が急務である。
- 注7)中腎、後腎
- ヒトの胎生期にのみ見られる腎臓組織。中腎は一時的に腎臓のように尿を作るが、生後は生殖器官の一部を作る。生後の腎臓としての機能は、胎生後期に発達する後腎が担う。
- 注8)CDX1+細胞
- 多くの生物に存在するホメオボックスタンパクであるCDX1を発現する胚盤葉上層注9)にある細胞が中胚葉の細胞を導くことが分かっている。今回、CDX1を発現する胚盤葉上層の細胞の性質を持つ細胞(CDX1+細胞)をiPS細胞から分化誘導することで、さらに中胚葉に分化誘導することに成功した。
- 注9)胚盤葉上層(エピブラスト)
- 受精卵が分裂して胚盤胞の段階になると、胚内部に内細胞塊を形成する。この内細胞塊の中で、胎児の体を形作る胚盤葉上層(エピブラスト)と呼ばれる細胞層が作られ、細胞層から、内胚葉、中胚葉、外胚葉が発生する。
- 注10)側板中胚葉
- 側板中胚葉は、中間中胚葉の外側に生じ、血管、血球、心筋などを形成する。
- 注11)沿軸中胚葉
- 体節中胚葉とも呼ばれる。体幹部では椎骨や肋骨、骨格筋、軟骨などをつくる。
- 注12)多光子励起顕微鏡
- 蛍光分子にレーザー光を照射したときに、複数の光子が同時に吸収される光子の吸収過程を利用した顕微鏡。生きたマウスの組織の深部まで見ることができる。
- 注13)中間中胚葉
- 中間中胚葉は側板中胚葉と沿軸中胚葉の間に生じる。腎臓、生殖腺などを含む泌尿生殖系の器官を形成する。
お問い合わせ先
京都大学iPS細胞研究所(CiRA) 研究支援部門
国際広報室 大内田 美沙紀
TEL:075-366-7005 FAX:075-366-7034
E-mail:cira-pr”AT”cira.kyoto-u.ac.jp
国立研究開発法人日本医療研究開発機構(AMED)
再生・細胞医療・遺伝子治療事業部 再生医療研究開発課
〒100-0004 東京都千代田区大手町一丁目7番1号
TEL:03-6870-2220 FAX:03-6870-2242
E-mail:saiseinw”AT”amed.go.jp
※E-mailは上記アドレス“AT”の部分を@に変えてください。
掲載日 令和2年4月8日
最終更新日 令和2年4月8日


