プレスリリース 多発性硬化症(MS)の進行・増悪に関連する腸内細菌叢・腸内環境の変化を解明―全メタゲノム解析の結果から診断・治療の手がかりも提示―
プレスリリース
国立研究開発法人国立精神・神経医療研究センター(NCNP)
国立研究開発法人理化学研究所(RIKEN)
国立研究開発法人日本医療研究開発機構(AMED)
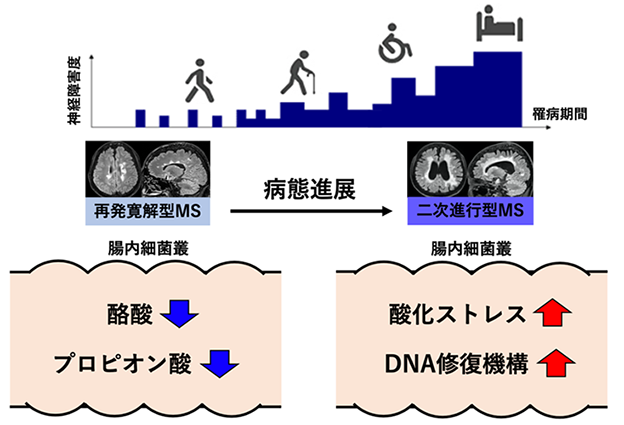
このたび国立精神・神経医療研究センター神経研究所の山村隆特任研究部長、理化学研究所の須田亙副チームリーダー、早稲田大学の服部正平教授らを中心とする共同研究グループは、神経難病である多発性硬化症1)(multiple sclerosis;MS)の各病型(再発寛解型、二次進行型など)について腸内細菌叢2)の比較を行い、治療に対する反応性が良好である再発寛解型MSに比較して、難治性である二次進行型MSでは、腸内細菌叢および腸内環境が有意に変化していることを明らかにしました。これまでに、二次進行型MSの腸内細菌を対象にした研究はなく、今回の研究結果は、難治性MSの新たな治療法開発や診断技術の向上につながる画期的な成果と考えられます。
研究グループは、腸内細菌叢のDNA配列を網羅的に取得し、腸内細菌叢全体の構造や機能を明らかにするメタゲノム解析手法3)を用いて、NCNP病院に通院中の再発寛解型MSと二次進行型MS患者の腸内細菌叢・腸内環境を比較しました。再発寛解型の腸内細菌では酪酸やプロピオン酸の産生能力の低下が顕著な特徴であるのに対し、二次進行型ではDNA修復(ミスマッチ修復機構)の亢進や過剰な酸化ストレス4)が特徴的でした。これらの結果は機能データベース(KEGG)5)を用いた解析により得られましたが、糞便代謝物解析によっても確認されました。酸化ストレスは神経系の慢性炎症病態を悪化させることが報告されており(*1)、二次進行型MSで確認された酸化ストレス亢進は、病態の進行・増悪を促進する重要な要因である可能性が推測されます。その他にも、MSの重症度と関連する細菌などに関する数多くの新たな知見が得られました。
この研究成果は、日本時間2020年8月25日午前4時(米国東部夏時間2020年8月24日午後3時)に、米国科学アカデミー紀要(Proceedings of the National Academy of Sciences of the United States of America;PNAS)オンライン版に掲載されます。
研究の背景
脳神経内科の代表的な難病である多発性硬化症(MS)は、中枢神経系の自己抗原(ペプチド抗原)に対する免疫反応による炎症が脳、脊髄、視神経の様々な部位に生じる自己免疫疾患です。代表的な病型である再発寛解型MSでは、炎症の生じた部位に対応した再発症状(視力低下、手足のしびれ、脱力など)が突然襲ってきますが、炎症を抑制するステロイド治療によって回復し、数ヶ月~数年に及ぶ寛解期に入ります。本邦のMS患者数は、1980年以降の40年間で20倍以上に増加しています(現在では推定2万人以上)。その理由としては、何らかの環境の変化や生活習慣の変化などが考えられますが、詳細は明らかになっていません。
MSは通常、再発寛解型MSとして発症しますが、一部は神経障害が改善することなく悪化し続けていく二次進行型MSへと移行します。二次進行型では、歩けなくなる、作業効率が低下する、記憶力が低下する、などの深刻な問題がゆっくりと進行しますが、その原因は謎に包まれています。MSは21世紀に入り治療法が急速に進歩した病気の一つですが、二次進行型MSの治療についてのエビデンスは乏しく、職を失い車椅子の生活を余儀なくされている患者さんが多いのが実情です。
なおMS関連疾患・病態としては、この他にも視神経や脊髄に病変が集まる非典型MSや、抗アクアポリン4抗体が陽性となる視神経脊髄炎と呼ばれる病型が存在します。
これまでに山村らの研究グループは、MSの動物モデルを用いた検討において、抗菌薬の投与によって腸内細菌を変化させると、中枢神経の炎症が軽症化することを2008年に報告しており(*2)、この研究が発端となって世界中で腸内細菌と脳内炎症の関連を解明しようとする研究が始まりました。さらに2015年には再発寛解型MS患者20例で、腸内細菌叢の異常を世界に先駆けて報告しました(*3)。その後、再発寛解型MSにおける腸内細菌叢の異常は世界中で確認されましたが、再発寛解型以外の病型についての解析は残されていました。
再発寛解型MSを対象とする従来の研究では、16SリボソームRNA(16SrRNA)遺伝子解析が用いられてきました。今回我々は、全メタゲノム解析による腸内細菌叢全体の代謝機能の比較を行うことにより、MSにおける腸内環境異常を詳細に解析し、さらに二次進行型MSの腸内細菌叢の特徴を明らかにすることを目指しました。
研究の内容
国立精神・神経医療研究センター病院に通院中の再発寛解型MS患者62名、二次進行型MS患者15名、非典型MS患者21名、視神経脊髄炎患者20名の糞便から細菌叢DNAを調整したのち、次世代シークエンサーを用いたメタゲノム解析手法により解析を行いました。なおサブ解析により、処方された治療薬が腸内細菌に有意な影響を与える可能性は否定されました。得られたデータと先行研究(16SリボソームRNA解析)で得られていた健常日本人55名の腸内細菌叢のデータを合わせて、腸内細菌叢に含まれる菌種や機能遺伝子の比較を行いました。その結果、日本人MS患者の腸内細菌叢について以下のことがわかりました。
1)菌組成解析
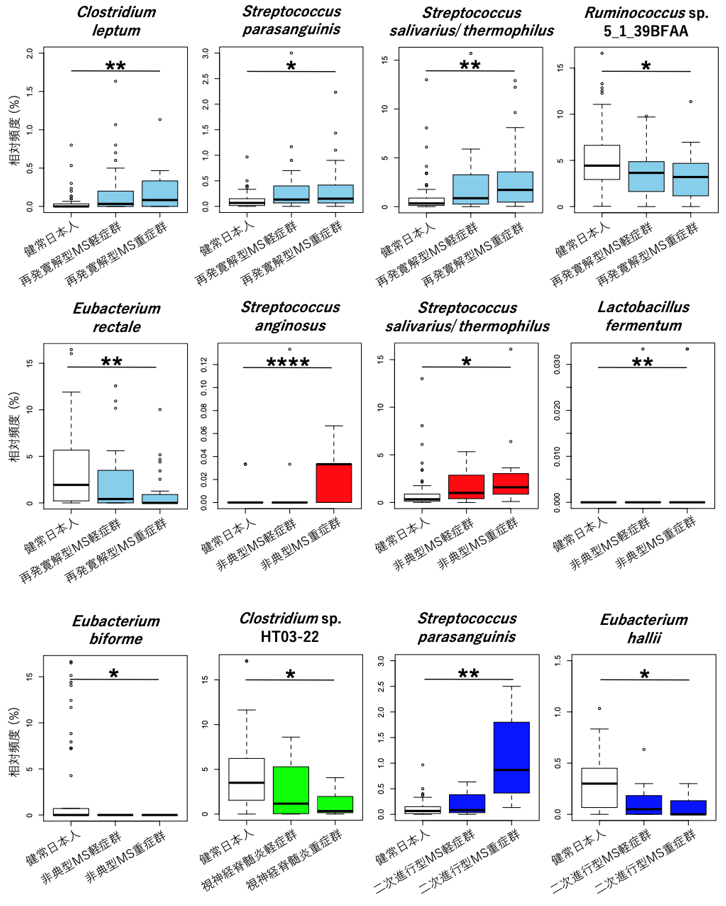
健常人と比較し、個々のMS病型において増加している菌種や減少している菌種が明らかになりました。さらにそれぞれの病型に属する患者を、病勢や神経障害度などの臨床情報をもとに軽症群と重症群とに分け、軽症群と比較した時に重症群との関連が深い菌種をそれぞれの病型ごとに明らかにしました。具体的には再発寛解型MS患者群における5菌種、非典型MS患者群における4菌種、視神経脊髄炎患者群における1菌種、二次進行型MS患者群における2菌種の相対頻度が、健常日本人群と各病型の重症群との比較において有意な差を認めましたが、健常日本人群と各病型の軽症群との比較では有意な差を認めませんでした(図1)。
2)腸内細菌叢の機能解析
細菌DNA配列を網羅的に取得し、その情報から腸内細菌叢全体の構造や機能を明らかにするメタゲノム解析手法を用い、細菌叢全体が持つ遺伝子の情報を調べました。得られた配列データから発見した遺伝子の機能やその遺伝子を含む代謝経路を機能データベース(KEGG)を用いて調べました。本研究では特に、MSの発症や病態の悪化に関わる腸内細菌の機能を明らかにすることを目的に“健常日本人群と再発寛解型MS患者群との比較”と“再発寛解型MS患者群と二次進行型MS患者群との比較”に注目して解析を進めました。
2-1)健常日本人群と再発寛解型MS患者群との比較
本研究においては腸内細菌の機能に関する遺伝子が計6,163個検出されました。その中で健常日本人群との比較において再発寛解型MS患者群で増加していた遺伝子が97個、減少していた遺伝子が117個みつかりました。次に統計学的な手法を駆使し、これらの遺伝子を含む代謝経路を2群間での増加・減少の程度が強い順に並べました。この順位付けにもとづく上位5つの代謝経路の中で、TCAサイクル、原核生物における炭素固定代謝経路、炭素代謝は、エネルギー代謝や炭水化物代謝に関連しており、プロピオン酸代謝と酪酸代謝は、短鎖脂肪酸の合成に関連していました。健常日本人群と比較して、腸内細菌が持つこれらの代謝機能が再発寛解型MS患者群で低下していることがわかりました(図2)。
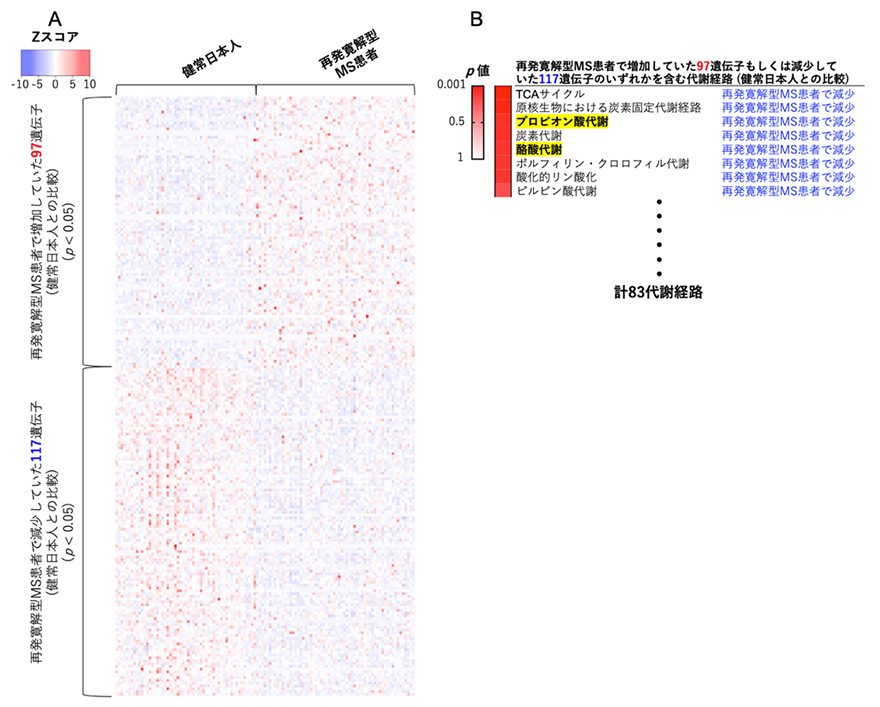
(A)健常日本人群と比較して再発寛解型MS患者群で増加していた遺伝子が97個、減少していた遺伝子が117個みつかった。健常日本人群と再発寛解型MS患者群の各被験者におけるこれらの遺伝子の頻度を2色の濃淡(増加;赤・減少;青)で表示した。(B)健常日本人群と比較して再発寛解型MS患者群で増加・減少の程度が大きかった順に代謝経路を順位付けした。
2-2)再発寛解型MS患者群と二次進行型MS患者群との比較
また再発寛解型MS患者群と二次進行型MS患者群との比較において、二次進行型MS患者群で増加していた遺伝子が38個、減少していた遺伝子が14個みつかりました。次にこれらの遺伝子を含む代謝経路を上記と同様の方法で2群間での増加・減少の程度が強い順に並べたところ、腸内細菌が持つミスマッチ修復機構と呼ばれるDNA損傷に関わる機能が二次進行型MS患者群で亢進していることが明らかになりました(図3)。
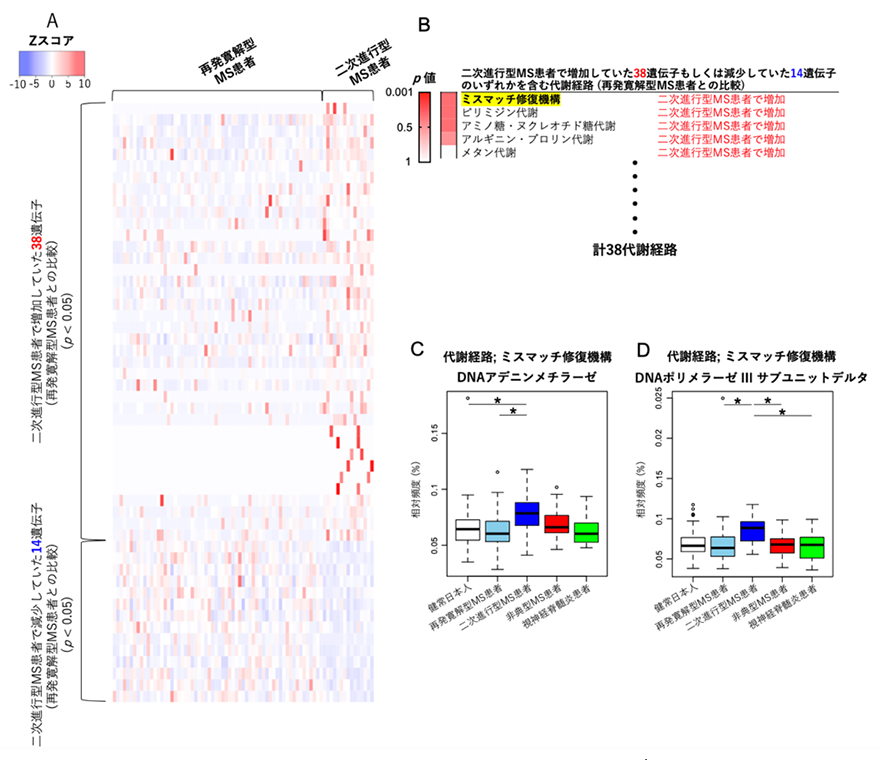
(A)再発寛解型MS患者群と比較して二次進行型MS患者群で増加していた遺伝子が38個、減少していた遺伝子が14個みつかった。再発寛解型MS患者群と二次進行型MS患者群の各被験者におけるこれらの遺伝子の頻度を2色の濃淡(増加;赤・減少;青)で表示した。(B)再発寛解型MS患者群と比較して二次進行型MS患者群で増加・減少の程度が大きかった順に代謝経路を順位付けした。(C、D)代謝経路;ミスマッチ修復機構に含まれる遺伝子のうち、2つの遺伝子(DNAアデニンメチラーゼ、DNAポリメラーゼIIIサブユニットデルタ)の相対頻度が再発寛解型MS患者群と比較して二次進行型MS患者群で増加していた。*p<0.05(ウィルコクソン順位和検定)
3)糞便代謝物解析
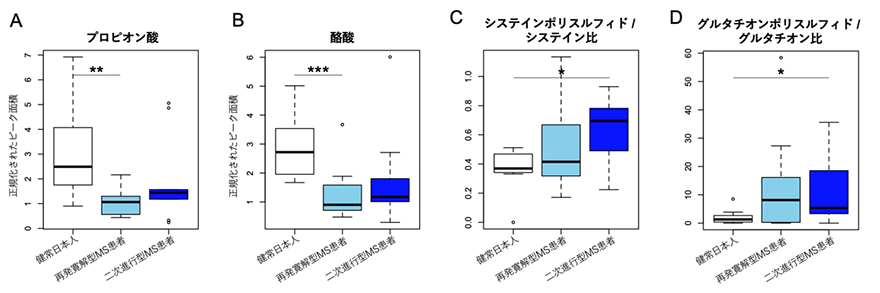
最後にメタゲノム機能解析で得られた上記の結果を裏付けるために、健常日本人8名、再発寛解型MS患者12名、二次進行型MS患者9名の糞便検体を用いて代謝物解析を行いました。健常日本人群との比較において再発寛解型MS患者群の糞便中では、予想通りプロピオン酸や酪酸などの短鎖脂肪酸の濃度が顕著に低下していました(図4A、B)。また、糞便中の酸化ストレスの程度を定量化する目的で硫黄化合物メタボローム解析6)を行いました。硫黄化合物におけるポリスルフィド化の程度は周囲の環境における酸化ストレスの程度を反映します(*4)。二次進行型MS患者群の糞便中ではシステインやグルタチオンなどの硫黄化合物におけるポリスルフィド化の程度が増加しており(図4C、D)、上記の結果は二次進行型MS患者群の腸管内における酸化ストレスの上昇を示唆する結果でした。
得られた結果の考察
腸内細菌が産生する酪酸やプロピオン酸には炎症を抑える制御性T細胞を誘導したり、脳や脊髄における髄鞘の再生を促したりする働きがあります。再発寛解型MS患者群における腸内細菌の異常とそれに伴う酪酸やプロピオン酸などの短鎖脂肪酸の減少は、少なくとも部分的には再発寛解型MSの病態悪化に関わっている可能性が考えられました。
また、二次進行型MS患者群でみられた糞便中の酸化ストレスの亢進は、細菌DNAの損修を引き起こし、ミスマッチ修復機構を亢進させている可能性があります。これらの結果は腸管に由来する酸化ストレスと神経慢性炎症病態との関連を示唆するものでした。
研究の意義・今後期待される展開
我々は治療への反応が良い再発寛解型MSと難治性である二次進行型MSそれぞれにおける腸内細菌叢の特徴を明らかにしました(図5)。二次進行型の病態において腸内細菌がその一端を担っている可能性を示したことは、腸内環境を標的とした新たな治療法の開発につながる画期的な成果と考えられます。
健常日本人の腸内細菌叢には、短鎖脂肪酸の産生に富み、DNA損傷が生じにくいという特徴を有しています(*5)。欧米に比較して日本ではMS患者の数が少ないことに対応している可能性が示唆されます。本研究結果はMSの克服を目指した様々な取り組みの中で、日本から発信される腸内細菌研究の重要性を改めて強調するものとなりました。“難病”として知られてきたMSを腸内細菌の制御によって根治に導く時代の到来が期待されます。
研究グループ、研究支援について
本研究は、以下の共同研究グループによって行われました。
- 国立精神・神経医療研究センター神経研究所免疫研究部(竹脇大貴、佐藤和貴郎、山村隆)
- 理化学研究所生命医科学研究センターマイクロバイオーム研究チーム(高安伶奈、Naveen Kumar、須田亙)
- 早稲田大学理工学術院先進理工学研究科(服部正平)
- 順天堂大学免疫学教室(三宅幸子)
本成果は、以下の事業・研究領域・研究課題によって得られました。
- AMED難治性疾患実用化研究事業「難治性多発性硬化症に関連する腸内細菌の同定と機能的意義の解明」
- AMED革新的先端研究開発支援事業(AMED-CREST)「微生物叢と宿主の相互作用・共生の理解とそれに基づく疾患発症のメカニズム解明」研究開発領域における研究開発課題「腸内細菌叢を介した神経炎症・変性・神経発達障害の修飾機序に関する研究」
用語解説
- 1)多発性硬化症(MS)
- 中枢神経(脳や脊髄)に炎症が生じ、運動・感覚・視力などの様々な身体機能が障害される自己免疫疾患です。若年で発症し、再発と寛解を繰り返しながら生涯にわたり徐々に障害が蓄積していきます。患者の多くは症状の悪化と改善を繰り返す再発寛解型MSとして発症しますが、そのうちの一部は神経障害が改善することなく悪化し続けていく二次進行型MSへと移行します。この他にもMSに典型的な脳病変を欠き、視神経や脊髄に病変が集まる傾向がある非典型MSと呼ばれる病型も存在します。また、視神経脊髄炎はMSの一部と以前は考えられておりましたが、多くの患者で血液中の抗アクアポリン4抗体が陽性となることが判明してからは、MSとは異なる病気として捉えられるようになりました。
- 2)腸内細菌叢
- ヒトの消化管には種類にして約1,000菌種、菌数にしてヒトの細胞数に匹敵する数十兆個にのぼる腸内細菌の集団(細菌叢)が生息しています。近年、様々な疾患と腸内細菌との関連が報告されており、宿主との密接な相互作用から“新たな臓器”として注目を集めています。
- 3)メタゲノム解析手法
- 細菌叢から抽出した細菌群のゲノムDNA総体に対し、全ゲノムショットガン法を用いることで網羅的に配列データを取得し、その情報から細菌叢の全体構造や細菌叢全体の遺伝子機能を明らかにする手法です。メタゲノム解析には2つの方法があります。細菌のゲノム・遺伝子配列を網羅的に収集・解析する方法(狭義のメタゲノム解析)と、細菌の16SリボソームRNA遺伝子のみをPCR増幅した後、配列を取得して解析する方法(16Sアンプリコン解析)です。前者からは細菌情報と遺伝子(=機能)情報の両方が得られ、後者は細菌情報に特化した解析法です。両方法とも大量の塩基配列データを情報学と統計学を駆使して解析します。
- 4)酸化ストレス
- 呼吸によって取りこまれた酸素の一部は活性酸素に変わります。活性酸素はDNAやタンパク質を傷つけてしまうため、老化や生活習慣病などの様々な病気との関連が指摘されています。一方で生物が活性酸素を抑えるためのしくみは抗酸化力と呼ばれています。酸化ストレスとは、活性酸素と抗酸化力とのバランスとして定義されています。
- 5)機能データベース(KEGG)
- KEGG(Kyoto Encyclopedia of Genes and Genomes)はこれまで明らかとなった各遺伝子の機能を階層的に分類したデータベースです。本研究では、同定された遺伝子の機能やその遺伝子を含む代謝経路の探索に使用しました。
- 6)硫黄化合物メタボローム解析
- 硫黄化合物には周囲の環境が酸化状態にあるほどポリスルフィド化がおこりやすいという性質があります。そのため硫黄化合物のポリスルフィド化の程度を調べることで周囲の環境の酸化還元度合いを推定することができます。本研究では糞便中の硫黄化合物を網羅的に調べ、各硫黄化合物のポリスルフィド化の程度を定量化することで糞便中の酸化度を測定しました。
参考文献
(*1)A. S. Mendiola et al., Transcriptional profiling and therapeutic targeting of oxidative stress in neuroinflammation. Nature Immunology 10.1038/s41590-020-0654-0 (2020).
(*2)H. Yokote et al., NKT cell-dependent amelioration of a mouse model of multiple sclerosis by altering gut flora. Am J Pathol 173, 1714-1723 (2008).
(*3)S. Miyake et al., Dysbiosis in the Gut Microbiota of Patients with Multiple Sclerosis, with a Striking Depletion of Species Belonging to Clostridia XIVa and IV Clusters. PLoS One 10, e0137429 (2015).
(*4)K. Yamada et al., Characterization of sulfur-compound metabolism underlying wax-ester fermentation in Euglena gracilis. Scientific reports 9, 853 (2019).
(*5)S. Nishijima et al., The gut microbiome of healthy Japanese and its microbial and functional uniqueness. DNA research 23, 125-133 (2016).
論文情報
- 論文名:
- “Alterations of the gut ecological and functional microenvironment in different stages of multiple sclerosis”
- 著者:
- Daiki Takewaki, Wataru Suda, Wakiro Sato, Lena Takayasu, Naveen Kumar, Kimitoshi Kimura, Naoko Kaga, Toshiki Mizuno, Sachiko Miyake, Masahira Hattori, and Takashi Yamamura
- 掲載誌:
- Proceedings of the National Academy of Sciences of the United States of America
- DOI:
- 10.1073/pnas.2011703117
お問い合わせ先
研究に関するお問い合わせ先
国立研究開発法人国立精神・神経医療研究センター 神経研究所
免疫研究部特任研究部長 山村隆(やまむらたかし)
〒187-8553 東京都小平市小川東町4-1-1
Tel:042-341-2711(代表) Fax:042-346-1753
E-mail:yamamura“AT”ncnp.go.jp
報道に関するお問い合わせ先
国立研究開発法人国立精神・神経医療研究センター 総務課広報係
〒187-8551 東京都小平市小川東町4-1-1
Tel:042-341-2711(代表) Fax:042-344-6745
E-mail:ncnp-kouhou“AT”ncnp.go.jp
国立研究開発法人理化学研究所 広報室 報道担当
E-mail:ex-press“AT”riken.jp
AMED事業に関するお問い合わせ先
難治性疾患実用化研究事業
国立研究開発法人日本医療研究開発機構 疾患基礎研究事業部 疾患基礎研究課
〒100-0004 東京都千代田区大手町1-7-1 読売新聞ビル
Tel:03-6870-2223
E-mail:nambyo-r“AT”amed.go.jp
革新的先端研究開発支援事業
国立研究開発法人日本医療研究開発機構 シーズ開発・研究基盤事業部 革新的先端研究開発課
Tel:03-6870-2224
E-mail:kenkyuk-ask“AT”amed.go.jp
※E-mailは上記アドレス“AT”の部分を@に変えてください。
関連リンク
掲載日 令和2年8月25日
最終更新日 令和2年8月25日


