2019年度 研究事業成果集 ビルトラルセンによるデュシェンヌ型筋ジストロフィー治療の実用化
 国内初のエクソン・スキップ治療薬の薬事承認取得
国内初のエクソン・スキップ治療薬の薬事承認取得
難病であるデュシェンヌ型筋ジストロフィーは、筋肉内のタンパク質が作れなくなることで歩行等の運動機能が低下する希少疾患です。国立精神・神経医療研究センター(NCNP)の武田伸一神経研究所名誉所長らの研究グループは、日本新薬株式会社と共同で筋肉内のタンパク質の回復が期待される画期的なエクソン・スキップ治療薬を国内で初めて開発し、2020年3月に薬事承認を取得しました。近年、新たなモダリティとして注目される核酸医薬品が実用化された事例の一つです。
取り組み
デュシェンヌ型筋ジストロフィー(DMD)は男児に発症する最も頻度の高い遺伝性筋疾患で、ジストロフィンと呼ばれる筋肉の骨組みを作るタンパク質の遺伝子変異により、正常なジストロフィンが作られなくなる難病です。そのため筋力低下を来たし、多くは10歳前後に歩行能を喪失します。現在、その進行を遅らせることが可能な治療薬は、ステロイド剤以外ありません。
ビルトラルセン(本剤)は、NCNPと日本新薬(株)の共同研究で創製された国内初のエクソン・スキップ作用(図1)を有する核酸医薬品です。ジストロフィン遺伝子にはエクソンが79ありますが、DMD患者では、エクソン51をスキップできれば約20%、エクソン53をスキップできれば約10%の患者について治療できる可能性があることがわかってきました。武田名誉所長らは、ジストロフィン遺伝子のエクソン53スキップに応答する遺伝子変異を有するDMD患者に対する治療薬として本剤を開発しました。また、DMDのように患者数が少ない希少疾患の治験においては、多くの場合、被験者の集積に長期間を要しますが、NCNPによる本剤の第Ⅰ相医師主導治験においては、NCNPが構築した神経・筋疾患のナショナルレジストリー(Remudy)*を用いて、効率的に被験者を集積でき、当該治験において本剤の一定の有効性及び安全性を確認できました。
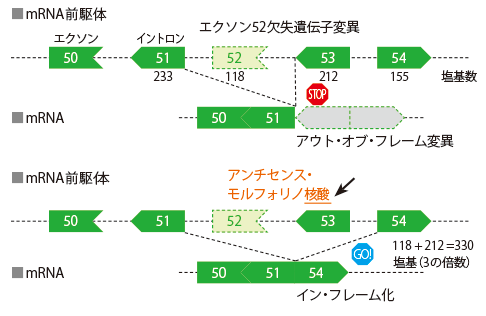
当該治験成績等を踏まえて、共同開発者の日本新薬(株)による企業治験(第Ⅰ/Ⅱ相試験)の実施、薬事承認申請に繋げることができました。
- *Remudy(Registry of Muscular Dystrophy)
- 臨床試験/治験を目的に、患者と製薬関連企業・研究者との橋渡しをする登録システム
成果
NCNPによる本剤の第Ⅰ相医師主導治験(安全性及び有効性の解析対象は10例)において、有効性については、筋生検によるエクソン53スキッピング効率やジストロフィンタンパク発現等について検討され、一定の有効性が確認されました(図2)。
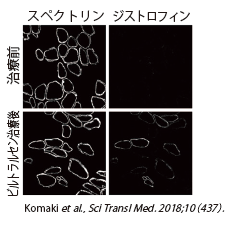
安全性については、重篤な有害事象は認められませんでした。当該治験成績等により、日本新薬(株)による企業治験(第Ⅰ/Ⅱ相試験)の実施に繋げることができました。
なお、これらの医師主導及び企業治験の成績等から、本剤は2015年10月27日に先駆け審査指定制度の指定医薬品に指定され、2019年8月22日には希少疾病用医薬品にも指定され、2019年9月26日に薬事承認申請が行われました。さらにその後、2019年10月29日に条件付き早期承認制度の適用対象にも指定され、2020年3月25日に薬事承認されました。本剤の薬事承認取得としては世界最速であり、米国の薬事承認取得(現地時間2020年8月12日)より3ヶ月以上早い薬事承認取得という素晴らしい成果をあげ、「患者に1分1秒でも早く医療研究開発の成果を届ける」というAMEDのミッション達成に貢献することができました。
展望
DMDの進行性の筋力低下に対して、臨床使用可能かつ有効性のエビデンスが評価されている既承認薬はステロイド剤のみです。
ステロイド剤の副作用に対しては個別の対応が必要であり、椎体骨折など重篤な副作用もあります。場合によってはステロイド剤の減量・中止も考慮する必要があります。
本剤では、薬事承認取得後に国際共同第Ⅲ相試験(検証的試験)、及びナショナルレジストリー(Remudy)を用いた製造販売後調査が実施されており、これらによって本剤の安全性や運動機能等 に対する有効性が確認されれば、DMD患者にとって大きな希望が持てる治療薬になることが期待されます。
最終更新日 令和3年8月13日


