プレスリリース 3段ロケット方式のエピゲノム指令でがんが悪性化する―第6の遺伝暗号解除で前立腺がんホルモン療法は効かなくなる―
プレスリリース
国立研究開発法人日本医療研究開発機構
発表者
高山 賢一(東京大学医学部附属病院 老年病科 助教)
発表のポイント
- 前立腺がんは男性ホルモンによって大きくなり、ホルモン療法で小さくなります。前立腺がんがホルモン療法の効かない難治がんに至る新しい仕組みをエピゲノムの観点から世界で初めて解明しました。
- 今回解明した仕組みは3段ロケット方式で、1段目でホルモンによって増える特定「マイクロRNA」が働き、2段目で「第6の遺伝暗号」を作る酵素の量が減り、3段目で「第6の遺伝暗号」が減ってがんを進行させ悪性化するスイッチが入ることがわかりました。
- この仕組みよって起きる「第6の遺伝暗号」の減少に至る一連の変化は、がんの予後予測の指標として有用であり、ホルモン療法が効かなくなった難治がんの新たな治療戦略の確立に役立つものと期待されます。
発表概要
発表内容
背景、先行研究
前立腺がんは、欧米では男性の最も頻度の高いがんです。日本では発症者、死亡者ともに急激な増加傾向にあり、2020年には肺がんについで2番目に多いがんとなることが推測されています。前立腺がんはアンドロゲンという男性ホルモンと、アンドロゲンを受け取るアンドロゲン受容体の作用が鍵となります。前立腺がんに対する治療薬としては、アンドロゲン受容体の作用を抑制する薬剤(抗アンドロゲン剤など)がホルモン療法として選択されています。しかし、この薬剤を用いたホルモン療法は、初期には治療効果がみられるものの、治療の過程で多くの患者さんにおいて治療の効果がみられなくなり(がんの再燃)、再燃に至ったがんは薬剤に対して抵抗性を持つ、つまり薬が効かなくなること(耐性化)が治療上の問題となっています。このため、なぜ薬が効かなくなるのか?という仕組みの解明が待ち望まれていました。
以上のような前立腺がんのホルモン療法耐性化に至る仕組みについては、これまでの研究によりアンドロゲン受容体の組織内での発現が増加すること、受容体の感受性やその後のシグナルが亢進すること、アンドロゲンの組織内での産生による作用などが重要であるといわれてきました。しかしながら、アンドロゲンやアンドロゲン受容体を標的とした薬剤が新たに開発されても、再びの薬が効きにくくなってしまうことから新たな治療戦略が求められています。
アンドロゲン受容体は細胞内でヒトゲノム(注4)の特定の位置に結合し、遺伝子の発現を調節することが知られています。またアンドロゲン受容体のゲノム中の結合には、他の転写因子(注5)であるFOXA1(注6)の結合が必要です。FOXA1はアンドロゲン受容体のゲノム中への結合を促し、アンドロゲンの働きにおいて大変重要な役割を果たしており、実際に前立腺がん患者の予後を決定する重要性が報告されています。
また、DNAやDNAを支えるタンパク質であるヒストンへのエピゲノム修飾は、がん化やiPS細胞の生成など細胞の運命を劇的に変化させる重要な機能を持つことが、近年の研究において明らかになってきました。しかしながら、ホルモン療法の耐性化に伴いどのようなエピゲノム変化が重要で、その変化がどのような遺伝子群を制御するか、それを引き起こす原因についてはよく分かっていませんでした。
研究内容
東京大学医学部附属病院22世紀医療センター抗加齢医学講座 井上聡特任教授と同病院老年病科 高山賢一助教を中心とした研究チームは、同病院泌尿器科、理化学研究所、東北大学とともに共同研究を行い、がんが進行し悪性化する仕組みとして、ホルモン療法耐性化に伴い変化する新たなエピゲノム修飾を介した仕組みを明らかにしました。
本研究グループは、まずアンドロゲン受容体が強く発現している前立腺がんモデル細胞を用いてホルモン療法耐性化のモデルがん細胞を作製しました。まずホルモン療法が効く細胞と効かない細胞間での遺伝子発現、アンドロゲン受容体の結合部位の変化について次世代シーケンサー(注7)を用いて解析しました。その結果、ホルモン療法耐性化に伴いアンドロゲンによって活性化されるマイクロRNA群で変化が起きており、それらは共通してエピゲノムの一つであるヒドロキシメチル(5hmC)化と呼ばれるDNA修飾を担うTET2遺伝子(注8)を標的として、そのタンパク質の生成を抑制していることが分かりました。特にマイクロRNA-29と呼ばれる分子群はアンドロゲンの作用を媒介して、TET2遺伝子をアンドロゲン依存的に強く抑制することが分かりました(図1)。
この発見を応用したところ、ホルモン療法耐性モデルの腫瘍移植による動物モデル実験において、マイクロRNA-29を抑制する薬剤をマウスに使用すると、ホルモン療法が効かなくなったがんに対して治療効果があることが明らかになりました(図2)。実際の手術検体を用いた前立腺がん組織における解析により、マイクロRNAの発現の高い患者さんは再発しやすく、このマーカーの測定はがん進行と悪性化の将来予測に役立つことが期待されました(図3)。同時に、TET2タンパクの発現、ならびに第6の遺伝暗号であるヒドロキシメチル化の減少も、患者さんにとってより強力な治療を必要とするかどうかの診断マーカーになることを発見しました(図3)。
次に、TET2が担うヒドロキシメチル化の前立腺がん細胞内での機能を解析するため、ゲノム全体の中でメチル化並びにヒドロキシメチル化修飾を受けている領域の網羅的なシーケンス(DNA配列解読)を行いました。その結果、1)ヒドロキシメチル化はホルモン療法耐性化により細胞のゲノム全体に広く抑制を受けていたこと、2)興味深いことにヒドロキシメチル化を受けるゲノム領域には有意にFOXA1の結合配列(注9)が集積しており、FOXA1に対して阻害する方向に働いていたこと、3)ヒドロキシメチル化の抑制により活性化される遺伝子群を網羅的に解析したところ、これまでアンドロゲン受容体の活性化、前立腺がんの進行に関与されると個々に報告されてきた遺伝子群が見事に集積していたこと、を発見しました(図1、図2)。
社会的意義、今後の予定
発表雑誌
- 雑誌名:
- 「Nature Communications」
- 論文タイトル:
- TET2 repression by androgen hormone regulates global hydroxymethylation status and prostate cancer progression.
- 著者:
- Ken-ichi Takayama, Aya Misawa, Takashi Suzuki, Kiyoshi Takagi, Yoshihide, Hayashizaki, Tetsuya Fujimura, Yukio Homma, Satoru Takahashi, Tomohiko Urano, Satoshi Inoue*
お問い合わせ先
研究に関するお問い合わせ
東京大学医学部附属病院 22世紀医療センター 抗加齢医学講座
特任教授 井上 聡
TEL:03-5800-8834(講座直通) FAX:03-5800-6530
E-mail:INOUE-GER“at”h.u-tokyo.ac.jp
取材に関するお問い合わせ
東京大学医学部附属病院 パブリック・リレーションセンター
(担当:渡部、小岩井)
TEL:03-5800-9188(直通)
E-mail:pr“at”adm.h.u-tokyo.ac.jp
次世代がん研究シーズ戦略的育成プログラムに関するお問い合わせ
国立研究開発法人日本医療研究開発機構(AMED) 戦略推進部がん研究課
〒100-0004 東京都千代田区大手町1-7-1
TEL:03-6870-2221 E-mail:cancer“at”amed.go.jp
※E-mailは上記アドレス“at”の部分を@に変えてください。
用語解説
- (注1)エピゲノム:
- ゲノムDNA(デオキシリボ核酸)は4つの文字(塩基)からなる遺伝暗号であり、音楽における主旋律にあたる。ゲノムの遺伝暗号は全部が常に読み込まれているわけではなく、読み込みが活発な部分と不活性な部分に分けられている。このゲノムの読み込みを調節する働きは「エピゲノム」と呼ばれ、遺伝暗号にマイナーな変化(修飾)をもたらして、ゲノムが奏でる主旋律にアレンジを加えることができる。代表的なエピゲノム修飾としては、ゲノムを支えるヒストンというタンパク質に化学的修飾を加えるヒストン修飾とDNAの塩基そのものを修飾する2種類があり、前者ではアセチル化、メチル化など、後者ではメチル化、近年新しく発見されたヒドロキシメチル化などがあげられる。ゲノムの遺伝暗号は先天的に決定されているのに対して、エピゲノムの情報は、後天的な環境要因などによって変化している。
- (注2)マイクロRNA:
- 20~30個程度の塩基から作られる短いRNAであり、ゲノムDNAから読み込まれたRNAの特定の場所に結合して、様々な遺伝子の量を増やしたり減らしたりする発現の調節を行っている。
- (注3)5hmC:
- ゲノムDNAは、アデニン(A)、シトシン(C)、グアニン(G)、チミン(T)の4つの塩基が遺伝暗号として連なることで特定の情報を含むようになり、あるタンパク質を生成するための情報を含んだ領域を遺伝子と呼んでいる。この4つの遺伝暗号に加えて、シトシンに含まれる5番目の炭素原子にメチル基の修飾がなされた5-メチルシトシン(5mC)が存在しており、5mCを含む塩基配列は「第5の遺伝暗号」として、遺伝子を使うかどうかを決める働きをもつことが知られてきた。注目した5-ヒドロキシメチルシトシン(5hmC)とは、脱メチル水酸化酵素TETタンパク質により、5mCにさらに水酸基を追加したヒドロキシメチル基が付加してできるシトシンであり、5mCに続く「第6の遺伝暗号」と呼ばれている。
- (注4)ヒトゲノム:
- ヒト(Homo sapiens)のゲノム、すなわち、遺伝情報の1セットである。遺伝情報は主に細胞核内に存在する核ゲノム配列に記録されている。ゲノム配列は上記(注1)、(注3)でいえば主旋律に当たる4つの遺伝子暗号、すなわち4種類(ACGT)のデオキシリボ核酸(DNA)と呼ばれる塩基が約31億個連なって形成され、その組み合わせにより決定されている。ヒトゲノム計画により2003年にその全配列が解読完了された。
- (注5)転写因子:
- 遺伝子が機能を発揮するためには、DNA情報を読み取り伝達するRNAを生成することが必要である。転写因子はヒトゲノムの遺伝子領域に結合してそのRNAの生成を促す、いわゆる遺伝子のスイッチの働きをする分子のことである。アンドロゲンのシグナル経路では、アンドロゲンがアンドロゲン受容体に結合すると、受容体そのものが転写因子として働き、その下流にある標的遺伝子のスイッチが入るようになる。
- (注6)FOXA1:
- Forkhead box protein A1が正式名称となる転写因子の一つである。アンドロゲン、エストロゲンなどの性ホルモンが作用する際に結合することで、その受容体のゲノムへの結合を促し、性ホルモン作用を導くパイオニアファクター(先導因子―水先案内人)と呼ばれている。
- (注7)次世代シーケンサー:
- 近年開発された極めて大量のDNA配列を高速に解析することができ、上記(注4)のヒトゲノムをはじめとする核酸配列を低価格かつ短時間で読むことに応用できる機器。
- (注8)TET2遺伝子:
- Ten-eleven translocationが正式名称のタンパク質であり、5mCから5hmCをつくる酵素である。TETファミリーにはTET1、TET2、TET3の3種類が知られている。
- (注9)結合配列:
- 転写因子がゲノムDNAに結合する塩基配列は転写因子ごとに特徴的な配列を持つことが分かっている。それぞれの転写因子がゲノムに結合すると予想される配列、または結合が確認された配列をさす。
添付資料:
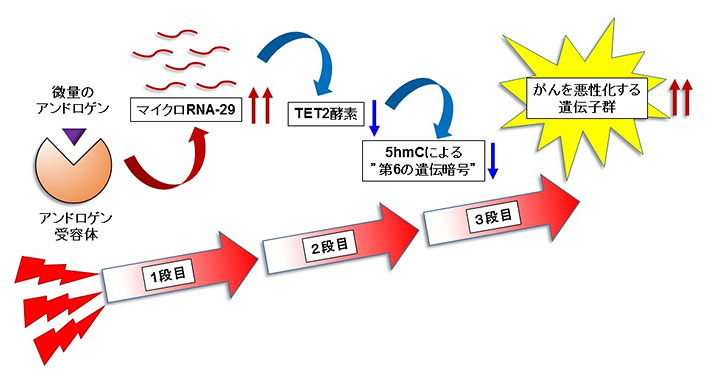
図1. 新たに発見された3段ロケット方式のエピゲノム指令により、
ホルモン療法が効かない耐性がんに至る仕組み
(ロケット1段目)ホルモン療法が効かない前立腺がんでは、アンドロゲン受容体の働きが強まっており、微量のアンドロゲンによって、マイクロRNA-29の量が増える。
(2段目)マイクロRNA-29のターゲットであり5hmCをつくるTET2酵素は、マイクロRNA-29が増えると量が減る。
(3段目)TET2酵素が減ると、5hmC遺伝暗号(ゲノムDNAのヒドロキシメチル化)は解除され、アンドロゲン受容体やそれと一緒に働くFOXA1などの転写因子の働きが強まり、がんの悪性化にかかわるがん関連遺伝子の量が増える。
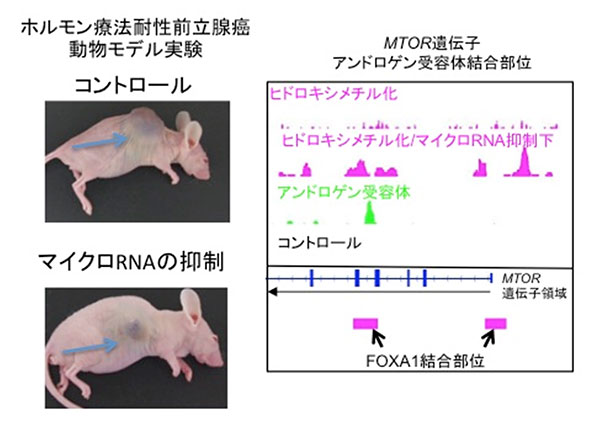
図2. マイクロRNA-29の働きを抑えると、
ホルモン療法が効かない耐性化したがんの増殖が抑えられる。
(左)ヌードマウスにホルモン療法が効かない耐性化したがん細胞を移植すると、上のマウスのように大きい腫瘍が作られるが、マイクロRNA-29の働きを抑える核酸の薬を注射した下のマウスでは、腫瘍は大きくならなくなり有力な治療効果が得られた。
(右)マイクロRNA-29は、「第6の塩基」と呼ばれる「5hmC」が多いエピゲノムの遺伝暗号(ヒドロキシメチル化)を抑さえ、がんを増悪させる遺伝子の発現を増やす。がんの転移に関与するMTOR遺伝子周辺を含むゲノムDNAのマップを一例として示す(MTORは「哺乳類ラパマイシン標的タンパク質」)。マイクロRNA-29を抑さえると、「5hmC」の遺伝暗号であるゲノムDNAのヒドロキシメチル化は増えてくる。MTOR遺伝子の「5hmC」の遺伝暗号にはアンドロゲン受容体やFOXA1転写因子がゲノムDNAに結合して作用する箇所(結合部位)が含まれるため、マイクロRNA-29が働いて「5hmC」の遺伝暗号が解除される時には、アンドロゲン受容体やFOXA1の働きが強まり、がんを増悪させる遺伝子が多数増えてくる。
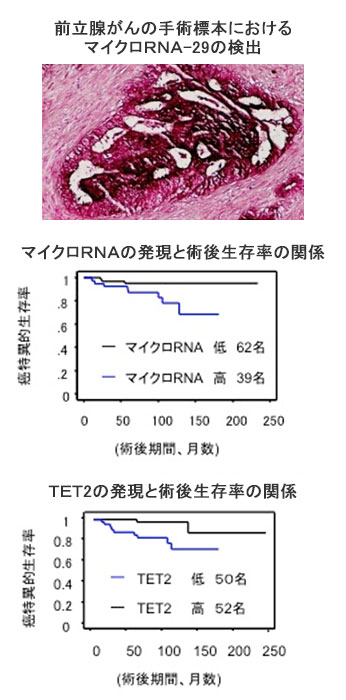
図3. マイクロRNA-29が過剰な前立腺がんの患者では生命予後が不良になる。
(上)前立腺がんの手術標本におけるマイクロRNA-29の検出。in situハイブリダイゼーションと呼ばれるマイクロRNA-29に相補的な核酸配列の有無を局所に調べる手法により、マイクロRNA-29は紫色に染色されている。
(中)マイクロRNA-29が過剰な前立腺がんの患者では生命予後が不良になる。マイクロRNA-29が過剰な症例では、マイクロRNA-29が少ない症例に比べて、統計学的有意に手術後の生存率が低下していた。
(下)TET2タンパク質が少ない前立腺がんの患者では、生命予後が悪化する。TET2タンパク質に対する抗体を用いた免疫組織染色法と呼ばれる手法により、TET2蛋白質の量を調べたところ、TET2が少ない症例では多い症例に比べて、生存率が有意に低下していた。
掲載日 平成27年9月28日
最終更新日 平成27年9月28日


