インフルエンザウイルスゲノムの核内動態に関わる宿主タンパク質を同定
プレスリリース
国立研究開発法人日本医療研究開発機構
国立研究開発法人科学技術振興機構
発表者
発表のポイント
- 従来、生理的な機能が十分に知られていない宿主のタンパク質CLUHを解析し、CLUHがウイルスゲノムの核内輸送に寄与することを明らかにしました。
- 本現象は、ウイルス感染時に特異的に生じるCLUHの核への局在と、それに伴うウイルスゲノムの核内輸送の制御機構が存在することを示唆するものです。
- 本研究により、ウイルス感染時に特異的なウイルスゲノムの核内輸送制御機構をターゲットとした新たな治療薬開発が期待されます。
発表概要
東京大学医科学研究所感染・免疫部門ウイルス感染分野の河岡義裕教授らの研究グループは、細胞の核内で複製されたインフルエンザウイルスゲノムが複製された場所から輸送(核内輸送)されるのに関わる宿主のタンパク質としてCLUH(clustered mitochondria protein homolog)を同定しました。
河岡義裕教授が2014年に発表した網羅的な解析から同定されたウイルス増殖に寄与する宿主因子を詳細に解析した結果、CLUHがウイルスゲノムの核内輸送に関わることを突き止め、核内におけるインフルエンザウイルスゲノムの核内動態の一端を初めて明らかにしました。
これまで、ウイルスゲノムの複製とウイルスゲノムの核外輸送複合体(注1)の形成は、核内のクロマチン領域で起きると報告されてきました。ところが、ウイルスの増殖に必要な「複製」と「複合体形成」が細胞核内の同じ場所で起きているかどうかは不明でした。本研究において、クロマチン領域で新規に複製されたウイルスゲノムは、核内を移動した後に、核外輸送複合体が形成される領域へ到達することが明らかとなりました。
通常は細胞質のみに存在するとされるCLUHはウイルス感染により核内へと移動し、複製されたウイルスゲノムを運ぶ役割に関わることがわかりました。
本研究成果は、ウイルス感染細胞の核内でのみ見られる現象を明らかにしたものであり、特異的なインフルエンザ治療薬開発のターゲットになることが期待されます。本研究成果は、2016年5月16日(米国東部時間11時00分)、英国科学雑誌「Nature Microbiology」のオンライン速報版で公開されます。本研究成果は、科学技術振興機構(JST)戦略的創造研究推進事業、日本医療研究開発機構(AMED)革新的先端研究開発支援事業、文部科学省感染症研究国際ネットワーク推進プログラム(平成27年度~感染症研究国際展開戦略プログラム)などの一環として得られました。
発表内容
研究の背景
インフルエンザウイルスは、細胞に感染すると、宿主のタンパク質を利用して複製・増殖することが知られています。インフルエンザウイルスのゲノムRNA(vRNA)は、感染した細胞の核内でウイルスタンパク質であるPB2、PB1、PAおよびNPと複合体vRNP(注2)を形成します。核内で新たに作られたvRNPは、ウイルスタンパク質M1およびNS2とともに核外輸送複合体を形成し、宿主の核外輸送を担うタンパク質CRM1依存的に核外に輸送されることが報告されています。しかし、新たに作られたvRNPが核外に輸送されるまでに、核内でどのような動きをするのかについての知見はありませんでした。
本研究では、河岡教授らが2014年に行った網羅的解析により同定された、インフルエンザウイルスの増殖に関与する宿主タンパク質の中で、vRNPの構成因子の1つであるPB2と相互作用するものを選びました。さらに生理的な機能がほとんど明らかになっていない、宿主タンパク質CLUHに注目し、インフルエンザウイルス感染時の役割を解析しました。
研究内容
インフルエンザウイルスは、細胞に感染すると、宿主のタンパク質を利用して複製・増殖することが知られています。インフルエンザウイルスのゲノムRNA(vRNA)は、感染した細胞の核内でウイルスタンパク質であるPB2、PB1、PAおよびNPと複合体vRNP(注2)を形成します。核内で新たに作られたvRNPは、ウイルスタンパク質M1およびNS2とともに核外輸送複合体を形成し、宿主の核外輸送を担うタンパク質CRM1依存的に核外に輸送されることが報告されています。しかし、新たに作られたvRNPが核外に輸送されるまでに、核内でどのような動きをするのかについての知見はありませんでした。
本研究では、河岡教授らが2014年に行った網羅的解析により同定された、インフルエンザウイルスの増殖に関与する宿主タンパク質の中で、vRNPの構成因子の1つであるPB2と相互作用するものを選びました。さらに生理的な機能がほとんど明らかになっていない、宿主タンパク質CLUHに注目し、インフルエンザウイルス感染時の役割を解析しました。
社会的意義・今後の予定 など
発表雑誌
論文タイトル:The host protein CLUH participates in the subnuclear transport of influenza virus ribonucleoprotein complexes
著者:河岡義裕*
DOI番号:10.1038/nmicrobiol.2016.62
お問い合わせ先
研究に関するお問い合わせ
河岡 義裕(カワオカ ヨシヒロ)
東京大学医科学研究所 感染・免疫部門ウイルス感染分野 教授
Tel:03-5449-5310(なるべくメールでお問い合わせください)
E-mail:kawaoka“AT”ims.u-tokyo.ac.jp
報道に関するお問い合わせ
東京大学医科学研究所 総務チーム
Tel:03-5449-5601
国立研究開発法人日本医療研究開発機構(AMED)
経営企画部 企画・広報グループ
Tel:03-6870-2245
国立研究開発法人科学技術振興機構(JST)広報課
〒102-8666 東京都千代田区四番町5-3
Tel:03-5214-8404 Fax:03-5214-8432
E-mail:jstkoho“AT”jst.go.jp
AMEDの事業に関するお問い合わせ
国立研究開発法人日本医療研究開発機構(AMED)
戦略推進部 医薬品研究課
革新的先端研究開発支援事業(インキュベートタイプ)担当
〒100-0004 東京都千代田区大手町1-7-1
Tel:03-6870-2219 Fax:03-6870-2244
E-mail:iyaku-leap“AT”amed.go.jp
JSTの事業に関するお問い合わせ
国立研究開発法人 科学技術振興機構 戦略研究推進部
〒102-0076 東京都千代田区五番町7 K's五番町
Tel:03-6380-9130 Fax:03-3222-2066
E-mail:suishinf“AT”jst.go.jp
※E-mailは上記アドレス“AT”の部分を@に変えてください。
用語解説
- (注1)核外輸送複合体
- 核内で新規に合成されたインフルエンザウイルスのvRNPが、核外に輸送される際に形成する複合体。vRNPにウイルスタンパク質M1およびNS2が結合し、NS2に存在する核外輸送シグナルに核外輸送を担う宿主タンパク質CRM1が結合することで、形成される。
- (注2)vRNP
- インフルエンザウイルスのゲノムRNA(vRNA)と、vRNAの転写・複製に必要なウイルスタンパク質(PB2, PB1, PA)、核タンパク質(NP)からなる、タンパク質―RNA複合体。インフルエンザウイルス粒子には、8本のvRNPが存在する。
- (注3)核スペックル
- 核内でクロマチンの間に存在する構造体。mRNAの編集に関与する因子が多く含まれる。
- (注4)siRNA
- siRNA(small interfering RNA)とは21~23塩基対からなる低分子二本鎖RNAである。siRNAはRNA干渉(RNAi)と呼ばれる現象に関わっており、mRNAの破壊によって配列特異的に遺伝子の発現を抑制する。
添付資料
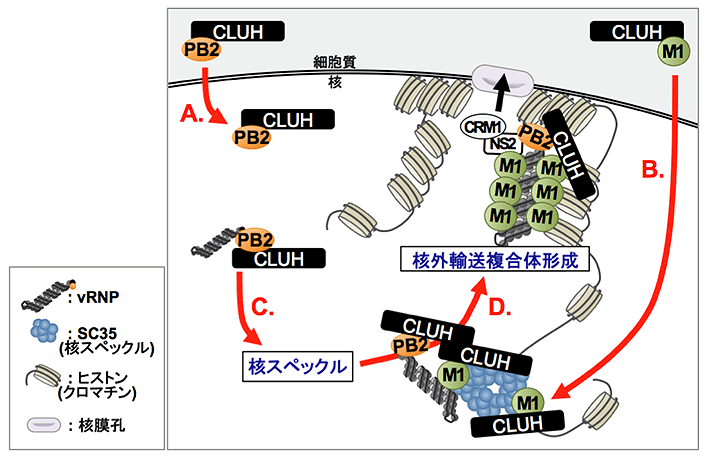
図 本研究で明らかになったCLUHによるウイルスゲノムの核内輸送の概念図
本研究成果から、核内で複製されたインフルエンザウイルスゲノム(vRNP)は、以下の4つのステップを経て核外輸送複合体を形成し、核外に輸送されることが明らかになりました。
- CLUHはウイルスタンパク質PB2と相互作用し、細胞質から核に移行します。
- CLUHはウイルスタンパク質M1とも相互作用し、細胞質から核スペックルに移行します。
- 核内で複製されたvRNPは、vRNPの構成因子であるPB2を介してCLUHと相互作用し、M1とCLUHが局在している核スペックルに移行します。
- 核スペックルに局在したvRNPはクロマチン結合領域に移行し、核外輸送複合体を形成して、核外に輸送されます。
関連リンク
掲載日 平成28年5月17日
最終更新日 平成28年5月17日


