プレスリリース 新たなてんかん治療戦略を提案―脳の過剰興奮を阻止するタンパク質ADAM22の量が鍵―
プレスリリース
自然科学研究機構生理学研究所
京都大学
日本医療研究開発機構
発症頻度の高い神経疾患である「てんかん注1)」は、いつ発作がおこるか予測困難であり、発作を何度も繰り返すことから、その原因究明と新しい治療薬の開発が強く望まれています。今回、自然科学研究機構生理学研究所の深田正紀教授、深田優子准教授、横井紀彦助教、平林真澄准教授、および京都大学の深井周也教授らは共同で、遺伝性のてんかんに関連する「ADAM22注2)」というタンパク質に注目。マウス脳においてADAM22の量を調節する仕組みを解明しました。さらに、てんかん発症を抑止するために必要なADAM22の量を明らかにしました。今回の発見はヒトのてんかん病態の解明と、てんかんの新しい治療戦略の開発に貢献できると考えられます。
概要
体の中には様々なタンパク質が存在しており、健康の維持に重要な役割を果たしています。実際に、多くの遺伝性疾患では、重要な働きを担うタンパク質の量や機能がある量を下回ることで、臨床症状が出現します。したがって、タンパク質の量と症状出現との関係を明らかにし、そのタンパク質の量の調節機構を解明することは、疾患治療において極めて重要となります。
これまでに研究グループは、てんかん発症に関連する、膜タンパク質ADAM22と分泌タンパク質LGI1注3)が神経シナプスにおいて複合体を形成していることや、ADAM22-LGI1複合体の量が減少すると、てんかんの原因となることを報告してきました(Fukata et al., Science 2006; Yokoi et al., Nat Med 2015; Fukata et al., PNAS 2021)。
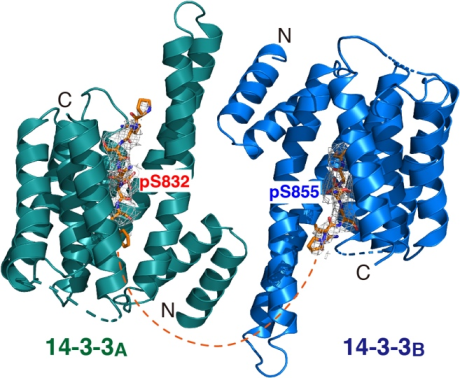
今回、まず研究グループは、ADAM22の量がどのように調節されているかを明らかにするため、ADAM22の合成経路と分解経路を詳細に調べました。その結果、ADAM22が安定化し、その後シナプスで正常に機能するためには、リン酸化酵素PKAによりリン酸化され、14-3-3注4)というタンパク質と強固に結合することが重要であることを見出しました(図1)。さらに両者の結合様式を原子レベルで明らかにすることに成功しました(図2)。一方、このリン酸化を受けない遺伝子改変マウス(Adam22S832A)を作製したところ、ADAM22は14-3-3と結合できずに分解されてしまい、脳内のADAM22の量が約40%程度にまで減少することを見出しました。
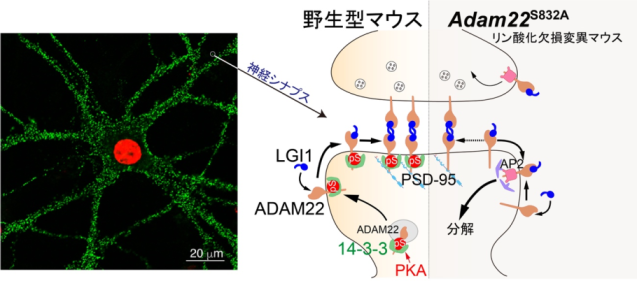
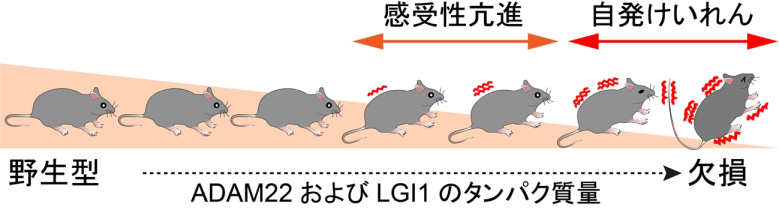
次に、どのくらいの量のADAM22があれば脳の過剰興奮が阻止され、てんかん発症を抑制できるかを明らかにするため、ADAM22とLGI1の量が異なる7種類のマウスにおいて、てんかんのおこりやすさを比較しました。その結果、ADAM22の量が健常マウスの約10%あればてんかん発症を抑えられることを明らかにしました(図3)。一方、LGI1の量は健常の30%まで低下すると致死性てんかんが発症し、自発性てんかんを抑止するには50%は必要であることを突き止めました。
さらに、脳内には様々な細胞の種類がありますが、てんかん発症を抑えるためには、ADAM22とLGI1は、興奮性神経細胞と抑制性神経細胞の両方で働く必要があることを明らかにしました。
このような「タンパク質の量と場所についての情報」は、病気の治療の開始や治療効果の判定に重要な指針を与えます。今後もさまざまな疾患で必要な研究手法であり、広く治療に活かされる事が望まれます。
本研究は文部科学省科学研究費補助金、日本医療研究開発機構(AMED)「領域横断的かつ萌芽的脳研究プロジェクト」、武田科学振興財団の支援を受けて行われました。
今回の発見
- てんかん抑制に重要なタンパク質であるADAM22は、脳内でPKAによりリン酸化を受け、14-3-3と結合することで安定化し、その後シナプスにおいて機能することを発見しました。
- てんかん発症を抑制するのに十分なADAM22とLGI1のタンパク質量を解明しました。
- 14-3-3安定化剤やPKA活性化剤は、ADAM22の発現量を増加させることにより、てんかん治療に貢献できる可能性を提案しました。
用語解説
- 注1)てんかん
- 人口の1%程度に発症する頻度の高い神経疾患であり、神経細胞や神経回路の異常な興奮により発症すると考えられている。
- 注2)ADAM22
- 膜1回貫通タンパク質で、LGI1の受容体として機能する。ヒトADAM22遺伝子の機能不全は、けいれん発作、知的障害、脳萎縮を引きおこす。
- 注3)LGI1
- 神経細胞から放出される分泌タンパク質で、その遺伝子変異による家族性側頭葉てんかんが知られている。また、LGI1に対する自己抗体は、記憶障害やけいれんを伴う辺縁系脳炎を引きおこす。
- 注4)14-3-3
- すべての真核生物の細胞で発現している保存されたタンパク質ファミリー。14-3-3タンパク質は、多様なタンパク質に結合し、その機能や安定性を制御する。
この研究の社会的意義
- 新しいてんかん治療戦略の提案
- 現在使用されている抗てんかん薬の多くは、直接イオンチャネルを標的としたものです。一方、ADAM22–LGI1はこれまでとは異なるてんかん治療標的になりうると考えられます。本研究で示したような「タンパク質の量と場所についての情報」は、病気の治療の開始や治療効果の判定に重要な指針を与えます。今後もさまざまな疾患で必要な研究手法です。
論文情報
- 論文タイトル
- 14-3-3 proteins stabilize LGI1–ADAM22 levels to regulate seizure thresholds in mice
- 著者情報
- Norihiko Yokoi, Yuko Fukata*, Kei Okatsu, Atsushi Yamagata, Yan Liu, Makoto Sanbo, Yuri Miyazaki, Teppei Goto, Manabu Abe, Hidetoshi Kassai, Kenji Sakimura, Dies Meijer, Masumi Hirabayashi, Shuya Fukai, Masaki Fukata* *責任著者
- 掲載誌
- Cell Reports(オンライン版は日本時間2021年12月15日午前1時に公開されました。)
お問い合わせ先
研究について
自然科学研究機構生理学研究所 分子細胞生理研究領域 生体膜研究部門
教授 深田正紀(フカタ マサキ)
TEL:0564-59-5873
E-mail:mfukata“AT”nips.ac.jp
自然科学研究機構生理学研究所 分子細胞生理研究領域 生体膜研究部門
准教授 深田優子(フカタ ユウコ)
TEL:0564-59-5873
E-mail:yfukata“AT”nips.ac.jp
広報に関すること
自然科学研究機構生理学研究所 研究力強化戦略室
TEL:0564-55-7722 FAX:0564-55-7721
E-mail:pub-adm“AT”nips.ac.jp
AMED事業に関すること
日本医療研究開発機構(AMED)
疾患基礎研究事業部 疾患基礎研究課
TEL:03-6870-2286 FAX:03-6870-2243
E-mail:brain-seeds“AT”amed.go.jp
※E-mailは上記アドレス“AT”の部分を@に変えてください。
掲載日 令和3年12月15日
最終更新日 令和3年12月15日


