成果情報 エイズウイルスの体内での拡がりに関わる宿主蛋白質を発見―新たな治療法の開発へ期待―
成果情報
公立大学法人横浜市立大学
国立研究開発法人日本医療研究開発機構
横浜市立大学学術院医学群 微生物学の梁 明秀 教授、宮川 敬 助教らの研究グループは、国立感染症研究所・シンガポール国立大学・北里大学・米国ミシガン大学などとの共同研究により、エイズの原因となるヒト免疫不全ウイルス(HIV)が体内で効率よく感染を拡げるための分子メカニズムを解明し、これに関わる宿主蛋白質を発見しました。
HIVが体内で多量に増殖するメカニズムとして、感染細胞から放出されたウイルス粒子が別の細胞に感染するいわゆる「cell-free感染」と、感染細胞と非感染細胞が直接接触することにより一度に大量のウイルスを受け渡す、いわゆる「cell-to-cell(細胞-細胞間)感染」という仕組みが知られています。このcell-to-cell感染は、細胞どうしが密に存在するリンパ節などの組織でみられ、一度に100~1000個のウイルスを伝播することが知られています。そのため、抗ウイルス薬を投与しても相対的な薬剤濃度が低下し薬の効果を弱める一因となっており、HIVの潜伏化や慢性感染の維持にも重要な役割を果たすと考えられています。したがってその分子メカニズムの解明は、エイズウイルスの体内での拡がりや潜伏化機構の解明につながるだけでなく、新たな治療法開発への応用に寄与するものと期待されます。
研究の背景
HIV感染を未然に防ぐワクチンはまだありませんが、抗ウイルス薬の服用によってウイルスの増殖を抑え、エイズの発症を遅らせることはできます。しかし、一度感染したウイルスを体内から完全に排除する治療法は確立されておらず、HIV感染者は抗ウイルス薬を日常的に飲み続ける必要があります。また、長期間の抗ウイルス薬の服用によって薬剤が効かなくなる事例も多数報告されています。そのため、HIVワクチンの開発と並行して、既存薬が効かない耐性ウイルスにも効果のある新しい薬剤を常に作り続ける必要があります。
研究の概要と成果
HIVの感染様式には、細胞外に分離・放出されたウイルス粒子によるcell-free感染とは別に、隣接し合う感染細胞から非感染細胞に直接ウイルスを受け渡すcell-to-cell感染があります。一般的にcell-to-cell感染はcell-free感染に比べ数十倍~数千倍も高い効率でウイルスを伝播することが可能とされています。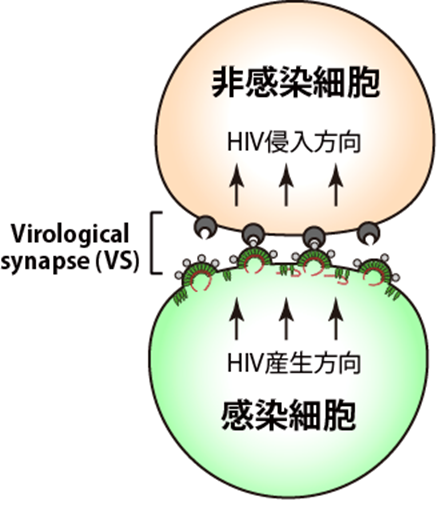 HIVによるcell-to-cell感染は、特にHIVの標的となるCD4陽性Tリンパ球*1)が高密度に存在する腸管関連リンパ組織などの2次リンパ組織において主要な感染様式であり、HIVの効率的な拡がりのみならず、潜伏化や長期感染維持においても重要な役割を果たすことが報告され、近年注目を集めています。cell-to-cell感染は、細胞生物学的には細胞と細胞の接合部に存在するVirological Synapse(VS)と呼ばれる特殊な構造体を介して起こります(図1)。VSはウイルスの受け渡し場所としての役割を果たしているため、HIVの効率的な伝播には、ウイルスの基本構成要素(構造蛋白質Gag*2)やウイルスゲノムvRNAなど)をVSまで輸送することが大変重要です。また、HIVが極性を有する感染細胞から放出される場合、一定の方向からのみ放出されることも知られています。しかしながら、これら一連のメカニズムや宿主蛋白質の役割については、これまでほとんど解明されていませんでした。
HIVによるcell-to-cell感染は、特にHIVの標的となるCD4陽性Tリンパ球*1)が高密度に存在する腸管関連リンパ組織などの2次リンパ組織において主要な感染様式であり、HIVの効率的な拡がりのみならず、潜伏化や長期感染維持においても重要な役割を果たすことが報告され、近年注目を集めています。cell-to-cell感染は、細胞生物学的には細胞と細胞の接合部に存在するVirological Synapse(VS)と呼ばれる特殊な構造体を介して起こります(図1)。VSはウイルスの受け渡し場所としての役割を果たしているため、HIVの効率的な伝播には、ウイルスの基本構成要素(構造蛋白質Gag*2)やウイルスゲノムvRNAなど)をVSまで輸送することが大変重要です。また、HIVが極性を有する感染細胞から放出される場合、一定の方向からのみ放出されることも知られています。しかしながら、これら一連のメカニズムや宿主蛋白質の役割については、これまでほとんど解明されていませんでした。
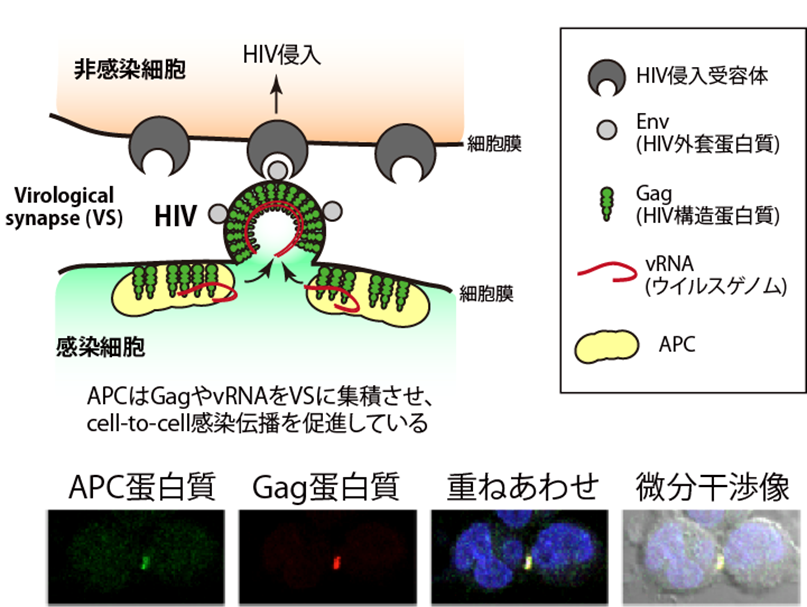
そこで本研究グループは、HIV粒子形成に関わる重要なステップの一つであるGag蛋白質とvRNAの細胞膜への輸送に着目しました。これまでの研究からGagとvRNAの輸送は一部共通の宿主蛋白質を介している可能性があると考えられました。したがって、それらを司る宿主因子が同定されれば新たな治療標的となりうると考え、TAP(Tandem Affinity Purification)*3)を用いたプロテオミクス解析により、Gagに結合する宿主因子の探索を試みた結果、がん抑制遺伝子産物であるAPC (adenomatous polyposis coli)を同定することに成功しました。APCは極性細胞の突端部に局在し、さまざまな蛋白質やRNAの局在や制御に関与することが明らかとなっています。そこで研究グループは、Gag、vRNAの輸送や制御にAPCがどのように関わるのかを検討しました。その結果、ウイルス感染細胞にAPCを過剰発現させると、HIV産生量が約6倍に上昇しました。特に、家族性大腸腺腫症*4)由来のAPC遺伝子変異細胞に野生型APCを過剰発現するとHIV産生量が約10倍以上亢進しました。さらに、蛍光標識したGagやvRNAを用いてHIVのcell-to-cell感染について観察したところ、APCはGagおよびvRNAとともにVSに集積することがわかりました。反対に、APCを発現抑制した細胞では、VSへのGagとvRNAの集積が減少し、それに伴ってHIVのcell-to-cell感染伝播効率の顕著な低下が認められました。
これらの結果から、APCはウイルス構成因子であるGagおよびvRNAをVSに集積、安定化させることで、HIVのcell-to-cell感染を制御している宿主蛋白質であることが示唆されました(図2)。
今後の展望
特記事項
用語解説
- *1)CD4陽性Tリンパ球
- 免疫機能の司令塔の役割を担う免疫細胞の一種。HIVはこの細胞に侵入して増殖を続けるため、HIV感染によってこの値は大幅に減少し、これに伴って免疫力も低下する。この値はエイズの診断や進行の度合いを測る上で重要な指標となっており、400個/mm3以下の場合はエイズ以外にも単純ヘルペスウイルス感染症、結核の再燃、カンジダ症、非ホジキンリンパ腫など、多くの病気が疑われる。
- *2)Gag
- HIVの骨格蛋白質。複数の構造的ドメインを含み、細胞膜への結合やウイルス粒子形成、ウイルスゲノムの粒子への取り込みなどの機能を担う。
- *3)TAP (Tandem Affinity Purification)
- 蛋白質に2種類のタグ(目印)を付け、タグを用いて2段階精製を行うことで、その蛋白質の結合パートナーを高純度に精製する手法。
- *4)家族性大腸腺腫症
- 大腸全体に多数のポリープ(腺腫)が形成され、放置により大腸癌を発症する遺伝性疾患。APC遺伝子の異常が主要な原因であるが、癌化にはさらに複数の遺伝子変異が関わるとされる。
論文情報
DOI:10.1038/ncomms14259
お問い合わせ先
内容に関するお問い合わせ
教授 梁 明秀
Tel:045-787-2602
E-mail:aryo“AT”yokohama-cu.ac.jp
事業に関するお問い合わせ
戦略推進部感染症研究課
Tel:03-6870-2225
E-mail:kansen”AT”amed.go.jp
※E-mailは上記アドレス“AT”の部分を@に変えてください。
掲載日 平成29年2月8日
最終更新日 平成29年2月8日


