神経膠腫(グリオーマ)のがん幹細胞に対する創薬標的分子PTPRZの同定と、 そのアロステリック阻害剤の研究開発について
成果情報
要旨
本研究の成果は、2017年7月17日にオンライン科学雑誌『Scientific Reports』に掲載されました。
背景
神経膠腫(グリオーマ)は、脳内にもともと存在するグリア細胞(あるいはグリア前駆細胞)に由来する固形癌で、脳腫瘍の約2割を占めています。もっとも悪性度の高いグリオーマは、膠芽腫(グリオブラストーマ)と呼ばれ、確定診断後の平均余命は約14ヶ月と言われています。グリオブラストーマ細胞は、正常な脳組織内に深く入り込んでいるため、手術によって完全に取り除くことが困難です。そのため、手術後も放射線と抗がん剤による治療が継続されますが、治療成績は長い間改善していません。
がん治療における問題点の一つは、「抗がん剤に抵抗性になったがん細胞」の出現です。そのメカニズムとして、腫瘍内に潜む「がん幹細胞」の存在が指摘されています。細胞死を誘導する抗がん剤は、がん幹細胞には効きにくく、このがん幹細胞から抗がん剤に耐性を獲得したがん細胞が新たに出現するためと考えられています。
現在、多くの研究機関や製薬企業で、がん幹細胞を標的にしたがん治療薬の開発が進められています。それらのほとんどは、特定のタンパク質や酵素などを狙い撃ちにする分子標的医薬です。これまで、がん領域で開発された分子標的薬の多くは、細胞のがん化に密接に関係しているタンパク質のチロシンリン酸化を担うプロテインチロシンキナーゼ(PTK)ファミリー(注1)を標的とするものでした。しかしながら、これらPTKファミリー分子に対する阻害薬だけでがん治療を行うことは難しく、新たな創薬標的を見つける必要があることが判ってきました。
基礎生物学研究所・統合神経生物学研究部門では長年、PTKファミリー と対をなすチロシンリン酸化の制御分子、プロテインチロシンホスファターゼ(PTP)ファミリー分子の生理的役割やその分子機構機能について研究してきました。最近、その基礎研究の成果をもとに、創薬標的分子としてのPTPファミリーの有望性に注目した研究を行っています。一つの成果として、昨年、統合神経生物学研究部門とアスビオファーマ(株)の共同チームは、PTPの一つPTPRZの酵素活性が、グリオブラストーマ細胞株の高い細胞増殖能や細胞浸潤能に関わることを報告しました(Sci. Reports 6, 20473;, 2016年プレスリリース参照)。同チームはこの研究で、PTPRZの活性中心に結合するオルソステリックタイプ(注2)の阻害剤SCB4380を見出しましたが、これはPTPRZに対する初の選択的阻害剤でした。一方、ハーバード大学医学部の研究グループから、グリオブラストーマにおける遺伝子発現パターンを1細胞レベルで解析し、がん幹細胞性とPTPRZの発現増強に非常に強い相関性があることを示すデータが発表されました(SCIENCE 344, 1396-1401, 2014; Supplementary figure 19)。今回の研究は、グリオブラストーマ細胞のがん幹細胞性に対する、PTPRZの機能阻害の有効性を明らかにすることを目的に行われました。
研究成果
基生研チームは、まずヒトU251及びラットC6グリオブラストーマ細胞株でPTPRZの発現を抑制して(遺伝子ノックダウン)、それが遺伝子発現に与える効果を調べました。その結果、幹細胞性に関わる転写因子群SOX2, OLIG2,及びPOU3F2の発現が変化し、がん幹細胞性の指標であるスフィア(細胞塊)形成能が著しく損なわれることが判りました(図1)。またPTPRZをノックダウンしたC6細胞では、ヌードマウスの皮下移植モデルにおいて、腫瘍形成能が著しく低下することが明らかになりました(図2)。
次に、グリオブラストーマのがん幹細胞性に、PTPRZの酵素活性自身が関わっているのか調べました。今回、共同チームが開発した阻害化合物NAZ2329は、酵素活性中心とは異なる部位に結合する初のアロステリック阻害(注3)化合物です(図3)。これは、第二世代のPTP阻害剤に分類されるもので(Trends Pharmacol Sci.38, 524–540, 2017参照)、我国では最初の報告となります。
グリオブラストーマ細胞株の細胞培養実験では、NAZ2329の処理によって、PTPRZのノックダウンと同様に、SOX2, OLIG2, POU3F2の発現レベルが変化し、スフィア形成能が阻害されました。ラットC6グリオブラストーマ細胞株は、グリオーマの標準治療で使われる抗がん剤である、テモゾロミドに耐性であることが報告されています。そこで、C6グリオブラストーマ細胞の皮下移植モデルを用いて、NAZ2329とテモゾロミドの効果を評価しました。その結果、NAZ2329はテモゾロミド同程度に腫瘍成長を抑制すること、NAZ2329とテモゾロミドの併用投与によって腫瘍成長に対して相乗的な抑制効果が得られることが判明しました(図4)。
今後の展開
用語解説
- (注1)タンパク質チロシンリン酸化:
- がん化に密接に関係する細胞内情報伝達機構として知られている。チロシンキナーゼと呼ばれる酵素群(PTKファミリー)は様々な成長因子の受容体として知られ、細胞内タンパク質の中のチロシンというアミノ酸残基にリン酸基を付加する機能をもつ。PTK活性異常に伴うリン酸化シグナルの異常は多くの発がんの原因であることが判っている。そのリン酸基は、酵素であるチロシンホスファターゼ(PTPファミリー)によって外される(脱リン酸化)。つまり、チロシンリン酸化シグナルは、PTKとPTPによって可逆的に制御されている。ヒトにおいて、PTK及びPTPファミリーに属する分子は、それぞれ100種類を超えている。
- (注2)オルソステリック阻害:
- 内因性の基質と同じ、活性中心への結合による阻害。オルソステリック阻害剤は、酵素の活性中心に結合して、基質分子の結合を競合的に阻害する。PTPに対するオルソステリック阻害化合物は、一般にリン酸基に似た負電荷をもつ構造であるため、細胞膜透過性が悪い。
- (注3)アロステリック阻害:
- 内因性の基質分子とは異なる制御部位への結合による阻害。アロステリック阻害化合物の結合によって、酵素タンパク質の構造や動きが変化し、基質分子に対する触媒活性が阻害される。NAZ2329とPTPRZとの結晶構造解析から、PTPに対する新たなアロステリック部位の存在と、その阻害メカニズムが明らかになった。今後、この解析データを活用して、より「薬らしさ」をもつ創薬シード化合物の開発が可能である。
参考図
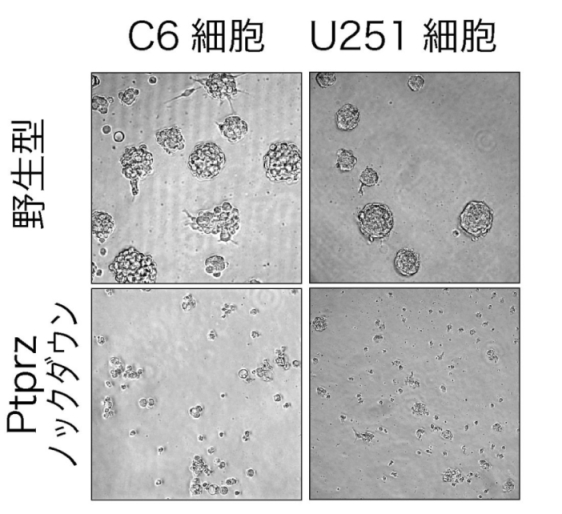
図1:Ptprzノックダウンによるスフィア形成の阻害
ラット由来C6及びヒト由来U251グリオブラストーマ細胞を、特殊な条件下で培養すると丸い細胞塊(スフィア)が形成される(がん幹細胞性の形態的指標の一つ)。Ptprzの発現をshRNAでノックダウンした細胞株では、スフィア形成能が大きく損なわれる。
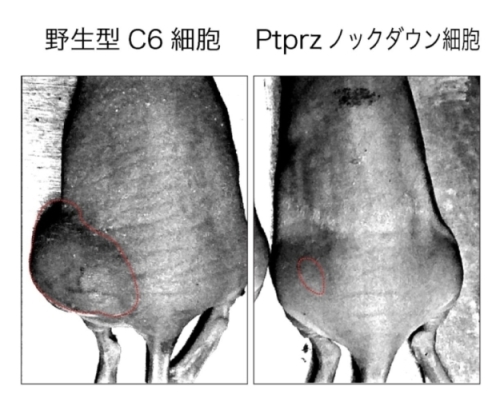
C6細胞をヌードマウス皮下へ移植すると大きな腫瘍が形成されるが、PtprzノックダウンC6細胞では、腫瘍形成能が著しく損なわれている。写真は、細胞移植30日後、腫瘍は赤線囲部分。
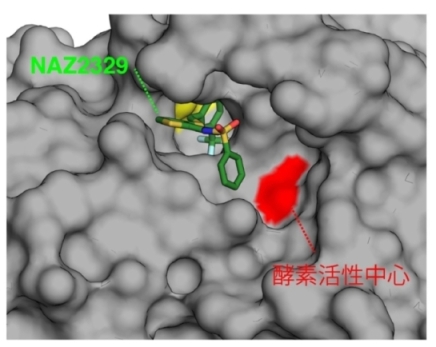
ヒトPTPRZの酵素ドメインとNAZ2329の結晶構造解析。NAZ2329は、活性中心と は異なるポケット(アロステリックサイト)に結合している(NAZ2329の合成はアスビオファーマ株式会社・田中太作氏、結晶解析はアスビオファーマ株式会社・菅原肇氏が担当)。
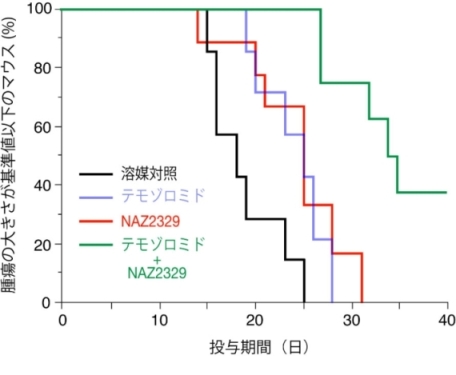
ヌードマウス皮下へのC6細胞移植モデルによる評価。腫瘍サイズが3,000mm3に達するまでの日数を評価指標にした。溶媒コントロール(黒色)に比べ、テモゾロミド(青色)もしくは、NAZ2329(赤色)の投与群では、腫瘍の成長が抑制されている。両者の併用投与(緑色)によって、さらに相乗的な効果が得られる。
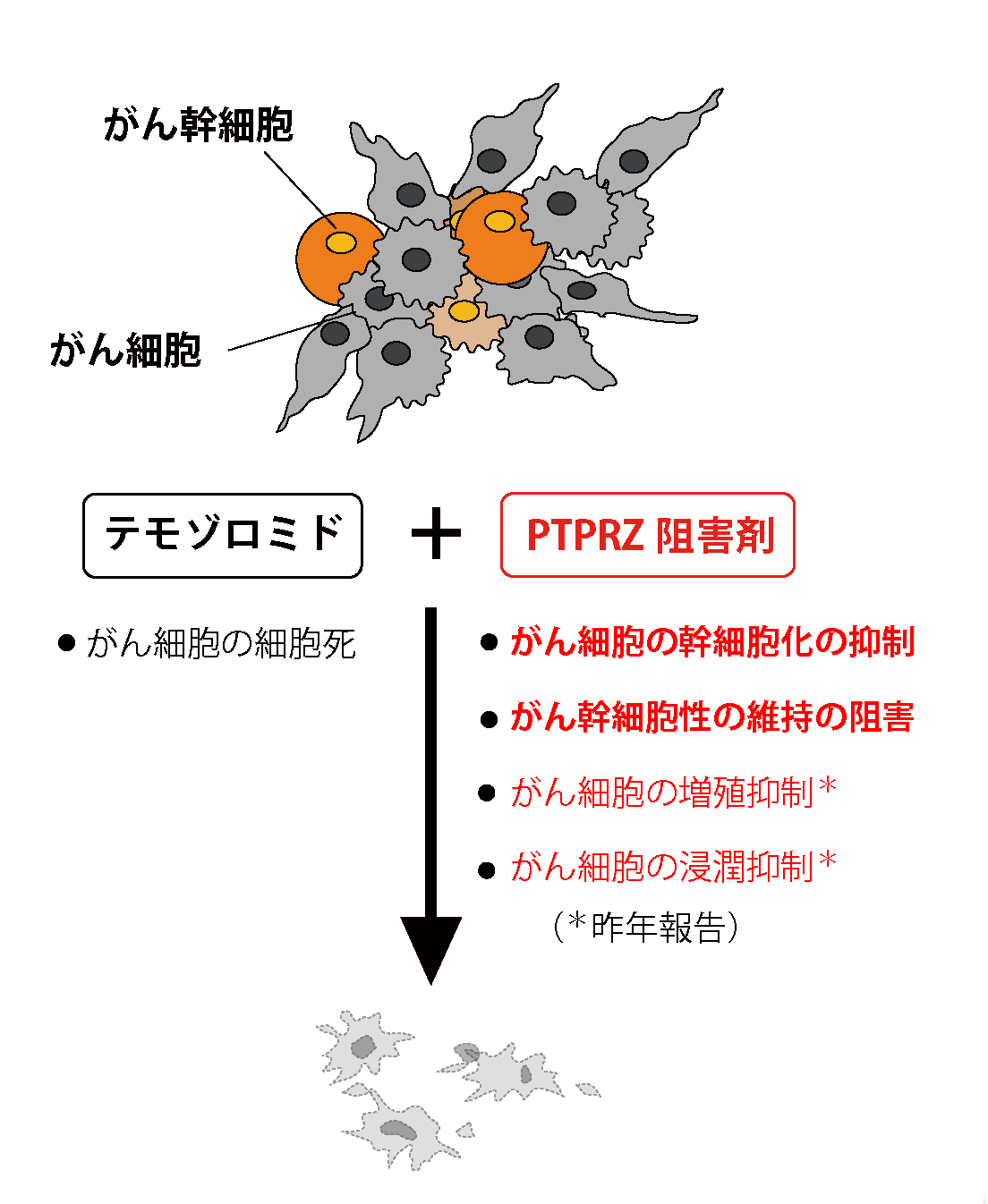
図5:悪性グリオーマに対するPTPRZの活性阻害効果
一つの腫瘍中の細胞は均一ではなく、様々な性質のがん細胞やがん幹細胞が混在している。また、がん細胞の中には、がん幹細胞に先祖返り(脱分化)する細胞もいる。これまでもいくつかのがん種においてPTPRZの発現増加が報告されていたが、最近、ハーバード大学医学大学院のグループによって、ヒトグリオブラストーマ患者の腫瘍における解析で、がん幹細胞性に強くその発現増加が相関する分子としてPTPRZが報告されている(SCIENCE 344, 1396-1401, 2014; Supplementary figure 19)。PTPRZの活性阻害剤には、テモゾロミドなど既存の抗がん剤に対する抵抗性のがん細胞の出現を防ぎ、その治療効果を増強させる作用が期待される。
発表雑誌
英国オンライン科学誌 Scientific Reports 2017年7月17日掲載
- 論文タイトル:
- Targeting PTPRZ inhibits stem cell-like properties and tumorigenicity in glioblastoma cells
- 著者:
- Akihiro Fujikawa,Hajime Sugawara,Taisaku Tanaka, Masahito Matsumoto,Kazuya Kuboyama,Ryoko Suzuki,Naomi Tanga,Atsuto Ogata,Makoto Masumura,and Masaharu Noda
- DOI:
- 10.1038/s41598-017-05931-8
研究サポート
本研究は、国立研究開発法人科学技術振興機構(JST)/国立研究開発法人日本医療研究開発機構(AMED)研究成果最適展開支援プログラム(A-STEP)の支援を受けて行われました。
また、他に以下の資金的支援を受けて実施されました。
- 自然科学研究機構 基礎生物学研究所 共同研究費
- 科学研究費補助金
- 民間財団研究助成金
お問い合わせ先
本件に関するお問い合わせ先 ※研究内容のお問い合わせはこちらにお願いします。
基礎生物学研究所 統合神経生物学研究部門
教授:野田 昌晴(ノダ マサハル)
TEL: 0564-59-5846(研究室)
E-mail:madon“AT”nibb.ac.jp
AMED・A-STEP事業に関すること
国立研究開発法人日本医療研究開発機構
産学連携部 産学連携課
〒100-0004 東京都千代田区大手町1-7-1
TEL:03-6870-2214
E-mail:sangaku“AT”amed.go.jp
※E-mailは上記アドレス“AT”の部分を@に変えてください。
最終更新日 平成29年7月18日


