卵巣がんの悪性度にIL-34が寄与することを初めて解明―新たな治療の標的となる分子としての可能性に期待―
プレスリリース
北海道大学
聖マリアンナ医科大学
神奈川県立がんセンター
滋賀医科大学
東京大学医科学研究所
安田記念医学財団
日本学術振興会
日本医療研究開発機構
ポイント
- 卵巣がんの病巣におけるインターロイキン-34 (IL-34)の発現が、がんの進行度と相関することを発見。
- 抗がん剤への耐性を獲得した卵巣がんの組織において、IL-34の発現が高いことを発見。
- 卵巣がん細胞に由来するIL-34の発現が、腫瘍内での免疫を抑制する環境の形成に寄与することを証明。
概要
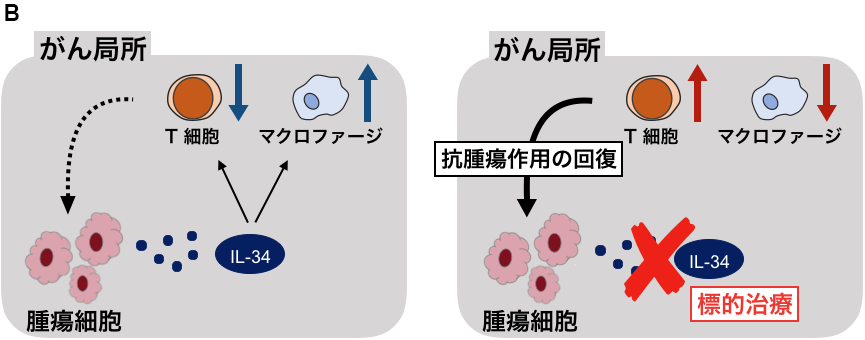
北海道大学遺伝子病制御研究所の清野研一郎教授、同大学大学院医学研究院産婦人科学教室の渡利英道教授、聖マリアンナ医科大学産婦人科学教室の鈴木直教授、滋賀医科大学医学部臨床腫瘍学講座の醍醐弥太郎教授(東京大学医科学研究所特任教授を兼任)、神奈川県立がんセンター臨床研究所の宮城洋平所長らの研究グループは、卵巣がん患者の病巣における液性生理活性因子インターロイキン-34(IL-34)*1が、がんの悪性度を高める一因であることを初めて解明しました。また、外科的手術及び抗がん剤治療を行った後に再発したがんの病巣において、IL-34の発現が高いレベルで検出されることを発見しました。実際にヒトの卵巣がん細胞株の培養液中に抗がん剤を添加した後、生き残ったがん細胞内では、IL-34を産生するために必要な遺伝子の発現が上昇していることを明らかにしました。さらに、マウスの卵巣がん細胞株を用いた実験において、がん細胞がIL-34を産生する条件下では、腫瘍内のがんを攻撃する役割を担うキラーT細胞*2の割合が、減少する傾向にあることを示しました(図を参照)。
本結果は、卵巣がんの進行とIL-34の関係性を示唆するものであり、IL-34を標的とした卵巣がんに対する新たな治療法の開発に繋がるものと期待されます。
なお、本研究成果は、日本時間2019年12月24日(火曜)公開のInternational Immunology誌にオンライン掲載されました。
背景
卵巣がんは婦人科がんにおいて子宮がんに次いで二番目に致死率の高いがんです。初期における自覚症状が乏しいため、卵巣がん患者の多くは進行期での診断となることが大きな問題となっています。また、発見後は原発巣*3の外科的摘出及び一次化学療法(抗がん剤療法)による治療が一般的ですが、その後の再発率が高いため患者を苦しめています。そのため、卵巣がん患者の治療効率を高めるには、がんの進行及び再発に寄与する要因の特定が必要です。
IL-34は2008年に初めて同定された液性生理活性因子・サイトカイン(細胞に変化をもたらすタンパク質の一種)であり、その発現は正常なヒトでは脳や皮膚にその発現は限定されていますが、近年さまざまな種類のがん種の病巣において発現が確認され、がんの進行や転移に関与することが報告されています。しかし現在までに卵巣がんにおけるIL-34の作用に関する報告はありませんでした。本研究では新たな治療の標的となり得るIL-34に着目し、卵巣がんの悪性度への寄与を検討しました。
研究手法
本研究では北海道大学大学院医学研究院産婦人科学教室(婦人科腫瘍学)、聖マリアンナ医科大学産婦人科学教室及び文部科学省科学研究費新学術領域研究「コホート・生体試料支援プラットフォーム(CoBiA)」から提供を受けた臨床検体を用いました。臨床検体におけるIL-34の発現と検体情報を基に、卵巣がんの病巣におけるIL-34とがんの悪性度及び患者の予後との関連性を検証しました。
また、ヒトの卵巣がん細胞株であるKF28、OVTOKO、OVISE及びマウスの卵巣がん細胞株であるHM-1におけるIL-34の発現をreal-time PCR*4、ELISA*5と呼ばれる手法で解析しました。IL-34を発現するHM-1から、遺伝子を編集する手法であるCRISPR-Cas9システム*6を用いてIL-34ノックアウト*7HM-1株(IL-34KO HM-1)を樹立し、元株であるHM-1及びIL-34KO HM-1のそれぞれを、実験用マウスの卵巣に直接移植する実験を行いました。その後、マウスの生存期間の観察と原発巣である卵巣腫瘍内に浸潤している免疫細胞を解析することで、がん細胞に由来するIL-34の卵巣がんの悪性度への寄与を検証しました。
研究成果
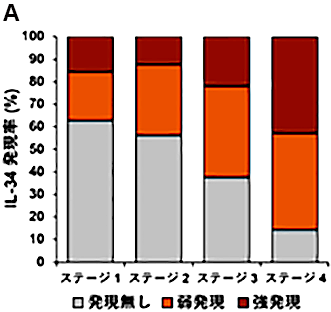
臨床検体の解析結果から、ステージ*8が3、4にまで達している患者の検体におけるIL-34の発現率は、ステージが1、2の患者よりも高いことが明らかとなりました。また,外科的手術及び抗がん剤治療を行った後に再発した検体では、原発巣と比べIL-34の発現が高いレベルで検出されました。さらに、ヒトの卵巣がん細胞株を用いた実験により、抗がん剤を添加した後に生存した細胞では、IL-34の産生に必要な遺伝子の発現が上昇することを発見しました。
次に、IL-34を産生するHM-1及びIL-34KO HM-1をマウスの卵巣内に移植し、その後のマウスの生存期間を比較したところ、IL-34KO HM-1を移植した群において有意に生存期間が延長されることが明らかとなりました。加えて、卵巣がん細胞の移植後10日目に原発巣である卵巣の腫瘍を摘出し、腫瘍内に浸潤する細胞を解析したところ、がん細胞を攻撃する役割を担うキラーT細胞の割合は、IL-34KO HM-1が形成する腫瘍で高い傾向にあることがわかりました。
これらの結果より、卵巣がん細胞から産生されるIL-34は腫瘍内の免疫環境に働きかけ、がんの悪性度を高めている恐れがあると考えられます。
今後への期待
本研究によって、進行性の卵巣がんの病巣においてIL-34が発現している確率が高く、またその発現は抗がん剤治療によっても誘導され得るものだということが明らかとなりました。実験用マウスを用いた解析では、がん細胞に由来するIL-34を抑制することでがんの進行を遅らせ、個体の生存期間が延長しました。これらのことから、卵巣がんに対する治療における新たな治療の標的となる分子としてIL-34が有用である可能性があります。今後、卵巣がんにおけるIL-34の免疫学的作用の研究が進み、IL-34を新たな標的とした新規治療法が確立されることが期待されます。
研究費・研究支援
本研究は、国立研究開発法人日本医療研究開発機構(AMED)の革新的がん医療実用化研究事業「IL34 を基軸としたがん微小環境分子基盤の理解とその臨床的特性に基づいた新しい治療法の開発」(研究開発代表者:清野研一郎)、公益財団法人安田記念医学財団若手癌研究助成(研究開発代表者:Muhammad Baghdadi)より支援を受けて行われました。また、IL-34に関する先行研究につき文部科学省科研究費助成事業・新学術領域研究「学術研究支援基盤形成」の「コホート・生体試料支援プラットフォーム(CoBiA)」(JSPS科研費:JP16H06277)(中核機関:東京大学医科学研究所)の試料提供・解析支援を受けました。
論文情報
- 論文名
- Interleukin-34 expression in ovarian cancer: A possible correlation with disease progression(卵巣がんにおけるIL-34の発現ががんの進行に関与する可能性)
- 著者名
- 遠藤 拓1、2、羽馬 直希1、Muhammad Baghdadi1、石川 浩三1、大塚 亮1、和田 はるか1、朝野 拓史3、遠藤 大介3、金野 陽輔3、加藤 達矢3、渡利 英道3、戸澤 晃子2、鈴木 直2、横瀬 智之4、高野 淳5, 8、加藤 久盛6、宮城 洋平7、醍醐 弥太郎5, 8、清野 研一郎1(1北海道大学遺伝子病制御研究所免疫生物分野、2聖マリアンナ医科大学産婦人科学教室、3北海道大学大学院医学研究院産婦人科学教室、4神奈川県立がんセンター病理診断科、5滋賀医科大学医学部臨床腫瘍学講座、6神奈川県立がんセンター婦人科、7神奈川県立がんセンター臨床研究所・がん分子病態学部、8東京大学医科学研究所附属病院抗体・ワクチンセンター)
- 雑誌名
- International Immunology(日本免疫学会誌)
- DOI
- 10.1093/intimm/dxz074
用語解説
- *1 インターロイキン-34 (IL-34)
- インターロイキンとは白血球から分泌されるタンパク質の総称であり、細胞同士の情報伝達を担うもの。30種類以上が発見されており、IL-34は34番目に同定された。
- *2 キラーT細胞
- 宿主にとって異物となる細胞(ウィルス感染細胞やがん細胞など)を認識して破壊する役割を担う細胞。外的影響を受け、増殖、活性化及び炎症部位への遊走などが促される。
- *3 原発巣
- がんが最初に発生した部分のこと。本研究中では卵巣と、そこに生じた腫瘍を指す。
- *4 Real-time PCR
- PCRとは、細胞(細胞株や組織から分取したもの)内で行われているDNAの複製を人工的に繰り返す実験手法であり、目的とした塩基配列のみを効率的に増幅することができる。この手法を応用したreal-time PCRでは、目的の遺伝子特異的な塩基配列のPCR産物を特殊蛍光物質でモニタリングすることで、その遺伝子発現レベルを相対的に定量することが可能となる。
- *5 ELISA
- 細胞から培養液中に放出されたタンパク質を定量する実験手法。
- *6 CRISPR-Cas9 システム
- DNA配列中の任意の部分を切断できる遺伝子改変ツール。切断したい部分に結合するように設計された短い塩基配列と、DNA切断酵素であるCas9 タンパク質を発現するために必要な遺伝子配列を同時に細胞に導入することで、DNA配列中の任意の部分を切断することが可能となる。
- *7 ノックアウト
- 細胞があるタンパク質を産生するために必要不可欠な遺伝子を人為的操作によって編集し、その産生を消失させること。
- *8 ステージ
- がんの進行度を示す指標。卵巣がんのステージは1から4に分類されている。
- ステージ1:がんが卵巣の中にとどまっている状態。
- ステージ2:がんが骨盤内に広がっている状態。
- ステージ3:がんが骨盤外の腹腔内に転移、あるいはリンパ節に転移している状態。
- ステージ4:がんが腹腔を越え、肺などの遠隔臓器にまで広がっている状態。
お問い合わせ先
研究内容に関すること
北海道大学遺伝子病制御研究所免疫生物分野
教授 清野研一郎(せいのけんいちろう)
TEL:011-706-5532 FAX:011-706-7545
メール:seino“AT”igm.hokudai.ac.jp
The SEINO Lab.
AMEDに関すること
国立研究開発法人日本医療研究開発機構(AMED)
戦略推進部 がん研究課
TEL:03-6870-2221 メール:cancer“AT”amed.go.jp
配信元
北海道大学総務企画部広報課
〒060-0808 札幌市北区北8条西5丁目
TEL:011-706-2610 FAX:011-706-2092
メール:kouhou“AT”jimu.hokudai.ac.jp
※E-mailは上記アドレス“AT”の部分を@に変えてください。
関連リンク
掲載日 令和元年12月25日
最終更新日 令和元年12月25日


