プレスリリース 第3の核酸医薬の「ヘテロ2本鎖核酸」の開発―日本発の分子標的核酸薬の基盤技術―
プレスリリース
国立大学法人東京医科歯科大学
国立研究開発法人科学技術振興機構
国立研究開発法人日本医療研究開発機構
ポイント
- 特定の遺伝子を制御して治療する目的の核酸医薬にアンチセンス核酸、siRNAがあります。これらの従来の核酸医薬とは異なる新しい分子構造・作用機序を有する第3の核酸医薬、「ヘテロ2本鎖核酸(HDO)」の開発に成功しました。
- ヘテロ2本鎖核酸は従来の核酸医薬よりはるかに高い効果を示し、既存のあらゆるアンチセンス核酸の作用を大幅に向上できます。
- 従来困難だった肝臓以外での臓器の遺伝子制御が可能となり、核酸医薬の臨床応用の可能性が大きく広がります。ヘテロ2本鎖核酸は日本発の分子標的治療の画期的な基盤技術として期待できます。
東京医科歯科大学大学院医歯学総合研究科 脳神経病態学分野の横田隆徳教授の研究グループは、大阪大学などとの共同研究で、新規の核酸医薬であるヘテロ2本鎖核酸(HDO)の開発に成功しました。この研究は国立研究開発法人科学技術振興機構(JST)戦略的創造研究推進事業(CREST)「新機能創出を目指した分子技術の構築」研究領域(研究総括:山本尚教授)、ならびに国立研究開発法人日本医療研究開発機構(AMED)革新的バイオ医薬品創出基盤技術開発事業などの支援のもとでおこなわれたもので、その研究成果の一部は、国際科学誌Nature Communications(ネイチャーコミュニケーションズ)に、2015年8月10日午前10時(英国時間)にオンライン版で発表されます。
研究の背景
アンチセンス核酸、siRNAなどの核酸医薬を用いた遺伝子治療は、細胞膜上の分子しか標的にできない抗体医薬と異なって、細胞内のあらゆる遺伝子を制御できます。その汎用性の高さから、今まで治療困難とされてきた様々な疾患、特に癌や神経疾患への臨床応用が強く期待されています。核酸医薬は2013年に高脂血症薬ミポメルセンが米国で認可されて以来、欧米で急速にその臨床応用は進展しています。一方で、生体内での有効性は未だ不十分で、特に肝臓以外の臓器へのデリバリーが困難であることが最大の問題点です。さらに、アンチセンス核酸やsiRNAはその基本特許を欧米に抑えられており、日本での開発には大きな制限があります。次世代分子標的治療薬として有望視されている核酸医薬で、日本がこの新領域をリードするには、有効性が高く、肝臓以外の臓器のデリバリーが可能な新規核酸の基盤技術の開発とその知財が必要です。我々は既存のアンチセンス核酸、siRNAと異なる新しい分子構造・作用機序と高い有効性を有する第3の核酸医薬、「ヘテロ2本鎖核酸」の開発に成功しました(図1)。
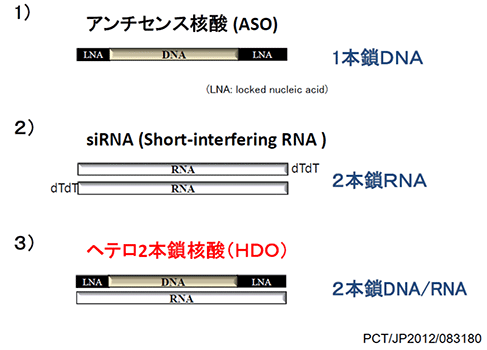 図1.ヘテロ2本鎖核酸の分子構造図
図1.ヘテロ2本鎖核酸の分子構造図
研究成果の概要
ヘテロ2本鎖核酸はDNA鎖を主鎖として、主鎖に相補的なRNAからなる2本鎖の人工機能核酸です。DNA鎖の両端に架橋型人工核酸(Locked nucleic acid; LNA)を配した「ギャップマー型」にした時、2本鎖の中央部がDNA/RNAヘテロ核酸になるため、この部分が細胞内のRNAを分解する酵素であるRNase Hによって認識され、相補鎖RNAが切断されます(図2A)。 その結果、単独となった主鎖が標的RNAに結合し、再びRNase Hが標的RNAを切断して、遺伝子抑制効果を発揮するデザインです。 すなわち、RNase Hが相補鎖RNAと標的RNAの切断の一人二役を果たすことにより、主鎖であるDNA鎖の結合親和性に影響を与えることなく相補鎖RNAにリガンドを結合することが可能となった点が特徴の分子技術です。 RNA鎖の末端のリガンドには脂質、抗体、ペプチド、糖鎖などさまざまな細胞内外の薬剤送達システムを制御、向上させる分子を結合することが可能です(図2B)。
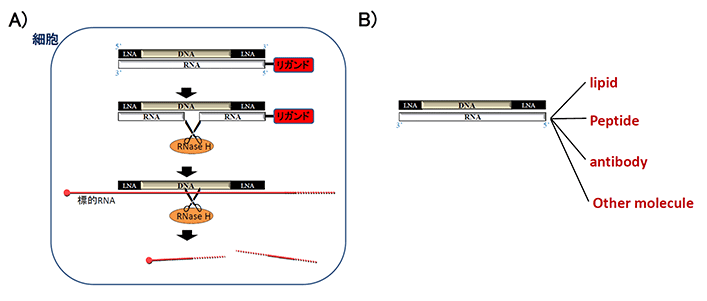 図2.ヘテロ2本鎖核酸の細胞内作用機序(A)、リガンド分子の多様性(B)
図2.ヘテロ2本鎖核酸の細胞内作用機序(A)、リガンド分子の多様性(B)
我々の特許であるビタミンE (VE)をリガンド分子として相補鎖RNAに結合させ、静脈投与したところ、低投与量(0.75mg/kg)でも90~99%以上と今までにない劇的な抑制率を達成しました。その標的遺伝子抑制効果は、従来のアンチセンス核酸や、VE結合siRNA(VE-siRNA)と比べて飛躍的に高く、現状の核酸医薬で最高水準です(図3)。
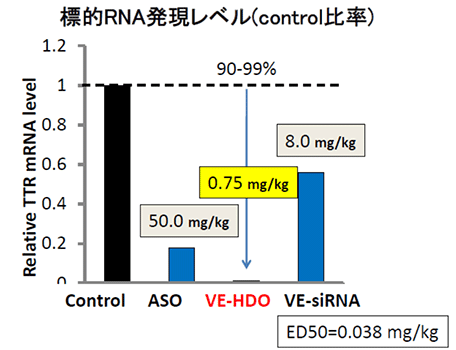 図3.ヘテロ2本鎖核酸の顕著な遺伝子抑制効果(肝臓)
図3.ヘテロ2本鎖核酸の顕著な遺伝子抑制効果(肝臓)
現在phase Ⅲ進行中の家族性アミロイドニューロパチーの原因遺伝子トランスサイレチン(TTR)をビタミンE結合ヘテロ核酸(VE-HDO)はアンチセンス核酸(ASO)やビタミンE結合siRNA(VE-siRNA)よりはるかに効果的に抑制できる
この技術によって、ビタミンEを結合したヘテロ2本鎖核酸をマウスに静脈注射することで、既存のアンチセンス核酸と比較して肝臓での標的遺伝子発現抑制効果を 10~1000倍に増強することに成功しました。この効果は霊長類であるカニクイザルでも確認できました。最も有効性の高い配列の場合、標的遺伝子発現を半減させるために必要な投与量(ED50)は0.038mg/kgとなりました。これは核酸医薬単独では従来報告されたものの中で最も高い有効性となります。さらに有効性が高いため、従来のアンチセンス核酸と比較して同等の効果を得るために必要な核酸量がはるかに少なくなり、その結果として肝機能障害などの副作用を軽減させることも分かりました。さらに、全身投与で肝臓だけでなく心臓、骨格筋、肺、腎臓、脾臓、皮下脂肪など多くの臓器の遺伝子制御が可能であることが判明しました(図4)。
その作用機序は、十分には判明していませんが、短いDNA/RNAヘテロ2本鎖核酸は特有の細胞内認識機構と細胞内の輸送系にあって、従来知られている「DNAを鋳型としてRNAが合成されその情報をもとにタンパク質が合成される」というセントラルドグマや非コードRNAとは異なる未知の分子生物学的機構を利用している可能性を考えています。
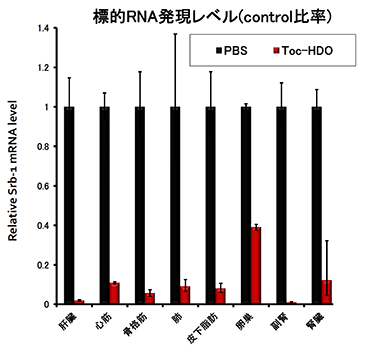 図4.ヘテロ2本鎖核酸の広汎な臓器での遺伝子抑制効果
図4.ヘテロ2本鎖核酸の広汎な臓器での遺伝子抑制効果
研究成果の意義
- ヘテロ2本鎖核酸はビタミンEを薬物送達分子として用いることにより、既存の核酸医薬で最も高い有効性(ED50=0.038mg/kg)を示し、かつ既存のアンチセンス核酸の有効性を10~1000倍に増強する効果を認め、高い汎用性と大幅なコスト削減、副作用の軽減に成功しました。
- 従来の核酸医薬を凌駕する有効性に加えて、 核酸医薬の臨床応用に最大問題点であった全身投与による肝臓以外の臓器の遺伝子制御を初めて可能にしました。
- その顕著な有効性の背景には、従来知られていない短いDNA/RNAによる新規の分子生物学的な機構の存在が示唆されます。
- ヘテロ2本鎖核酸は基盤技術として、高い汎用性・応用性・発展性を持った日本発の第3の新規核酸医薬であり、その知財も確保され、次世代分子標的薬の構図を塗り替える可能性を秘めています。
問い合わせ先
研究に関すること
東京医科歯科大学大学院医歯学総合研究科
脳神経病態学分野 横田 隆徳(ヨコタ タカノリ)
TEL:03-5803-5233 FAX:03-5803-0169
E-mail:tak-yokota.nuro"at"tmd.ac.jp
JSTの事業に関すること
古川 雅士(フルカワ マサシ)
科学技術振興機構 戦略研究推進部 グリーンイノベーショングループ
〒102-0076 東京都千代田区五番町7K’s五番町
TEL:03-3512-3531 FAX:03-3222-2066
E-mail:crest"at"jst.go.jp
報道に関すること
東京医科歯科大学 広報部広報課
〒113-8510 東京都文京区湯島1-5-45
TEL:03-5803-5833 FAX:03-5803-0272
E-mail:kouhou.adm"at"tmd.ac.jp
科学技術振興機構 広報課
〒102-8666 東京都千代田区四番町5番地3
TEL:03-5214-8404 FAX:03-5214-8432
E-mail:jstkoho"at"jst.go.jp
日本医療研究開発機構 経営企画部 企画・広報グループ
〒100-0004 東京都千代田区大手町1-7-1
TEL:03-6870-2245 FAX:03-6870-2206
E-mail:contact"at"amed.go.jp
AMEDの事業に関すること
日本医療研究開発機構 戦略推進部医薬品研究課
革新的バイオ医薬品創出基盤技術開発事業担当
〒100-0004 東京都千代田区大手町1-7-1
TEL:03-6870-2219 FAX:03-6870-2244
E-mail:kaku-bio27"at"amed.go.jp
※E-mailは、アドレスの"at"の部分を@に変えてください。
関連リンク
掲載日 平成27年8月10日
最終更新日 平成27年8月10日


