プレスリリース 胆道がんにおける大規模ゲノム解読―新規治療標的ゲノム異常と発生部位ごとの分子学的特徴を解明 予後不良群での免疫チェックポイント療法の有効性を示唆―
プレスリリース
国立研究開発法人国立がん研究センター
国立研究開発法人日本医療研究開発機構
本研究成果のポイント
- 世界最大の胆道がんゲノム解読研究によって、新規のものも含めドライバー遺伝子の全貌を明らかにした。
- 胆道がんの約40%には治療標的となりうるゲノム異常が存在していることを明らかにした。
- 胆道がんにおいて免疫チェックポイント療法に反応する可能性が高いグループを同定した。
国立研究開発法人国立がん研究センター(理事長:堀田知光、東京都中央区、略称:国がん)は、大規模な胆道がんのゲノム(DNA)ならびにトランスクリプトーム(RNA)解読を行い、新たな治療標的となりうる新規ゲノム異常や発生部位(肝内および肝外胆管、胆のう)ごとの特徴を明らかしました。また遺伝子発現データから予後不良群を同定し、同群で免疫チェックポイント療法が有効である可能性を報告しました。
本研究は、国際共同ゲノムプロジェクト「国際がんゲノムコンソーシアム」(International Cancer Genome Consortium:ICGC)の一環として、研究所 がんゲノミクス研究分野(分野長:柴田龍弘)の研究グループが厚生労働省ならびに2015年度からは日本医療研究開発機構(AMED)の「革新的がん医療実用化研究事業」の支援を受けて行ったもので、国際科学誌「Nature Genetics(電子版)」に2015年8月10日付(日本時間8月11日午前0時)オンライン版で発表されました。
胆道がん(肝内および肝外胆管がん、胆のうがんの総称)は日本をはじめアジアで多いがんですが、近年は欧米でも増加傾向にあります。しかし、分子標的薬を含めてこれまで有効な治療法が確立しておらず、本邦における5年生存率は20%以下と膵がんに続く予後不良ながんです。
本研究では、胆道がんにおける治療標的の同定とそれを起点とした新たな治療法の開発を目指し、世界最大規模となる260例の臨床検体についてゲノム(DNA)ならびにトランスクリプトーム(RNA)の解析を行い、胆道がんにおけるゲノム異常の全貌を明らかにしました。
免疫チェックポイントは、がんが免疫細胞の機能を抑制し、宿主免疫細胞による攻撃から逃れる機構としても知られ、最近では免疫チェックポイント阻害薬ががんに対する治療として世界的に注目されています。すでに免疫チェックポイント阻害薬は大規模臨床試験においてメラノーマ(皮膚がんの一種)や肺がんに対する有効性が示されており、他のがん種に対しても現在、精力的に開発が進められています。今回の研究結果から、一部の胆道がんにおいても免疫チェックポイント阻害薬に反応する可能性が示唆され、今後、胆道がんに対する免疫チェックポイント阻害薬の開発推進が期待されます。
研究成果の概要
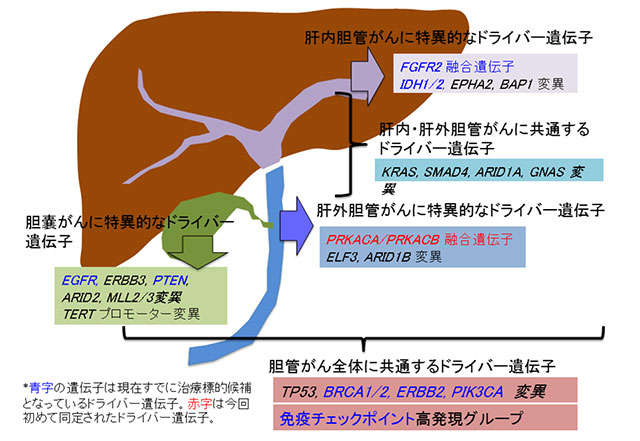
1.世界最大の胆道がんゲノム解読研究によって、新規を含めたドライバー遺伝子やドライバー分子経路の全貌を明らかにした(図1、2)
肝内胆管がん145例、肝外胆管がん86例、胆のうがん29例を対象として、ゲノム(DNA)およびトランスクリプトーム(RNA)解読を行い、32個の重要なドライバー遺伝子*1を同定しました。
また、図1に示すように、解剖学的部位(肝内および肝外、胆のう)ごとに特徴的なドライバー遺伝子ががんの発生に寄与していることが明らかとなりました。例えば、肝内胆管がんではFGFR2融合遺伝子、IDH1、EPHA2、BAP1というドライバー遺伝子が特徴的でした。一方、肝外胆管がんでは新規に同定したPRKACA/PRKACB融合遺伝子、ELF3, ARID1Bといったドライバー遺伝子が、胆のうがんではEGFR、ERBB3、PTEN、TERT等といったドライバー遺伝子が特徴的でした。また、肝内・肝外胆管がんに共通なドライバー遺伝子としてKRAS、SMAD4、ARID1A、GNASが、全ての部位で共通なものとしてはTP53、BRCA1、BRCA2、ERBB2、PIK3CAが同定されました。
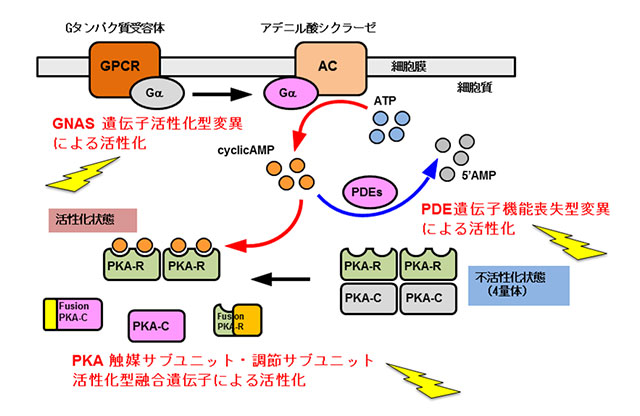
さらに、胆道がんにおけるドライバー分子経路として、これまで報告されていたRAS経路に加えて、PKA (プロテインキナーゼA)分子経路の活性化が胆道がんにおいて重要なドライバー分子経路であることを初めて明らかにしました(図2)
これらの結果から、発生部位ごとにがんの発生メカニズムが異なっており、それに応じて薬剤臨床開発の重心も変えていく必要があることが分かりました。
図1:世界最大の胆道がんゲノム解読研究によって、新規のものも含めドライバー遺伝子の全貌を明らかにした
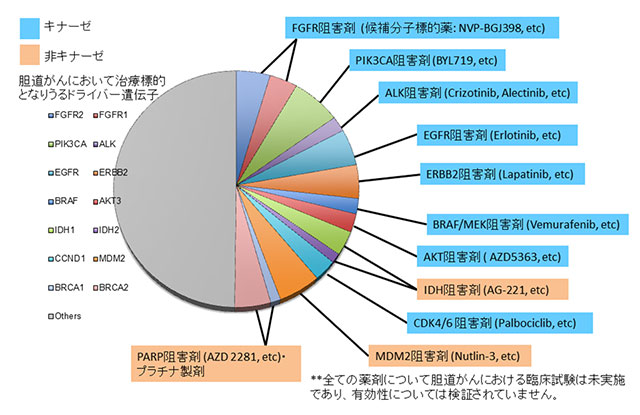
2.胆道がんの約40%には治療標的となりうるゲノム異常が存在していることを明らかにした(図3)
本研究で同定した胆道がんにおけるゲノム異常の中には、図3に示すように、少なくとも14個の治療標的(すでに治療薬の臨床開発が進められているもの)となりうる遺伝子が含まれていました。さらに、それらのゲノム異常を少なくとも1つ持つ腫瘍は全体の約40%を占めていました。これらのゲノム異常を標的とした治療薬が胆道がんに対して有効かどうかは、臨床試験によって検討を重ねる必要がありますが、とりわけ日本人における胆道がん治療開発を進めていく上で、今回の研究成果は重要な情報基盤となります。
図3:胆道がんの約40%には治療標的となりうるゲノム異常が存在していることを明らかにした
(*下図では同一症例に重複して起こっている遺伝子についても分けて表示)
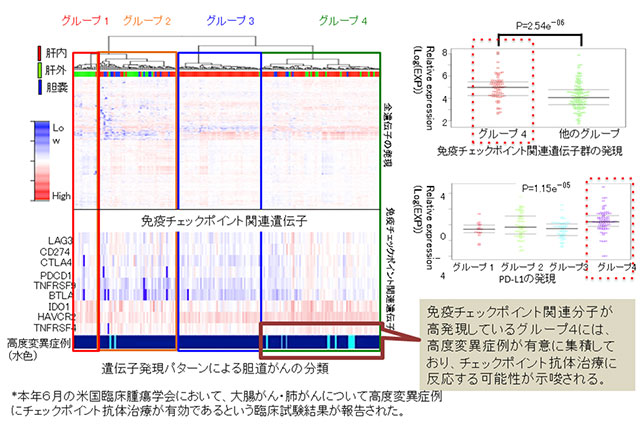
3.胆道がんにおいて免疫チェックポイント療法に反応する可能性が高いグループを同定した(図4)
トランスクリプトーム(RNA)解読によって得られた遺伝子発現やゲノム情報を元に、分子プロファイルに基づく胆道がんの新たな分類を試みたところ、4群に分類することができました。このうちグループ4は他のグループに比べ有意に予後不良でした。そこで、グループ4に特徴的な遺伝子発現を調べた結果、免疫関連遺伝子、とりわけPD-L1等の免疫チェックポイント分子の発現が有意に上昇していることが明らかとなりました。さらに最近、大腸がん・肺がんにおいて高度変異蓄積症例に免疫チェックポイント阻害薬が有効であるという臨床試験の結果が報告されましたが、グループ4においても高度変異蓄積症例が有意に集積していました。これらの結果から、グループ4の症例に免疫チェックポイント阻害薬が有効である可能性が示唆されました。
図4:胆道がんにおいて免疫チェックポイント療法に反応する可能性が高いグループを同定
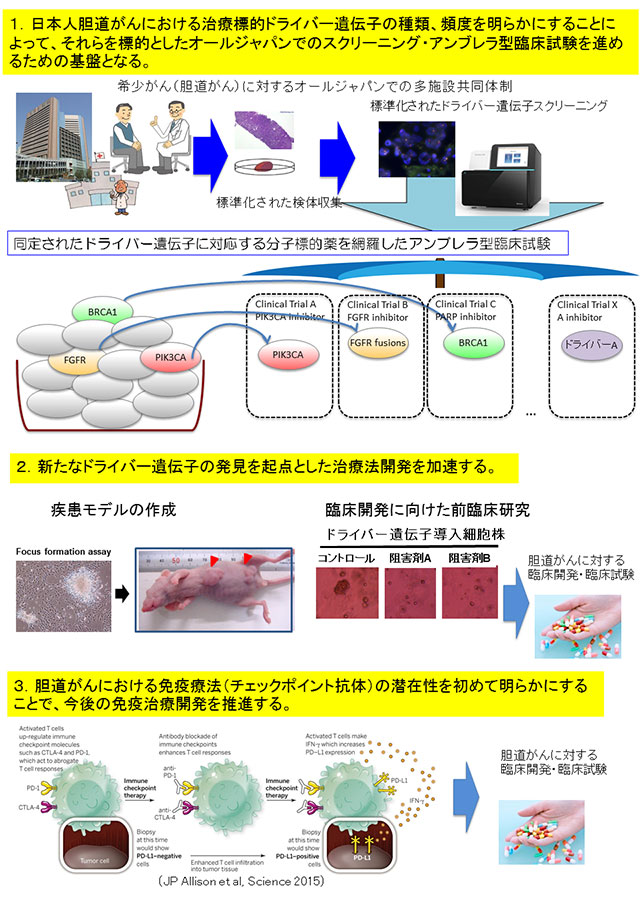
今後の展望(図5)
今回の研究成果を元に、以下の3つの方向で今後の胆道がんの治療を変えていくことを目指します。
- 本研究で明らかにした日本人胆道がんのドライバー遺伝子を治療標的とした、オールジャパン(全国規模)での遺伝子スクリーニングとアンブレラ型臨床試験*2を進めます。
- 新たに発見したドライバー遺伝子に対する治療法の開発を進めます。
- 胆道がんにおける免疫療法(免疫チェックポイント阻害薬)の可能性が初めて示されたことから、今後、免疫治療の開発推進が期待されます。
図5:今回の研究成果が今後の胆道がんの治療をどう変えるのか?
中央病院 肝胆膵内科長 奥坂 拓志のコメント
「胆道がんは早期発見が難しく良い治療方法が少ないため難治がんと言われてきましたが、今回の研究は胆道がんに対して複数の分子標的治療や免疫療法が良好な効果を示す可能性が高いことを示しており、今後の治療開発に直結する非常に重要な成果と考えられます。」
発表雑誌
- 論文タイトル:
- Genomic spectra of biliary tract cancer
- 著者:*責任者
-
Hiromi Nakamura, Yasuhito Arai, Yasushi Totoki, Tomoki Shirota, Asmaa Elzawahry, Mamoru Kato, Natsuko Hama, Fumie Hosoda, Tomoko Urushidate, Shoko Ohashi, Nobuyoshi Hiraoka, Hidenori Ojima, Kazuaki Shimada, Takuji Okusaka, Tomoo Kosuge, Shinichi Miyagawa, Tatsuhiro Shibata*
- DOI番号:
- 10.1038/ng.3375.
用語解説
- *1 ドライバー遺伝子
-
がん遺伝子・がん抑制遺伝子といった、がんの発生・進展において直接的に重要な役割を果たす遺伝子。低分子阻害剤や抗体医薬など、さまざまな分子治療の標的として有望とされる。がんの発生過程においては、ゲノム変異が起こりやすい状態(いわゆるゲノム不安定性)となるため、がんの発生には無関係な遺伝子にもランダムに変異が起こることが知られている(背景変異、あるいはパッセンジャー遺伝子と呼ばれる)。したがって、統計的解析によって、本物の異常(ドライバー遺伝子)と背景異常(パッセンジャー遺伝子)を区別する必要がある。
- *2 アンブレラ型臨床試験
-
分子標的薬のように特定のバイオマーカーの有無で個別化医療を行う場合、一部の患者さんしか臨床試験の対象とならない場合がある。その際に、個別化バイオマーカーが異なる臨床試験を複数並列して行うことで、なるべく多くの患者さんが臨床試験に参加することが可能となり、効率的に臨床開発を行うことができる。こうした仕組みをアンブレラ型(複数の臨床試験が傘の骨のように並列することから)と呼び、とりわけ胆道がんのような希少がんでは、臨床試験に参加できる患者さんの数も限られていることから有効な取り組みであると考えられている。
お問い合わせ先
報道関係のお問い合わせ先
国立研究開発法人国立がん研究センター
〒104-0045 東京都中央区築地5-1-1
研究所 がんゲノミクス研究分野 分野長
東京大学医科学研究所 ヒトゲノム解析センター ゲノムシークエンス解析分野
教授 柴田 龍弘
TEL:03-3542-2511(内線3123) FAX:03-3547-5137 E-mail:tashibat"at"ncc.go.jp
企画戦略局 広報企画室
TEL:03-3542-2511(代表) FAX:03-3542-2545 E-mail:ncc-admin"at"ncc.go.jp
がん対策全般についてのお問い合わせ
厚生労働省健康局 がん対策・健康増進課
〒100-8916 東京都千代田区霞が関1-2-2
TEL:03-5253-1111(代表)
革新的がん医療実用化研究事業に関するお問い合わせ
国立研究開発法人日本医療研究開発機構(AMED) 戦略推進部がん研究課
〒100-0004 東京都千代田区大手町1-7-1
TEL:03-6870-2221 E-mail:cancer"at"amed.go.jp
※E-mailは、アドレスの"at"の部分を@に変えてください。
関連リンク
掲載日 平成27年8月11日
最終更新日 平成27年8月11日


