プレスリリース 神経難病「多発性硬化症」の慢性炎症に関わる新しいリンパ球を発見―新しい治療法の開発に道筋―
プレスリリース
国立研究開発法人国立精神・神経医療研究センター
国立研究開発法人日本医療研究開発機構
国立研究開発法人 国立精神・神経医療研究センター(NCNP、東京都小平市 理事長:樋口輝彦)神経研究所(所長:武田 伸一)免疫研究部山村隆部長、大木伸司室長、ベン レイバニー研究員らの研究グループは、神経難病である多発性硬化症(MS, Multiple sclerosis)のなかでも、特に高度の神経障害をのこす二次進行型MSで、エオメス(Eomes)というタンパクを発現する新型リンパ球が重要な役割を果たすことを明らかにしました。このリンパ球は神経細胞を障害する物質を分泌して脳や脊髄の慢性炎症を引き起こします。研究グループは、マウスモデルでこのリンパ球が病気の発症に関わることを証明し、治療薬開発の新たな標的になることを示しました。また二次進行型MS患者の血液や髄液でも、この新型リンパ球が増加していることが分かりました。エオメス陽性の新型リンパ球を阻害する薬剤によって、進行型MSや炎症を伴う神経変性疾患が治療できる可能性があります。
この研究成果は、2015年10月5日午後6時(イギリス時間10月5日午前10時)Nature Communicationsオンライン版に掲載されます。
本成果は、以下の事業・研究領域・研究課題によって得られました。
- AMED委託研究開発費;難治性疾患実用化研究事業「二次進行型多発性硬化症の画期的な新規治療の開発に関する研究」 2015年度~
- 厚生労働科学研究委託事業;難治性疾患等克服研究事業「二次進行型多発性硬化症に対する革新的な医薬品の開発を促進させる研究」 2014年度
- 科学研究費助成事業基盤研究C「自己免疫疾患の炎症病態形成・維持に関わる細胞間相互作用の研究」 2012年度~2014年度
研究の背景
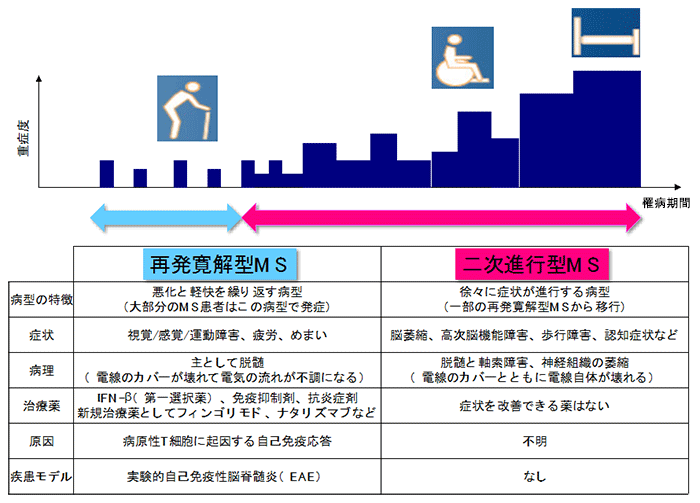 図1 多発性硬化症の病型とその特徴(再発寛解型MS vs 二次進行型MS)
図1 多発性硬化症の病型とその特徴(再発寛解型MS vs 二次進行型MS)
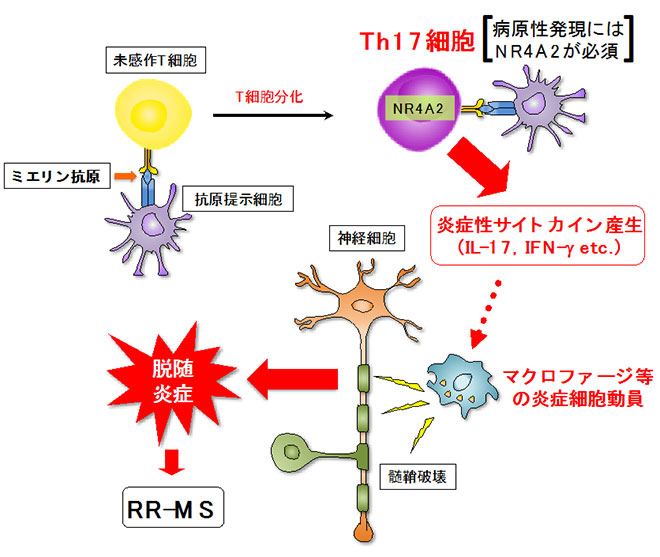 図2 再発寛解型MSの発症機序とNR4A2によるTh17細胞の機能制御
図2 再発寛解型MSの発症機序とNR4A2によるTh17細胞の機能制御
研究の内容
SP-MSモデルを用いた病原性T細胞の同定と病態解明
NR4A2欠損マウスにEAEを誘導したところ、最初のうちは病気の発症が抑制されたように見えました。ところが観察を続けると、NR4A2欠損マウスではEAEの症状が何週間も遅れて現れてきました(図3)。そこでこの遅れて発症する病気(以下、後期EAE)は、NR4A2の関与するRR-MSとはまったく異なる病態を反映するのではないかと考えました。解析をすすめたところ、後期EAEマウスの中枢神経系(CNS)には、Th17細胞とは違うヘルパーT細胞が集まっていることが分かりました。このリンパ球は通常細胞障害性T細胞(CTL)が発現する転写因子Eomesodermin(エオメス, Eomes)を強く発現していました。
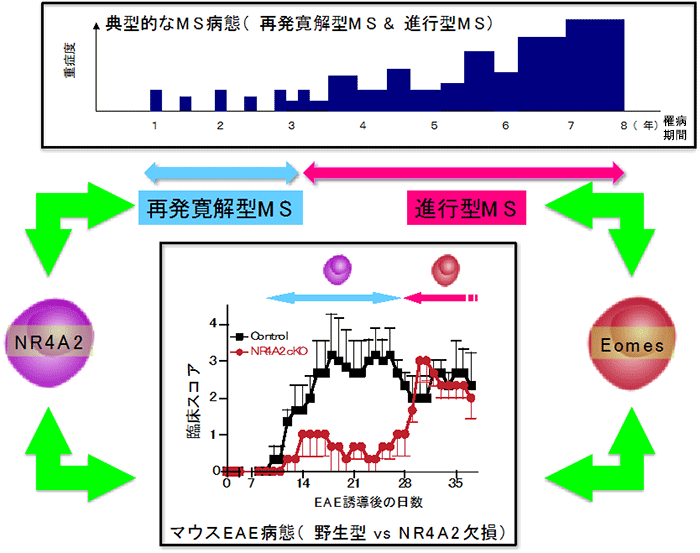 図3 MS病態の多様性と疾患モデルを用いた病態解明
図3 MS病態の多様性と疾患モデルを用いた病態解明
MS病態との関連をみるために、健常人、RR-MS患者、SP-MS患者の末梢血におけるEomes陽性ヘルパーT細胞の数を比較したところ、SP-MS患者で顕著に増加していました。SP-MS患者の脳脊髄液中では、Eomes陽性ヘルパーT細胞の頻度がさらに増えており、この細胞がSP-MSの病態できわめて重要な役割を果たしている可能性が示唆されました。
研究グループは、Eomes陽性ヘルパーT細胞がCTLと同様に細胞障害性プロテアーゼであるグランザイムBを放出することも確認しました。グランザイムBによる細胞が障害される機序は多様ですが、その一つとして神経細胞などが発現するPar-1分子を介した細胞障害が知られています。そこでPar-1阻害剤を投与すると後期EAEが有意に抑制されました。我々は脳脊髄液中に浸潤したEomes陽性ヘルパーT細胞が産生するグランザイムBと神経細胞の発現するPar-1が、SP-MSの治療標的になるのではないかと考えています(図4)。
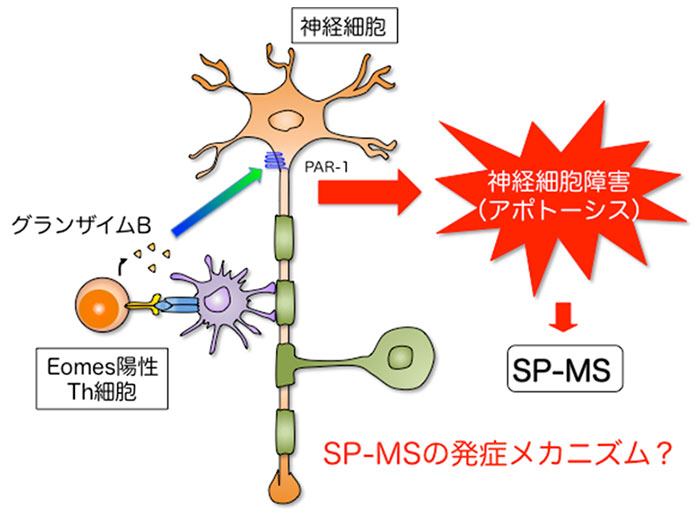 図4 二次進行型MSの発症機序(仮説)とEomes陽性ヘルパーT細胞
図4 二次進行型MSの発症機序(仮説)とEomes陽性ヘルパーT細胞
研究の意義と今後の展開
手つかずの二次進行型MSに対する新たな治療法開発への応用に期待
MSの経過には多様なバリエーションがありますが、大まかには多くの患者が発症時に呈するRR-MS、RR-MSから移行する進行性病態であるSP-MS、および、発症初期から進行型病態を呈する一次進行型MS(PP-MS)などに分類されます。今回、SP-MS病態を良く反映すると考えられる新規動物モデルを確立し、その病態形成に関わる細胞群の同定と病態形成機序の手がかりを得ることに成功しました。実験的なアプローチがはじめて可能になったと言え、これまで手つかずであったSP-MS病態の解明と、新規治療法の開発が飛躍的に進むことが期待されます。SP-MSによる歩行障害や認知機能障害の進行を止める治療薬が開発されれば、世界中で数10万人以上と想定されるSP-MS患者の症状の改善や進行予防に役立つことでしょう。
神経細胞障害をともなう進行性の中枢神経疾患の多くでは、T細胞を含む免疫細胞のCNSへの浸潤が普遍的に見られます。ところがこのような免疫細胞の集積は、持続的炎症に伴う非特異的な反応の結果とみなされることが多く、細胞の絶対数が極めて少ないことから、病態との関連は十分に検証できていません。今回同定した新型リンパ球(Eomes陽性ヘルパーT細胞)は強い病原性を示すため、ごく少数の細胞でも病態形成に関わる可能性が十分に考えられます。したがって、今後さまざまな神経変性疾患について一つ一つ調べていくことで、Eomes陽性ヘルパーT細胞が関与する新たな疾患が見つかり、治療の可能性が開けるかもしれません。
用語解説
- 注1)多発性硬化症(multiple sclerosis; MS):
- 中枢神経系の炎症性脱髄疾患であり、国内では約1万5000人、全世界では200万~300万人の患者が推定されている。神経軸索を保護的に覆う髄鞘内のミエリンタンパク質に対する自己免疫応答に起因する。大部分の患者が発症時に呈するRR-MS、RR-MSから移行する進行性病態であるSP-MS、および、再発寛解病態を経ずに進行型病態を呈する一次進行型MS(PP-MS)などの病型が知られている。RR-MSにはインターフェロンβをはじめとする疾患修飾薬が開発されているが、SP-MSをはじめとする進行型病態に対する治療法が確立していないことが問題になっている。
- 注2)実験的自己免疫性脳脊髄炎(experimental autoimmune encephalomyelitis; EAE):
- MSの治療法開発を目指した研究のために極めて有用な疾患動物モデルであり、既存のMS治療薬のほとんどはEAE病態の改善効果を示す。最も頻用される実験系においては、C57BL/6マウスにミエリン由来ペプチドMOG35-55を免疫して、ミエリン抗原反応性T細胞依存的な発症を誘導する。比較的短期(~30日)で実験が完了するため、疾患動物モデルとしては使いやすいといえるが、発症後長期にわたり持続する単相性の病態は必ずしもMS病態を反映しないため、病態モデルとしての意義に関する議論もある。マウスとペプチドの組み合わせを代えることで、再発寛解型MSに類似した病態を誘導することもできる。
- 注3)Th17細胞:
- 炎症性サイトカインであるIL-17産生性のヘルパーT細胞(Th細胞)サブセットを指す。実験的自己免疫性脳脊髄炎(EAE)の病態形成に関与することが報告され、自己免疫疾患との関連が注目を集めている。MS以外にも、関節リウマチ、炎症性腸疾患(クローン病、潰瘍性大腸炎)、乾癬の病態形成過程への関与が示されており、同細胞を標的とした自己免疫疾患の治療法開発が精力的に行われている。
- 注4)細胞障害性T細胞(Cytotoxic T lymphocyte; CTL):
- 細胞表面にCD8分子を発現するT細胞で、移植細胞、ウイルス感染細胞、癌細胞などを異物として認識し破壊する。刺激に伴ってグランザイム、パーフォリン、 腫瘍壊死因子などの細胞障害性タンパク質を放出したり、標的細胞のFasを介したアポトーシスに陥らせることで標的細胞を攻撃する。
原論文情報
- 論文名:
- “Eomesodermin-expressing T helper cells are essential for chronic neuroinflammation”
- 著 者:
- ベン・レイバニー、大木伸司、北條浩彦、中村雅一、佐藤和貴郎、村田美穂、山村 隆
- 掲載誌:
- Nature Communicationsオンライン版/2015.10.5
- DOI:
- 10.1038/NCOMMS9437
- URL:
- http://www.nature.com/naturecommunications
お問い合わせ先
研究に関するお問い合わせ
神経研究所 免疫研究部
大木伸司(室長)、 山村 隆(部長)
TEL:042-341-2711(代表) FAX:042-346-1753
E-mail:soki“at”ncnp.go.jp
※E-mailは上記アドレス“at”の部分を@に変えてください。
報道に関するお問い合わせ
国立研究開発法人国立精神・神経医療研究センター
総務課広報係
TEL:042-341-2711(代表)
事業に関するお問い合わせ
国立研究開発法人日本医療研究開発機構
戦略推進部 難病研究課
TEL:03-6870-2223
関連リンク
掲載日 平成27年10月5日
最終更新日 平成27年10月5日


