プレスリリース 神経伝達物質やインスリン分泌の新しい可視化法開発:分泌速度の謎を解明
プレスリリース
国立研究開発法人日本医療研究開発機構
発表者
高橋 倫子(東京大学大学院医学系研究科 附属疾患生命工学センター 構造生理学部門講師)
発表のポイント
- 神経伝達物質の放出はミリ秒の時間経過で起こるのに対し、インスリン分泌は遅い。この速度を何が決めているのか不明だった。
- 今回、開口放出を起こす複数の蛋白質(注1)の複合化を蛍光寿命測定法(注2)で調べたところ、神経終末ではそれらが既に複合した状態で刺激を待っているのに対して、インスリン分泌細胞では刺激後に初めて複合化が起きることがリアルタイムに可視化され、分泌速度の謎が解かれた。
- 本技術を用いると、シナプス前終末の活性領域(注3)を1ミクロン以下で画像化するので、シナプス結合や神経回路の機能的同定に応用することができる。
発表概要
東京大学医学系研究科 疾患生命工学センター 構造生理学部門の河西春郎教授と高橋倫子講師らの研究グループは、蛍光寿命画像法を用い、生きた細胞内で蛋白の複合化と局在を計測・可視化する実験系を組み上げた。そして、神経シナプスとインスリンを分泌する膵島で、SNARE蛋白質の複合化の様子を測定した。シナプスでは高度に複合化した状態で待機しており、この蛋白質のコンフォメーションの変化のみで神経伝達物質の放出が起きる。シナプス前終末の活性領域では複合化率が特に高く、蛍光寿命法は活性領域を解像した。一方、膵島ではSNARE蛋白質はほとんど複合化しておらず、刺激後に初めて開口放出部位で複合化する様子を捉えた。このように複合化に時間がかかるため、インスリンの開口放出は遅いと考えられた。本研究はインスリン分泌が細胞内代謝に強く依存することをよく説明するとともに、本研究で用いた革新的技術は、シナプス結合や神経回路の同定に新たな方法を拓くものである。
本研究は、日本医療研究開発機構(AMED)の「脳機能ネットワークの全容解明プロジェクト」(平成27年度に文部科学省より移管)、文部科学省の科学研究費、最先端・次世代研究開発プログラム、及び脳科学研究戦略推進プログラムの支援を受けて行ったもので、国際科学誌「Nature Communications(電子版)」に2015年10月6日付オンライン版で発表される。
発表内容
研究の背景
研究内容(具体的な手法など詳細)
東京大学医学系研究科 疾患生命工学センター 構造生理学部門の河西春郎教授と高橋倫子講師らの研究グループは、インスリンを分泌する膵島と大脳皮質神経細胞で、放出のエンジンに当たる蛋白質群(SNARE)の複合化をリアルタイムで計測するために、①組織内の微細構造の観察に適した2光子励起画像法 ②蛍光共鳴エネルギー移動(FRET)(注4)を起こしうる二種類の蛍光色素による蛋白の標識法 ③異なる分子間の複合化を定量する蛍光寿命画像法を組み合わせて、生きた細胞内で蛋白の複合化と局在を計測・可視化する実験系を組み上げた。
刺激後に細胞内の分泌小胞が細胞膜に融合する際には、分泌小胞側の膜に存在する蛋白質と、細胞内と外を境界する膜(細胞膜)に存在する蛋白質が接合し、非常にコンパクトな複合体を形成し、2つの膜の距離を限界まで接近させて、最終的には膜同士が融合し、内容物が細胞外に放出される。このような膜融合の際の中核的な役割を持つのがSNARE蛋白質であり、細胞膜側に局在するSNARE蛋白質はSNAP25と Syntaxin1の2種類、分泌小胞側に局在するSNARE分子はVAMP2(図1)である。これら3つの内の2つに対して、遺伝子工学的にFRETが起きる2種の蛍光色素で標識し、培養標本に遺伝子導入した(図2)。蛍光寿命画像を獲得し、結合関係を検討した結果、大脳皮質シナプス前終末では3種類のSNARE蛋白質が複合化した状態が多く見られることが判明した(図2A)。この状態はパラフォルムアルデヒド固定を行っても変わらず、免疫染色も可能となり、シナプスの活性領域で特に高い複合化が観察された。興味深いことに、軸索でも軽度の複合化が観察されたが、これは開口放出の結果生じる「cis-SNARE」(図1)を反映する。それに対して、神経終末や活性領域では、開口放出の準備状態である「trans-SNARE」が大量にあり、シナプス小胞はSNARE複合体を介して細胞膜に接着している状態であると判明した。このシナプス小胞を刺激すると、開口放出に伴いtrans-SNAREからcis-SNAREが形成され(図2B)、シナプスの開口放出はtransからcisへのSNARE複合体のコンフォメーションの変化だけで起きることが示唆された。さらに、海馬スライス標本でシナプス後部構造との関連を調べた結果、高いtrans-SNARE形成 はスパイン内に見出され、電子顕微鏡的な活性領域の位置と一致した(図2A)。活性領域では約25%のSNAREがtrans-SNAREを形成し、大きなスパインにできるシナプスほど活性領域が大きく、神経伝達が高頻度に起きた。このように、SNARE蛋白質の複合化は放出確率に関連した。
一方、内分泌組織である膵島のβ細胞の細胞膜ではSNARE蛋白質はほとんど複合化していなかった(図2C)。しかし、グルコースによる分泌刺激を与えると、分泌に先立ち分泌顆粒近傍でSNAREの複合化する様子が観察された(図2D)。本実験により、神経と内分泌細胞では細胞膜SNAREの初期状態に大きな差があることが初めて明らかになった。
神経伝達物質の放出は、刺激後ミリ秒単位で迅速に起きるのに対して、膵島からのホルモンの分泌は分単位で緩徐に起こる。このような放出速度の1万倍以上もの違いを説明する要因としてSNARE複合化の初期状態があることが示された。インスリン分泌の際には刺激前には小胞と細胞膜はSNAREで接着しておらず、刺激はなんらかの機構で、この会合を促進すると考えられた。その真のトリガー機構は神経とは必然的に異なり不明である。
社会的意義・今後の予定など
発表雑誌
- 雑誌名:
- ature Communications 6:8531.(10月6日オンライン版)
- 論文タイトル:
- Two-photon fluorescence lifetime imaging of primed SNARE complexes in presynaptic terminals and β cells
- 著者:
- Noriko Takahashi, Wakako Sawada, Jun Noguchi, Satoshi Watanabe, Hasan Ucar, Akiko Hayashi-Takagi, Sho Yagishita, Mitsuyo Ohno, Hiroshi Tokumaru & Haruo Kasai
- DOI番号:
- doi:10.1038/ncomms9531.
アブストラクトURL:http://www.nature.com/naturecommunications.
お問い合わせ先
研究に関するお問い合わせ
河西 春郎
東京大学大学院医学系研究科 附属疾患生命工学センター 構造生理学部門 教授
TEL:03-5841-1439 FAX:03-5841-1442
Email:hkasai“at”m.u-tokyo.ac.jp
高橋 倫子
東京大学大学院医学系研究科 附属疾患生命工学センター 構造生理学部門 講師
TEL:03-5841-1440 FAX:03-5841-1442
Email:norikomd“at”m.u-tokyo.ac.jp
AMEDの事業に関するお問い合わせ
日本医療研究開発機構 脳と心の研究課
TEL:03-6870-2222 FAX:03-6870-2244
E-mail:brain-pm“at”amed.go.jp
※E-mailは上記アドレス“at”の部分を@に変えてください。
用語解説
- (注1)SNARE蛋白質:
- 細胞内器官の間の膜融合を起こす原因となる蛋白質。神経や内分泌細胞の分泌小胞と細胞膜の場合には、図1に示すように、細胞膜側にSNAP25, Syntaxin1、小胞膜側にVAMP2があり、これらの蛋白質のSNAREモチーフが強く会合することで膜融合が起きる。
- (注2)蛍光寿命測定法:
- 2つの分子の複合化を見る方法のひとつ。それぞれの分子を蛍光共鳴エネルギー移動(注4)を起こす2つの色素蛋白質で標識し(図2ではmtqとVen)、エネルギー移動の供与側(青側)の蛍光の寿命をパルスレーザーで測定する。通常、蛍光分子はナノ秒(ns)の一定の時定数で減衰するが、2つの分子が結合していると共鳴エネルギー移動が起き寿命が短縮する。この解析から結合比を推定することができる。2光子顕微鏡はパルスレーザーを用いるので、自然に蛍光寿命測定ができ、また、レーザーを走査するので、蛍光寿命画像(結合比の画像)を取得することができる。
- (注3)活性領域(アクティブゾーン):
- シナプス後部に面するシナプス前終末の領域には、シナプス小胞やカルシウムチャネルが集積し、開口放出が起きやすくなっている領域が存在している。この領域を活性領域(アクティブゾーン、active zone)と呼ぶ。
- (注4)蛍光共鳴エネルギー移動(FRET):
- 2つの蛍光色素において、①1つの色素(供与体)の蛍光波長と他の色素(受容体)の励起波長が近く、②非常に近接(5nm以下)している場合には、供与体が蛍光を出すことなく、そのエネルギーが受容体に移動し、励起が起きる。これをFRET(Forster Resonant Energy Transfer)という。
添付資料:
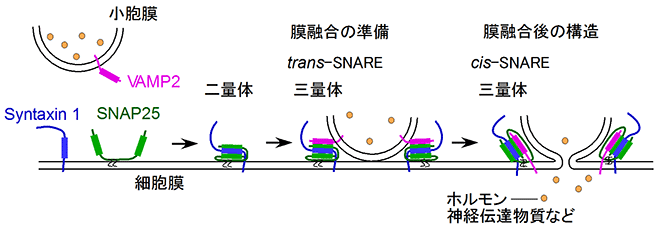
図1 膜融合の基本機構とSNARE蛋白質(SNAP25、Syntaxin1、VAMP2)
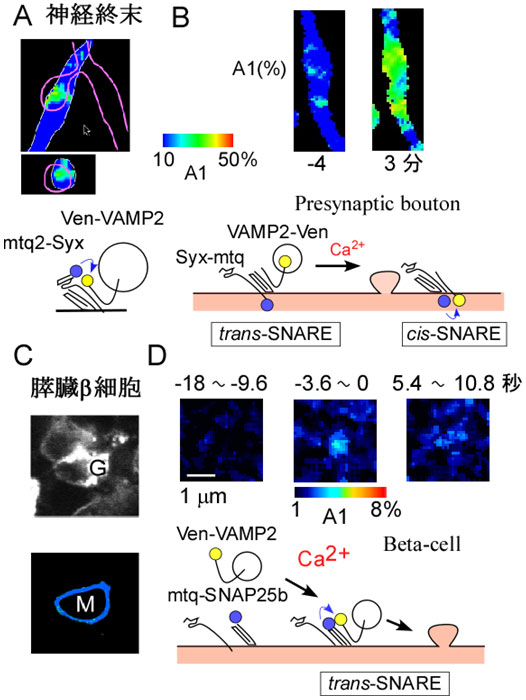
図2 2つの分泌様式の蛍光寿命法による可視化
神経終末ではSNARE蛋白質が複合化した状態で待っている(A)。赤はシナプス後部の細胞。特に、神経終末は樹状突起スパインに面した部分に活性領域を作っていることがわかる。刺激がくるとtrans-SNAREからcis-SNAREへのコンフォメーション変化により起きる(B)。β細胞では無刺激ではSNAREの会合がなく(C)、刺激が来て初めてSNAREの複合化が起きる(D)。
掲載日 平成27年10月6日
最終更新日 平成27年10月6日


