プレスリリース 認知症の治療薬開発に道拓く―長寿医療センターが理研、同志社大と共同で「神経細胞脱落」の抑制実験に成功―
プレスリリース
国立研究開発法人日本医療研究開発機構
国立研究開発法人国立長寿医療研究センター
国立研究開発法人国立長寿医療研究センター
要旨
国立長寿医療研究センター(鳥羽研二理事長 以下「長寿センター」という。)の添田義行脳科学推進プログラム研究員、高島明彦分子基盤研究部長らは、理化学研究所(以下、「理研」という。)と同志社大学、井原康夫教授グループとの共同研究で、アルツハイマー型認知症の原因となる「神経細胞脱落」を抑制する薬剤を発見した。
これまでの研究から神経細胞脱落は、タウ蛋白質が原因となって引き起こされると考えられてきたが、その相関は明確にはわかっていなかった。今回、モデルマウスを用いた実験によって、「タウ蛋白質の凝集」を阻害する薬剤が、神経細胞脱落の抑制にきわめて高い効果があることを突き止めた。
共同研究グループは、理研の天然化合物ライブラリーから、認知症の原因物質とされるタウ蛋白質が体内で凝集することを抑制する化合物をスクリーニングした。この凝集阻害剤のうち、ドーパミンやアドレナリンのようなカテコール核をもつ薬剤が、タウ蛋白質の凝集を阻害することを見出した。
具体的には、カテコール核を持つ化合物のうち、D/L―イソプロテレノール(徐脈や気管支喘息に用いられる医薬品)を、モデルマウスに3か月間経口投与したところ、タウ凝集の阻害と、それに伴う神経細胞脱落の抑制が観察された。さらに、神経活動の低下や異常行動の改善も示した。
この結果は、アルツハイマー型認知症に直接関与するタウ蛋白質を標的として、その凝集抑制のメカニズムを初めて明らかにした報告であり、認知症の治療薬開発に新たな道を切り開くものとして期待される。この実験結果は、12月16日のNature Communications誌に掲載される。
本研究は日本医療研究開発機構「脳科学研究戦略推進プログラム」の「精神・神経疾患の克服を目指す脳科学研究(課題F:脳老化研究チーム)」(平成27年度に文部科学省より移管)の一環として行なっています。 また、新学術領域研究(研究領域提案型)【脳タンパク質老化と認知症制御】からの補助を受け行われました。
これまでの研究から神経細胞脱落は、タウ蛋白質が原因となって引き起こされると考えられてきたが、その相関は明確にはわかっていなかった。今回、モデルマウスを用いた実験によって、「タウ蛋白質の凝集」を阻害する薬剤が、神経細胞脱落の抑制にきわめて高い効果があることを突き止めた。
共同研究グループは、理研の天然化合物ライブラリーから、認知症の原因物質とされるタウ蛋白質が体内で凝集することを抑制する化合物をスクリーニングした。この凝集阻害剤のうち、ドーパミンやアドレナリンのようなカテコール核をもつ薬剤が、タウ蛋白質の凝集を阻害することを見出した。
具体的には、カテコール核を持つ化合物のうち、D/L―イソプロテレノール(徐脈や気管支喘息に用いられる医薬品)を、モデルマウスに3か月間経口投与したところ、タウ凝集の阻害と、それに伴う神経細胞脱落の抑制が観察された。さらに、神経活動の低下や異常行動の改善も示した。
この結果は、アルツハイマー型認知症に直接関与するタウ蛋白質を標的として、その凝集抑制のメカニズムを初めて明らかにした報告であり、認知症の治療薬開発に新たな道を切り開くものとして期待される。この実験結果は、12月16日のNature Communications誌に掲載される。
本研究は日本医療研究開発機構「脳科学研究戦略推進プログラム」の「精神・神経疾患の克服を目指す脳科学研究(課題F:脳老化研究チーム)」(平成27年度に文部科学省より移管)の一環として行なっています。 また、新学術領域研究(研究領域提案型)【脳タンパク質老化と認知症制御】からの補助を受け行われました。
背景
アルツハイマー病研究では特徴的な病理像である老人斑と神経原線維変化の主要な構成成分であるβアミロイドとタウ蛋白質(図1)に病因が求められてきた。
家族性アルツハイマー病の研究からβアミロイドが原因であるとするβアミロイド仮説が発表され1990年代以降はβアミロイド研究に主眼が置かれた。βアミロイド抗体が動物モデルにおいて老人斑の除去と記憶学習能の改善が観られたことから、アルツハイマー病は克服されたかに思われたが、臨床試験で6年間の長期観察の結果、βアミロイド抗体投与により老人斑は除去されたが認知機能低下の進行を抑制出来ないことが2008年のLancet誌に報告された。その後もβアミロイド産生に関わる化合物が臨床試験に付されたがいずれも失敗に終わっている。
一方、これまでのタウ蛋白質の研究から神経原線維変化は嗅内野に最初に生じ、そこから大脳辺縁系、新皮質へと拡大すること(図2)、また、神経原線維変化が生じている領域では神経原線維変化の数の数倍の神経脱落が生じており、神経原線維変化数、神経脱落数、認知機能低下に相関があることが示されている(図3)。
タウ蛋白質の凝集過程を試験管内で再現すると、単量体のタウ蛋白質はその中にあるアミノ酸の一つであるシステイン残基を介して、オリゴマーという塊を形成する。ここにシステイン以外の領域での結合が加わると、顆粒状タウオリゴマーとなる。この顆粒状タウオリゴマーが結合して、タウの線維となることが研究グループによって明らかになっている。
このタウ線維が集まったものが神経原線維変化となる。顆粒状タウオリゴマーは神経原線維変化の前駆体であり、これはヒトの脳でも見出され、モデル動物の観察から神経細胞脱落に関与することが明らかになった。
そこで当研究グループでは、神経脱落を阻止することによって認知症の進行を防ぐことを目的として、顆粒状タウオリゴマーの形成を阻害する化合物のスクリーニングを行った。
家族性アルツハイマー病の研究からβアミロイドが原因であるとするβアミロイド仮説が発表され1990年代以降はβアミロイド研究に主眼が置かれた。βアミロイド抗体が動物モデルにおいて老人斑の除去と記憶学習能の改善が観られたことから、アルツハイマー病は克服されたかに思われたが、臨床試験で6年間の長期観察の結果、βアミロイド抗体投与により老人斑は除去されたが認知機能低下の進行を抑制出来ないことが2008年のLancet誌に報告された。その後もβアミロイド産生に関わる化合物が臨床試験に付されたがいずれも失敗に終わっている。
一方、これまでのタウ蛋白質の研究から神経原線維変化は嗅内野に最初に生じ、そこから大脳辺縁系、新皮質へと拡大すること(図2)、また、神経原線維変化が生じている領域では神経原線維変化の数の数倍の神経脱落が生じており、神経原線維変化数、神経脱落数、認知機能低下に相関があることが示されている(図3)。
タウ蛋白質の凝集過程を試験管内で再現すると、単量体のタウ蛋白質はその中にあるアミノ酸の一つであるシステイン残基を介して、オリゴマーという塊を形成する。ここにシステイン以外の領域での結合が加わると、顆粒状タウオリゴマーとなる。この顆粒状タウオリゴマーが結合して、タウの線維となることが研究グループによって明らかになっている。
このタウ線維が集まったものが神経原線維変化となる。顆粒状タウオリゴマーは神経原線維変化の前駆体であり、これはヒトの脳でも見出され、モデル動物の観察から神経細胞脱落に関与することが明らかになった。
そこで当研究グループでは、神経脱落を阻止することによって認知症の進行を防ぐことを目的として、顆粒状タウオリゴマーの形成を阻害する化合物のスクリーニングを行った。
研究手法と成果
顆粒状タウオリゴマーの形成を阻害するには、タウ蛋白質に結合する化合物を見出す必要があると考え、理研の長田裕之主任研究員が考案した天然化合物マイクロアレイを使用してスクリーニングを行った。
その結果、最終的に3種類の物質が顆粒状タウオリゴマーの形成を阻害する化合物として見出された。そのうち2つがカテコール核を持っており、カテコール核を持つ化合物(カテコール化合物)およびその酸化体を調べたところ、いずれもタウ蛋白質の凝集抑制効果を示した(図4)。
顆粒状タウオリゴマーの形成を抑制するメカニズムを明らかにするため、カテコール化合物とタウ蛋白質の結合部位を調べた。その結果、カテコール化合物の酸化体がオリゴマー形成に必要なシステイン残基のSH-基と共有結合することがわかった。さらに、カテコール化合物がシステイン残基に結合したタウ蛋白質は、タウオリゴマー形成能力が消失し、毒性を持つ顆粒状タウオリゴマーを形成しないことがわかった(図5)。
カテコール核を持つ化合物のうち、イソプロテレノール(徐脈や気管支喘息に用いられる医薬品)を選択し、タウ蛋白質を過剰に発現するマウスに3か月間投与した。その結果、投与量に依存してタウ蛋白質凝集量の低下が観察された。それに伴い、神経細胞脱落の抑制、脳機能の低下と行動異常の改善が観られた(図6)。
このモデルマウスを用いた研究結果から、タウ蛋白質のシステイン残基を標的とした化合物によって、認知症の進行を阻止することが可能であることがわかった。
その結果、最終的に3種類の物質が顆粒状タウオリゴマーの形成を阻害する化合物として見出された。そのうち2つがカテコール核を持っており、カテコール核を持つ化合物(カテコール化合物)およびその酸化体を調べたところ、いずれもタウ蛋白質の凝集抑制効果を示した(図4)。
顆粒状タウオリゴマーの形成を抑制するメカニズムを明らかにするため、カテコール化合物とタウ蛋白質の結合部位を調べた。その結果、カテコール化合物の酸化体がオリゴマー形成に必要なシステイン残基のSH-基と共有結合することがわかった。さらに、カテコール化合物がシステイン残基に結合したタウ蛋白質は、タウオリゴマー形成能力が消失し、毒性を持つ顆粒状タウオリゴマーを形成しないことがわかった(図5)。
カテコール核を持つ化合物のうち、イソプロテレノール(徐脈や気管支喘息に用いられる医薬品)を選択し、タウ蛋白質を過剰に発現するマウスに3か月間投与した。その結果、投与量に依存してタウ蛋白質凝集量の低下が観察された。それに伴い、神経細胞脱落の抑制、脳機能の低下と行動異常の改善が観られた(図6)。
このモデルマウスを用いた研究結果から、タウ蛋白質のシステイン残基を標的とした化合物によって、認知症の進行を阻止することが可能であることがわかった。
今後の期待
2013年12月にロンドンで開催されたG8 dementia summitでは、2025年までに認知症治療薬を開発することを目標とした宣言を行った (G8 dementia summit agreements)。
この研究成果は、これまでのβアミロイドを標的にした治療戦略とは異なり、神経脱落やタウ蛋白質の凝集を標的とし、その抑制のメカニズムを明らかにした初めての報告となる。モデル動物を用いた結果ではあるが、今後ヒトでの効果を確かめることによって、2025年までの認知症治療薬開発に大きく貢献すると考えられる。
原著論文情報
Toxic tau oligomer formation blocked by capping of cysteine residues with 1,2-dihydroxybenzene groups
Nature Communications (2015)
お問い合わせ先
リリースの内容に関するお問い合わせ
国立長寿医療研究センター 分子基盤研究部
TEL:0562-44-5651(Ex.6331) E-mail:kenneth“AT”ncgg.go.jp
TEL:0562-44-5651(Ex.6331) E-mail:kenneth“AT”ncgg.go.jp
報道に関するお問い合わせ
国立長寿医療研究センター 総務部総務課広報担当
TEL:0562-46-2311(代表) E-mail:terada-h“AT”ncgg.go.jp
〒474-8511 愛知県大府市森岡町7丁目430番地
※E-mailは上記アドレス“AT”の部分を@に変えてください
補足説明
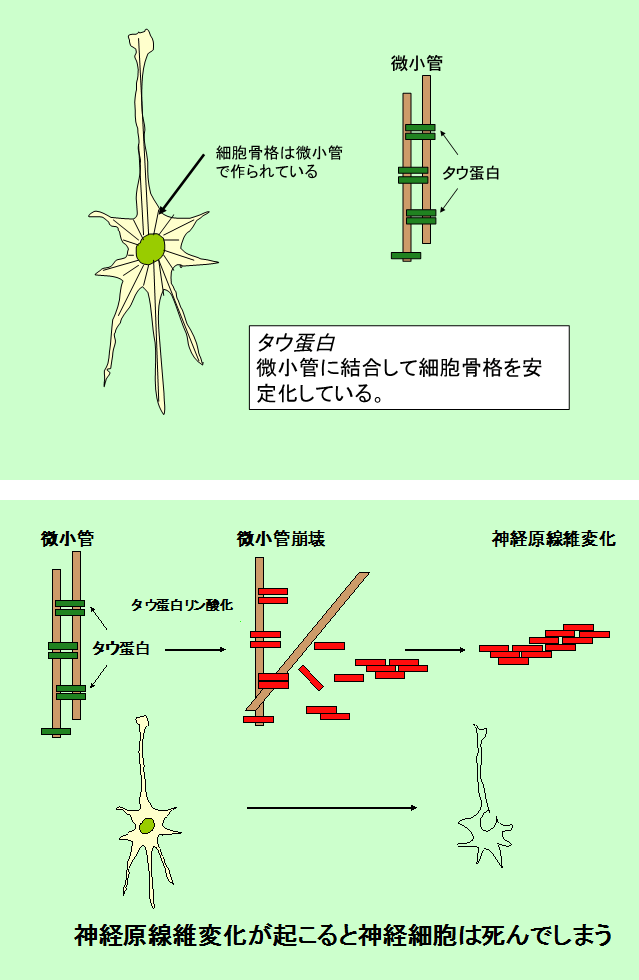
図1
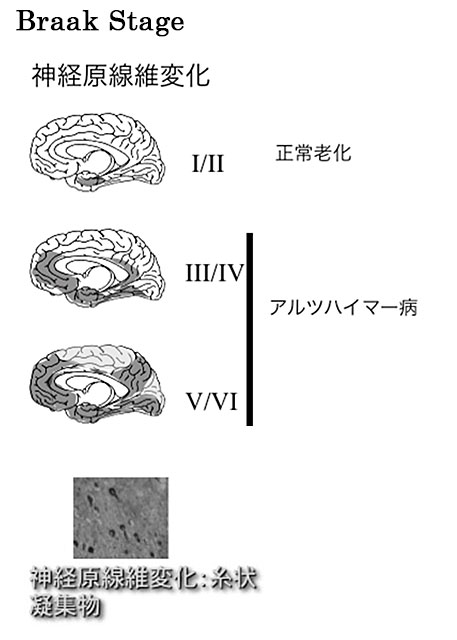
図2
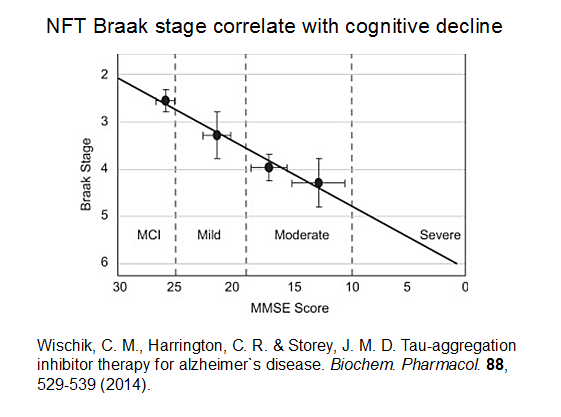
図3
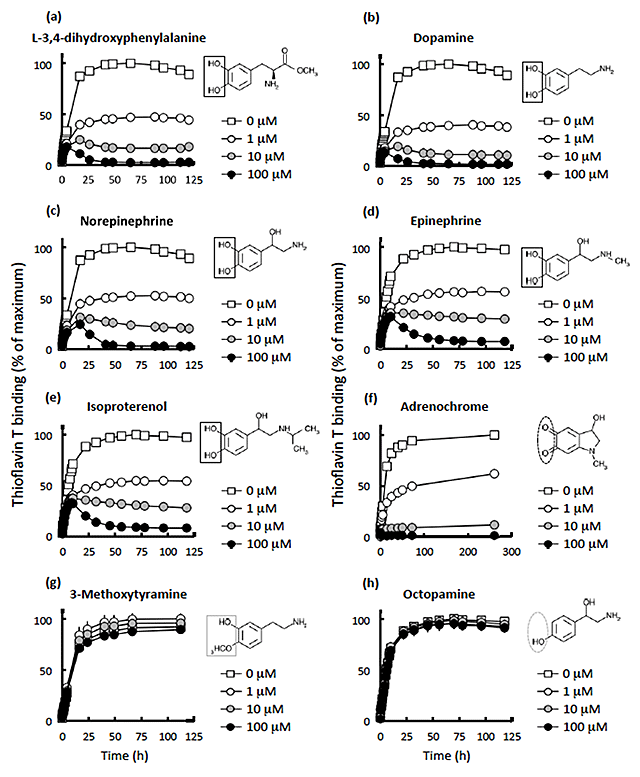
図4 カテコール核を持つ化合物またはその酸化体はタウ凝集を抑制する
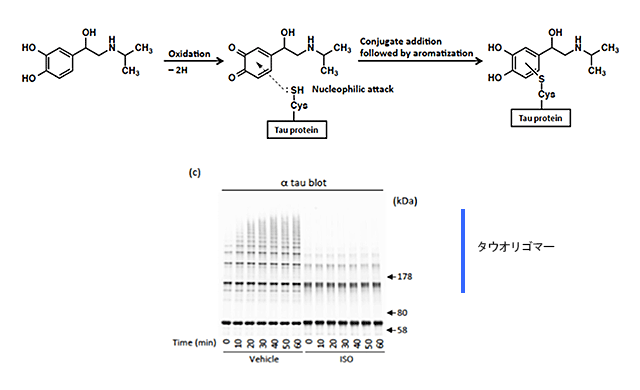 図5 カテコール核は酸化された後タウのCys残基のSH基と共有結合する。このように修飾されたタウはタウオリゴマーを形成出来ない。
図5 カテコール核は酸化された後タウのCys残基のSH基と共有結合する。このように修飾されたタウはタウオリゴマーを形成出来ない。
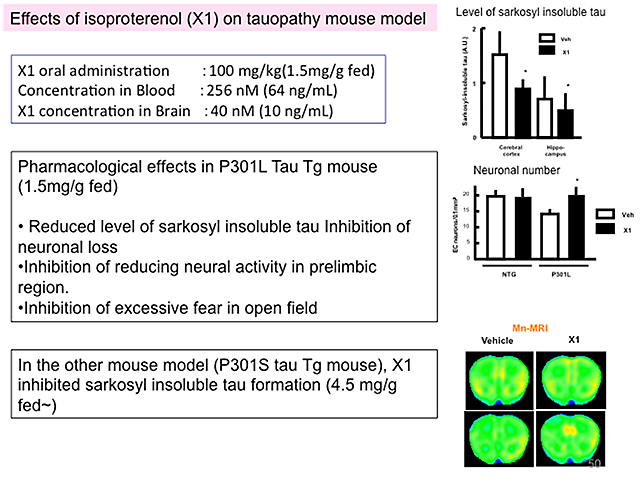
図6 モデルマウスへのイソプロテレノール3ヶ月間経口投与の効果
掲載日 平成27年12月16日
最終更新日 平成27年12月16日


