プレスリリース 粘膜の死細胞が腸炎、アトピー性皮膚炎、喘息の発症を促進する
プレスリリース
国立大学法人筑波大学
国立研究開発法人日本医療研究開発機構
研究成果のポイント
- 粘膜の死細胞が免疫細胞を直接刺激して、腸炎、アトピー性皮膚炎、喘息の発症を促進することを世界で初めて発見しました。
- 粘膜組織では多数の細胞が死んでおり、これらは単に便、垢、痰などに排泄されるだけというこれまでの固定観念を覆す発見です。
- 新しい発想の革新的な炎症性腸疾患、アレルギー治療法の開発が期待されます。
国立大学法人筑波大学医学医療系・生命領域学際研究センター 渋谷 彰教授、小田 ちぐさ助教らは、腸管、皮膚、気管などの粘膜の死細胞が、粘膜組織の免疫細胞を刺激して、炎症性腸疾患、アトピー性皮膚炎、喘息の発症を促進することを世界で初めて発見しました。
腸管、皮膚、気管などの粘膜は上皮細胞で覆われ、外界からの異物や病原体の侵入を防いでいます。粘膜では、毎秒100万個とも言われる数の上皮細胞が常に死に絶えていく一方、新しい上皮細胞が新生され、粘膜が維持されています。死んだ上皮細胞は、皮膚では垢、腸では便、気管では痰などとして排泄されていきますが、これまで、これらの死細胞には特に何の役割もないと考えられていました。
本研究では、皮膚、腸管、気管などの常在細菌が、粘膜組織の樹状細胞を刺激して、炎症を抑制する制御性T細胞という細胞の数を増加させること、およびそのメカニズムを発見しました。一方、常に死に絶えていく粘膜の上皮細胞は、樹状細胞の細胞膜上に発現するCD300aというタンパク分子を介して樹状細胞の活性化を抑制して制御性T細胞の数を減少させ、腸管、皮膚、気管などで腸炎、アトピー性皮膚炎、喘息の発症を促進させることを発見しました。これらの結果から、CD300aの働きを抑制する薬剤を開発することで、これらの難治疾患の革新的な治療につなげることが期待できます。
- 本研究成果は、英国時間の2016年2月8日午後4時(日本時間2月9日午前1時)付で英国科学誌「Nature Immunology」のオンライン速報版で公開されます。
- 本研究は国立研究開発法人日本医療研究開発機構(AMED)革新的先端研究開発支援事業ユニットタイプ(AMED-CREST)の研究開発領域「アレルギー疾患・自己免疫疾患などの発症機構と治療技術」(研究開発総括:菅村和夫)の一環で行われました。なお、本研究開発領域は、本年度4月の日本医療研究開発機構の発足に伴い、国立研究開発法人科学技術振興機構(JST)より移管されています。
研究の背景
腸管、皮膚、気管などの粘膜は上皮細胞で覆われ、外界からの異物や病原体の侵入を防いでいます。粘膜では、毎秒100万個とも言われる数の上皮細胞が常に死に絶えていく一方、新しい上皮細胞が新生され、粘膜が維持されています。死んだ上皮細胞は、皮膚では垢、腸では便、気管では痰などとして排泄されていきますが、これまで、これらの死細胞には特に何の役割もないと考えられてきました。
粘膜上皮細胞は、アポトーシス(別名、プログラム細胞死)と呼ばれる特徴的な死に方をします。一般にアポトーシスによって細胞が死ぬと、細胞膜を構成するフォスファチジルセリンというリン脂質が細胞表面に表出してくることが知られています。研究グループは、2003年に免疫細胞の細胞膜上に発現するCD300aという蛋白分子を世界に先駆けて発見しました(Yotsumoto et al, J Exp Med 2003)。2012年には、CD300aはフォスファチジルセリンと特異的に結合する蛋白分子であり、その結果、免疫細胞に信号を伝え、免疫細胞の活性化を抑制することを明らかにしました(Nakahashi-Oda et al, J Exp Med 2012)(図1) 。そこで、粘膜で常に生じている多数のアポトーシスを起こした上皮の死細胞は、単に排泄されるだけではなく、CD300aを介して免疫細胞と結合し、何らかの働きを持っているのではないかと推測しました。
研究内容と成果
本研究では、まず始めに、粘膜組織でCD300aを発現する免疫細胞を探しました。その結果、腸や気管では樹状細胞、皮膚ではランゲルハンス細胞と呼ばれる免疫細胞がCD300aを発現することがわかりました。さらに、これらの免疫細胞がアポトーシスで死んだ上皮細胞と接着していることを突き止めました(図2)。これらの結果から、予想した通り、粘膜上皮の死細胞は、CD300aを介して何らかの働きを有しているのではないかという可能性が強く示唆されました。
次に、粘膜上皮の死細胞が、CD300aを介して、どのような働きをもっているかを明らかにするために、CD300a遺伝子欠損マウスを解析しました。その結果、皮膚、腸管、気管などのいずれの粘膜組織においても、免疫反応を抑制する働きをもつ制御性T細胞が有意に増加していることがわかりました(図3)。さらに、野生型の(正常な)マウスに、フォスファチジルセリンと特異的に結合する蛋白質D89E MFG-E8注1)を腸への注入、皮膚への塗布、あるいは気管吸入することで、粘膜上皮の死細胞とCD300aを発現する免疫細胞との結合を遮断すると、それぞれの粘膜組織において、制御性T細胞が増加しました(図4)。これらの結果から、死細胞のフォスファチジルセリンとCD300aの結合がこれらの粘膜組織における制御性T細胞の数を制御していることが示されました。興味深いことに、無菌下で飼育した野生型マウスとCD300a遺伝子欠損マウスでは、ともに制御性T細胞の数が同じレベルまで顕著に減少しました(図3)。これらの結果は、粘膜に存在する常在細菌が制御性T細胞を増やす一方で、CD300aがこれを減少させていることを意味しています。
次に、CD300a遺伝子欠損マウスの粘膜組織で増加した制御性T細胞がどのような働きを持つかを検討しました。一般に、制御性T細胞は免疫細胞の活性化を抑制する機能を有します。そこで、免疫細胞の活性化により引き起こされる腸管、皮膚、気管などの粘膜での炎症病態である腸炎、アトピー性皮膚炎、喘息について解析しました。その結果、炎症性腸炎を誘導した野生型マウスでは20%以上の体重減少が見られたのに対し、CD300a遺伝子欠損マウスではおよそ5%程度しか見られず、有意に軽度の炎症病態を示しました(図5)。これらのマウスから制御性T細胞を除去すると、体重減少に違いが見られなくなり(図6)、CD300a遺伝子欠損マウスでの体重減少が軽度であったことは、制御性T細胞が増加していることがその原因と考えられました。同様に、アトピー性皮膚炎、喘息モデルを誘導すると、野生型マウスと比較し、CD300a遺伝子欠損マウスで、有意に軽度の病態を示しました(図7)。以上の結果から、粘膜上皮の死細胞が、CD300aを介して、腸、皮膚、気管などの粘膜組織の制御性T細胞の数を減少させ、腸炎、アトピー性皮膚炎、喘息を促進していることが明らかになりました(図8)。
今後の展開
炎症性腸疾患を代表とする潰瘍性大腸炎やクローン病の患者数は、この30年来、毎年右肩上がりに増加しており、2014年度には我が国でそれぞれ19万人、4万人の患者数を数えるまでになりました(難病医学研究財団・難病情報センター特定疾患医療受給者証交付件数より)。これらは腸粘膜の炎症による原因不明の疾患で、現時点では根治療法がない難病です。一方、アレルギー疾患を代表する喘息、アトピー性皮膚炎の患者数も、それぞれ人口の10%、5~10%と、近年増加の一途を辿っています。世界的にもおよそ25~30%の人がアレルギー疾患に罹患しているとされ、その克服は人類の健康・福祉にとってはもちろんのこと、社会的にも喫緊の課題です。
本研究により、粘膜の死細胞が、免疫細胞に発現するCD300aを介して制御性T細胞を減少させ、これらの難治疾患の発症を促進させることがわかりました。CD300aの働きを抑制するMFG-E8や抗体医薬などの薬剤を開発することで、これらの難治疾患の革新的な治療につなげることが期待できます。これらは、これまで全く知られていなかった新しい発想の炎症性腸疾患やアレルギー疾患の有用な治療法となりうるものと考えられます。
参考図

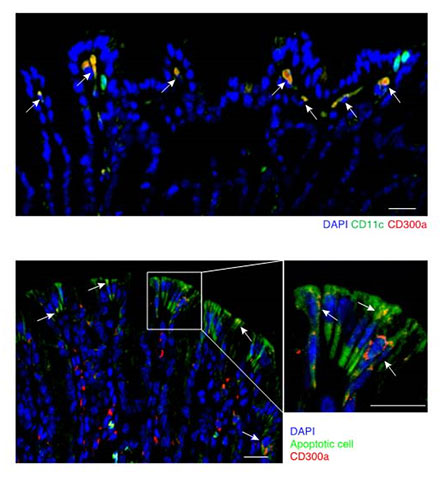
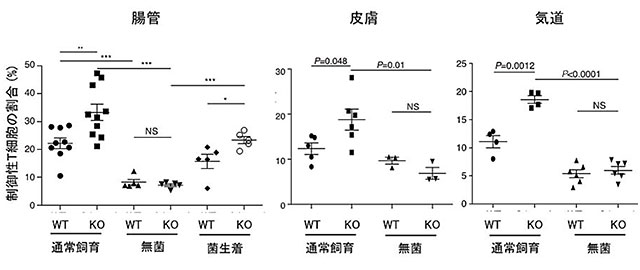
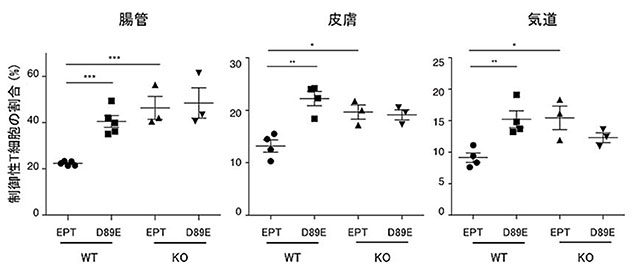
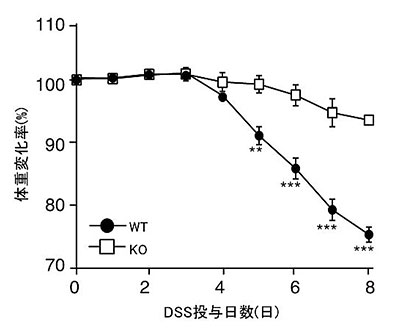
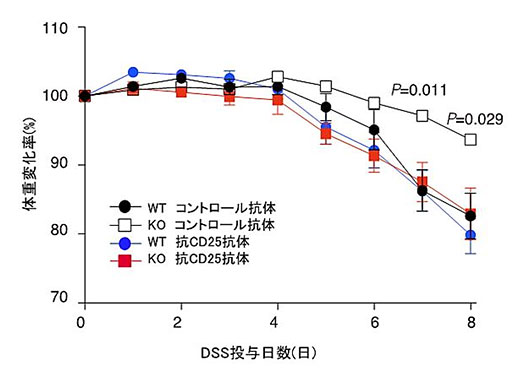
図6.野生型マウス(WT)とCD300a遺伝子欠損マウス(KO)にDextran Sulfate Sodium(DSS)を経口投与し、腸炎を惹起させるとともに、制御性T細胞を除去する抗CD25抗体、もしくはコントロール抗体を投与した。体重を測定し、最初の体重を100%としたときの体重減少率を観察した。コントロール抗体を投与したKOマウスでは体重減少がほとんど認められなかったが、抗CD25抗体を投与したKOマウスでは、WTマウスと同程度まで体重が減少した。このことは、CD300aが制御性T細胞を抑制していることが、腸炎による体重減少を増悪させていることを示唆した。
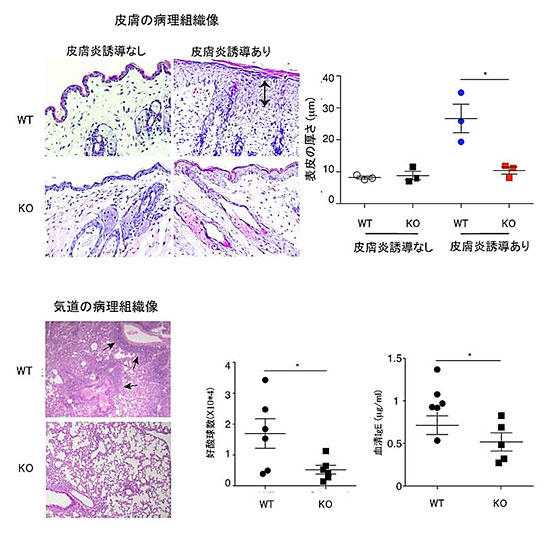
図7.CD300aはアトピー性皮膚炎、アレルギー性気道炎症を増悪させている。上図:野生型マウスとCD300a遺伝子欠損マウス(KO)にアトピー性皮膚炎を誘導し、病理組織像、表皮肥厚を解析した。KOマウスでは表皮の肥厚がほとんど認められず、アトピー性皮膚炎の症状が軽減していた。下図:WTマウスとKOマウスにアレルギー性気道炎症を誘導した。KOマウスでは、病理組織上細胞の浸潤が軽度であり、肺胞洗浄液中の好酸球数が減少し、血清IgE値が低下しており、アレルギー性気道炎症の軽減が認められた。
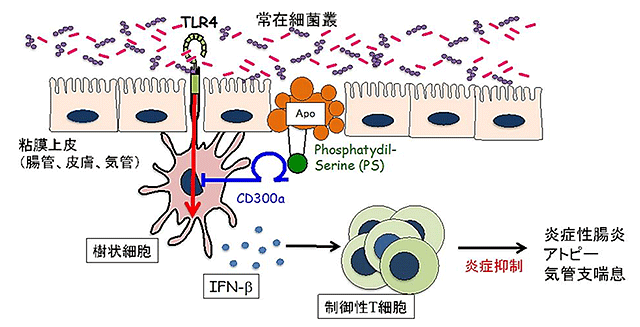
図8.粘膜死細胞が炎症性腸炎、アトピー性皮膚炎、喘息の発症を促進するメカニズム(概念図)
粘膜上皮細胞の直下にある樹状細胞は常在細菌からの刺激を受けてインターフェロンβを産生し、制御性T細胞の数を増加させる。一方、粘膜上皮の死細胞(Apo)は、CD300aを介して常在細菌からのシグナルを遮断し、インターフェロンβの産生を抑制し、制御性T細胞の割合を減少させることによって、炎症性腸炎、アトピー性皮膚炎、喘息の発症を促進する。
用語解説
- 注1)MFG-E8:
- 死細胞などを貪食する細胞マクロファージが分泌する因子。アポトーシス細胞(死細胞)のフォスファチジルセリンとマクロファージの接着分子に結合し、マクロファージによるアポトーシス細胞の貪食を促進する。D89E MFG-E8はMFG-E8の変異体でフォスファチジルセリンには結合するが、マクロファージの接着分子には結合できない。したがって、フォスファチジルセリンとCD300aとの結合を遮断する。 EPT MFG-E8はD89E MFG-E8のコントロール蛋白。
参考文献
- Yotsumoto, K. Okoshi, Y. Shibuya, K. Yamazaki, S. Tahara-Hanaoka, S. Honda, S. Osawa, M. Kuroiwa, A. Matsuda, Y. Tenen, D. G. Iwama, A. Nakauchi, H. Shibuya, A. Paired activating and inhibitory immunoglobulin-like receptors, MAIR-I and MAIR-II, regulate mast cell and macrophage activation. J Exp Med, 198(2):223-233, 2003
- Nakahashi-Oda C, Tahara-Hanaoka S, Shoji M, Okoshi Y, Nakano-Yokomizo T, Ohkohchi N, Yasui T, Kikutani H, Honda S, Shibuya K, Nagata S, Shibuya A. Apoptotic cells suppress mast cell inflammatory responses via the CD300a immunoreceptor. J Exp Med, 209(8):1493-1503, 2012
掲載論文
【題 名】“Apoptotic epithelial cells control Treg cell abundance at barrier surfaces.”
(粘膜上皮の死細胞が粘膜表面の制御性T細胞の数を調節する)
【著者名】Nakahashi-Oda C., Kankanam Gamage Sanath Udayanga, Nakamura, Y., Nakazawa, Y, Totsuka, N., Miki, H., Iino, S., Tahara-Hanaoka, S., Honda, S., Shibuya, K., Shibuya, A.
【掲載誌】Nature Immunology
doi.org/10.1038/ni.3345
お問い合わせ先
研究に関すること
研究者氏名 渋谷 彰(シブヤ アキラ)
筑波大学 医学医療系・生命領域学際研究センター 教授
住所:〒305-8575 茨城県つくば市天王台1−1−1
Tel:029-853-3281 Fax:029-853-3410
E-mail:ashibuya“AT”md.tsukuba.ac.jp
AMEDの事業に関すること
国立研究開発法人日本医療研究開発機構(AMED)
戦略推進部 研究企画課
Tel:03-6870-2224 Fax:03-6870-2243
E-mail:kenkyuk-ask“AT”amed.go.jp
※E-mailは上記アドレス“AT”の部分を@に変えてください。
最終更新日 平成28年2月9日


