プレスリリース 微弱な電気刺激が脳を活性化する仕組みを解明―ノルアドレナリンを介したアストロサイトの活動が鍵―
プレスリリース
国立大学法人埼玉大学
国立研究開発法人日本医療研究開発機構
要旨
理化学研究所(理研)脳科学総合研究センター神経グリア回路研究チームの毛内拡研究員、平瀬肇チームリーダーらの共同研究グループ※は、経頭蓋(けいとうがい)直流電気刺激がマウス脳機能に及ぼす影響とその作用メカニズムを明らかにしました。
「経頭蓋直流電気刺激法(tDCS)[1]」は、頭蓋骨の上から極めて微弱な直流電気を流して脳を刺激する方法で、ヒトではうつ症状の改善、運動機能障害のリハビリテーション、記憶力の向上などへの効果が知られています。しかし、その詳しい作用メカニズムは解明されていませんでした。これまでの動物実験の結果からは、tDCSがシナプス伝達[2]を増強することが、電気生理学的手法[3]を用いて断片的に報告されていました。
理研の神経グリア回路研究チームはこれまで、シナプス伝達の増強がグリア細胞の1種であるアストロサイト[4]のカルシウム活動によって引き起こされること注1)に注目してきました。アストロサイトは、神経細胞(ニューロン)とは異なり、電気的応答が微弱であるため、脳波記録などの電気生理学的手法ではその活動を捉えることは困難です。一方、アストロサイトは細胞内カルシウム濃度をダイナミックに変動させることが知られています。
そこで共同研究グループは、アストロサイトとニューロンの細胞内カルシウム動態をリアルタイムで観測できる遺伝子改変マウスを作製し、tDCS前後の大脳皮質のカルシウム動態を計測しました。その結果、tDCSによって大脳皮質におけるアストロサイトの細胞内カルシウム濃度が一過的に著しく上昇することを発見しました。さらに、tDCS後に視覚刺激などの感覚刺激に対するニューロンの応答が大きくなることから、シナプス伝達の増強が起こることを見出しました。一方、アストロサイトのカルシウム応答を抑制した遺伝子改変マウスでは、tDCSによる感覚刺激に対する応答は増強しませんでした。
次に薬理実験により、神経伝達物質の1種であるノルアドレナリンの受容体「α1アドレナリン受容体」が、tDCSによるアストロサイトのカルシウム応答に必須であることを見出しました。さらに、ノルアドレナリン作動性ニューロン[5]を神経毒により損失させると、アストロサイトのカルシウム応答も感覚刺激に対する応答の増強も起こりませんでした。これらの結果から、「tDCSによりノルアドレナリンが放出され、アストロサイトのカルシウム上昇を介してシナプス伝達の増強を起こしやすくなる」ことが明らかになりました。
本研究の結果から、うつ病などの精神疾患に対してのアストロサイトを標的とした創薬や治療法の開発が期待できます。また、tDCSの効果や安全性については、神経細胞だけではなくグリア細胞の研究も含めて議論することが必要と考えられます。
本研究は、文部科学省新学術領域研究「グリアアセンブリによる脳機能発現の制御と病態」および日本医療研究開発機構「革新的技術による脳機能ネットワークの全容解明プロジェクト」(平成27年度に文部科学省より移管)の一環として行われました。
成果は、国際科学雑誌『Nature Communications』(3月22日付)に掲載されます。
※共同研究グループ
- 理化学研究所 脳科学総合研究センター
-
神経グリア回路研究チーム
チームリーダー 平瀬 肇(ひらせ はじめ)
研究員 毛内 拡(もうない ひろむ)
研究員 田中 三佳(たなか みか)
研究員 大江 佑樹(おおえ ゆうき)
研究員 岩井 陽一 (いわい よういち)発生神経生物研究チーム
チームリーダー 御子柴 克彦(みこしば かつひこ)行動遺伝学技術開発チーム
チームリーダー 糸原 重美(いとはら しげよし) - 埼玉大学 理工学研究科 脳末梢科学研究センター
- 教授 中井 淳一(なかい じゅんいち)
准教授 大倉 正道(おおくら まさみち) - 群馬大学 医学系研究科 脳神経再生医学分野
- 教授 平井 宏和(ひらい ひろかず)
助教 今野 歩(こんの あゆむ)
背景
頭皮の上から微弱な直流電気を流し、頭蓋骨(とうがいこつ)を介して脳を刺激する「経頭蓋直流電気刺激法(tDCS)」が、ヒトではうつ病などの気分障害の改善に有効であることが知られています。また、脳卒中などによる運動機能障害を回復させることから、リハビリテーションへの応用が期待されています。さらに、学習や記憶力の向上などへの有効性も報告され、産業応用への期待が高まっています。しかし、その詳しい作用メカニズムは解明されていませんでした。一方で動物実験の結果からは、tDCSが大脳皮質の神経回路のシナプス伝達を増強することが電気生理学的手法を用いて断片的に報告されています。しかし、それに関与する細胞・分子基盤は分かっていませんでした。
グリア細胞の1種であるアストロサイトは、神経細胞 (ニューロン)とは異なり電気的応答が微弱であり、脳波記録などの電気生理学的手法ではその活動を捉えることは困難です。そのため、これまで神経回路内では単なる支持細胞(ニューロンの隙間を埋める細胞)と考えられてきました。ところが近年、アストロサイトが細胞内カルシウム濃度をダイナミックに変動させ、神経伝達に大きく作用し、シナプス伝達の増強を引き起こすということが分かってきました。
そこで共同研究グループは、tDCSによって生じるシナプス伝達の増強に、大脳皮質のアストロサイトのカルシウム応答が関与しているという仮説を立て、その検証に挑みました。
研究手法と成果
共同研究グループは、まず細胞内カルシウム濃度に応答して蛍光を発するタンパク質(G-CaMP7[6])を一部のニューロンとアストロサイトの両方に発現した遺伝子改変マウス「G7NG817マウス[7]」を作製しました。その結果、G7NG817マウスにおいては、大脳皮質における蛍光タンパク質の発現が非常に強いため、通常の蛍光実体顕微鏡下で、経頭蓋イメージングを行うことができることを見出しました(図1)。
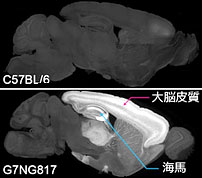 図1 マウス固定脳における蛍光の発現パターンの矢状面(左右に分ける面)の断面図
図1 マウス固定脳における蛍光の発現パターンの矢状面(左右に分ける面)の断面図
上: 比較用の野生型(C57BL/6)マウス脳。
下: 作製したG7NG817マウス脳。大脳皮質と海馬の一部に著しいG-CaMP7の発現がみられる。この強い発現のために、蛍光変化を頭蓋骨越しに測定することができる。
このことから、G7NG817マウスが「マクロレベルの脳機能マッピング」に有用であることを見出しました。まず、ヒゲ刺激を行った際には、刺激したヒゲ1本1本に対応する大脳皮質部位のカルシウム応答が得られました(図2A)。視覚刺激を与えた場合は、視覚皮質と呼ばれる部位の応答が得られる様子を100ミリ秒単位で可視化することができました(図2B)。次に、マウスの尾部に刺激(テールピンチ)を与えた際、これまでとは蛍光輝度や時間経過が全く異なる一過性の反応が起こることを発見しました(図2C上段)。この応答は、視覚刺激を与えた場合と比べて、蛍光輝度の変化率が約10倍大きく、また時間も20秒程度続く、ゆっくりとしたものでした。頭蓋骨に観察用の“窓”を作製し、二光子顕微鏡を用いてより詳しく観察した結果、テールピンチ刺激では、ニューロンの活性化に加えて、アストロサイトが著しく活性化していることを見出しました(図2C下段)。
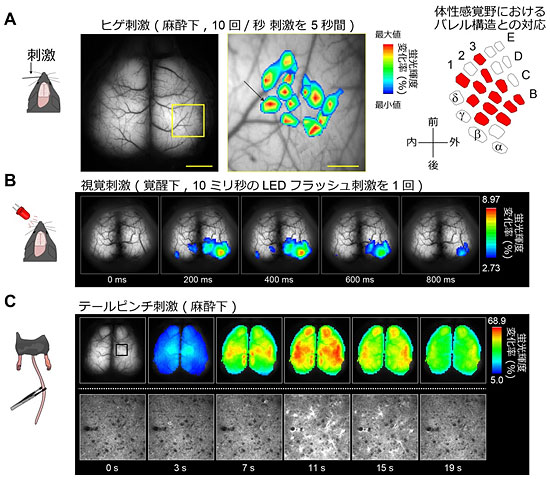 図2 G7NG81マウスの経頭蓋イメージングによる大脳皮質カルシウム動態の機能マッピング
図2 G7NG81マウスの経頭蓋イメージングによる大脳皮質カルシウム動態の機能マッピング
- 麻酔をかけた状態で、5秒間に50回ずつヒゲ1本1本を刺激した。そのときのバレル野(左画像の黄色枠内)におけるカルシウム応答の蛍光輝度の変化率を、疑似カラー表示し重ねて表示した(中央画像)。これは、右図に示す既知のバレル皮質のヒゲ-バレル野の対応と一致している。スケールバーは左画像が1mm、中央画像が 250マイクロメートル(μm、1μmは1000分の1mm)。
- 目が覚めている状態で、10ミリ秒の LEDフラッシュ刺激を左目に与えた。そのときの視覚皮質のカルシウム応答の蛍光輝度の変化率を疑似カラーで表示した。応答は、1秒以下という非常に短いものであった。
- 麻酔をかけた状態でのテールピンチ刺激に対する応答。上段は、経頭蓋イメージングによる結果。Bの視覚刺激と比較して約10倍程度蛍光輝度の変化率が大きく、時間も20秒間程度続く、ゆっくりしたものであった。下段は、体性感覚野(上段左端の黒色枠内)の一部において、二光子顕微鏡を用いた詳しい観察の結果(ただし、上段とは異なる個体)。上段と同様の時間経過をたどる白く明るい細胞は、「アストロサイト」であった。一視野の大きさは一辺が400μm程度。
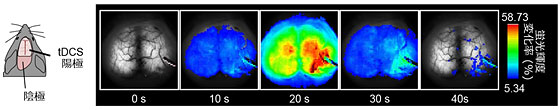 図3 G7NG817マウスの大脳皮質におけるtDCS中のカルシウム動態
図3 G7NG817マウスの大脳皮質におけるtDCS中のカルシウム動態
マウスの脳を頭蓋骨越しに上からみている。右脳の一部にtDCSの陽極を置き、陰極は首の筋肉に設置し、0.1mAで10分間tDCSを行った。電気刺激開始直後からゆっくりとした非常に明るいカルシウム応答が、左脳を含む大脳皮質全体にわたって起こった。これは一過性の応答で、電気刺激を与えている間だけ著しく増加した。
次に、共同研究グループは、tDCSがアストロサイトのカルシウム応答を引き起こす要因の1つとして神経伝達物質の1種であるノルアドレナリン[8]に着目し、薬理学的手法を用いてこれを検証しました。その結果、α1アドレナリン受容体(A1AR)の働きを阻害するプラゾシン[9]を投与した場合、tDCSによるアストロサイトのカルシウム応答が消失することが分かりました。
続いて、tDCSがシナプス伝達の変化にもたらす効果を調べるために、さまざまな感覚刺激によって誘発される脳波の応答の比較を行いました。その結果、tDCSを行なったマウスでは、60分間で脳波応答の大きさが平均約35%増大し、シナプス伝達が増強することが分かりました(図4右図)。そこで、このシナプス伝達の増強にアストロサイトの活性化が関与しているかどうかを検証するために、アストロサイトのカルシウム応答を消失させた遺伝子改変マウス(IP3R2 KO マウス[10])を用いた実験を行いました。すると、tDCS前後で脳波応答の増強が起こらないことが分かりました(図4)。さらに、ノルアドレナリン作動性ニューロンを神経毒DSP-4[11]により損失させると、脳波応答の増強が起こらないことが分かりました。
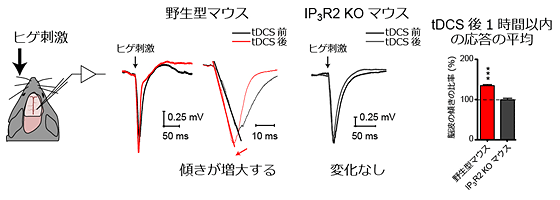 図4 tDCSによる感覚刺激に対する脳波応答の増強
図4 tDCSによる感覚刺激に対する脳波応答の増強
マウスにヒゲ刺激を与え、そのときの脳波応答を電気生理学的手法にて記録した。tDCS後、野生型マウスでは、tDCS前に比べて有意に脳波の傾きが増大した。一方、アストロサイトでのカルシウム応答を消失させたIP3R2 KOマウスでは、脳波の傾きに変化がなかった。脳波の傾きが増大することは、シナプス伝達が増強したことを意味する。
以上の結果から共同研究グループは、「tDCSによりノルアドレナリンが放出され、それがアストロサイトのα1アドレナリン受容体に作用することでアストロサイトの細胞内カルシウム濃度を上昇させ、その結果、シナプス伝達の増強を起こしやすくなる」という、tDCSの作用メカニズムの一端を明らかにしました (図5)。
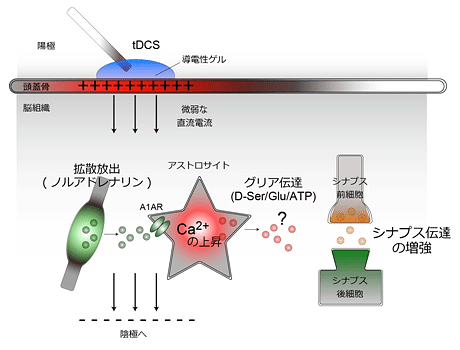 図5 tDCSがマウスのシナプス伝達の増強を起こすモデル
図5 tDCSがマウスのシナプス伝達の増強を起こすモデル
マウス脳への微弱な直流電流(tDCS)によってノルアドレナリンの放出が促進され、ノルアドレナリン受容体(A1AR)を介してアストロサイトを活性化する(カルシウム濃度が上昇する)。その結果、シナプス伝達が増強される。アストロサイトが何らかの伝達物質を放出(グリア伝達)して、シナプス機能を調節していることが想定される。
さらに、共同研究グループは、tDCSがストレス環境下で飼育したマウスのうつ様行動に作用して、「抗うつ効果」を示す可能性を見出しつつあります。それに対して、tDCSを行わなかったマウスや、アストロサイトのカルシウム応答を抑制したマウス、あらかじめα1アドレナリン受容体を阻害したマウス、ノルアドレナリン作動性ニューロンを損失させたマウスでは、tDCSを行っても抗うつ効果を示さない傾向にあることを見出しました。これらの結果は、ヒトで報告されているtDCSの作用に類似した効果がマウスでも起こり得ることを示しています。
今後の期待
これまで、tDCSの効果や安全基準にはグリア細胞の関与は考慮されてきませんでした。tDCSの効果や安全性については、神経細胞だけではなくグリア細胞の研究も含めて議論することが必要と考えられます。本研究を足掛かりに、tDCSがより安全で有効に臨床や産業分野で利用され、広く社会に貢献することが期待できます。
論文情報
- タイトル
- Calcium imaging reveals glial involvement in transcranial direct current stimulation-induced plasticity in mouse brain
- 著者名
- Hiromu Monai, Masamichi Ohkura, Mika Tanaka, Yuki Oe, Ayumu Konno, Hirokazu Hirai, Katsuhiko Mikoshiba, Shigeyoshi Itohara, Junichi Nakai, Youichi Iwai, and Hajime Hirase
- 雑誌
- Nature Communications
- DOI
- 10.1038/ncomms11100
補足説明
- [1]経頭蓋直流電気刺激(tDCS)
- 電極を用いて頭皮の上から1~2mA程度の微弱な直流電気を、約10~30分間通電する手法。その他に磁気刺激を用いる、経頭蓋磁気刺激(TMS)というのも知られている。tDCSは、transcranial direct-current stimulationの略。
- [2]シナプス伝達
- ニューロン間の接合部位であるシナプスにおける情報伝達のこと。情報を伝達する側のニューロンをシナプス前細胞、情報を受け取る側のニューロンをシナプス後細胞という。
- [3]電気生理学的手法
- ニューロンが活動時、電気的な信号を発生することを利用して、電極を用いて、ニューロンの集合的な電気応答や膜電位応答などを記録する手法。
- [4]アストロサイト
- 脳を構成するグリア細胞の1種。血管と直接の相互作用を持ち、ニューロンへのエネルギー供給や脳内環境の恒常性維持を担うことが知られている。
- [5]ノルアドレナリン作動性ニューロン
- 脳幹と呼ばれる、脳の奥部から大脳皮質に信号を伝えるニューロンのうち、ノルアドレナリンと呼ばれる神経伝達物質を放出し、信号伝達を行なうもの。
- [6]G-CaMP7
- 遺伝子工学的に開発されたカルシウムセンサータンパク質G-CaMP(2001年発表)の改良版で、2012年に発表された。
- [7]G7NG817マウス
- グルタミン酸トランスポーター1のプロモータ(遺伝子を発現させる機能を持つ塩基配列)の下流にG-CaMP7を発現した遺伝子改変マウスの系統の1つ。
- [8]ノルアドレナリン
- 神経伝達物質の1種で、注意や覚醒などに影響するさまざまな役割を持つ。本研究では、覚醒下動物のアストロサイトを興奮させる伝達物質として着目した。
- [9]プラゾシン
- アルファ1―アドレナリン受容体(A1AR)の選択的拮抗阻害薬の1種。高血圧の治療に用いられる。
- [10]IP3R2 KO マウス
- イノシトール三リン酸(IP3)の受容体のうち、アストロサイトに存在すると考えられているIP3受容体2型の発現を担う遺伝子を欠損(ノックアウト)したマウス。
- [11]DSP-4
- 人工的に合成された神経毒で、ノルアドレナリン作動性ニューロンに特異的に作用し、1週間程度で損失するといわれている。
お問い合わせ先
研究内容について(発表者)
理化学研究所 脳科学総合研究センター
神経グリア回路研究チーム
研究員 毛内 拡(もうない ひろむ)
チームリーダー 平瀬 肇(ひらせ はじめ)
TEL:048-462-6918(平瀬) FAX:048-467-9652
E-mail:hirase“AT”brain.riken.jp(平瀬)
広報について
理化学研究所 広報室 報道担当
TEL:048-467-9272 FAX:048-462-4715
E-mail:ex-press“AT”riken.jp
日本医療研究開発機構の事業について
日本医療研究開発機構 脳と心の研究課
TEL 03-6870-2222
E-mail: brain-pm“AT”amed.go.jp
※E-mailは上記アドレス“AT”の部分を@に変えてください。
最終更新日 平成28年3月22日


