AYA世代に多い白血病の原因を解明―革新的な治療法へ期待―
プレスリリース
国立研究開発法人日本医療研究開発機構
発表者
発表のポイント
- AYA世代(adolescence and young adult:思春期—若年成人、注1)の最も多いがんの一つであるB細胞性急性リンパ性白血病の原因は不明でしたが、今回の研究でAYA世代B細胞性急性リンパ性白血病(注2)の約65%について、その原因となるがん遺伝子を解明しました。
-
最も多く見られた原因遺伝子は、本研究で新たに発見された融合型がん遺伝子DUX4-IGH(注3)であり(全体の約16%)、DUX4-IGHが白血病の直接的な原因であることが証明されました。
-
DUX4-IGHの働きを抑制することにより革新的な治療法につながることが期待され、またDUX4-IGHを含む融合遺伝子群は新たな予後予測バイオマーカーとなります。
発表概要
AYA世代のがんの多くは原因が不明です。なかでもB細胞性急性リンパ性白血病(B-cell acute lymphoblastic leukemia: B-ALL)はAYA世代に最も頻度の高いがんの一種ですが、9割近くが原因不明なままでした。
東京大学大学院医学系研究科の間野博行教授らのグループは、AYA世代のB-ALL白血病細胞を次世代シーケンサーにより網羅的に解析することで、B-ALLの約65%の症例が何らかの融合型がん遺伝子を有することを発見しました。そのうち、最も多く(約16%)見られたのは全く新しいがん遺伝子DUX4-IGH融合遺伝子で、2番目に多いものはZNF384(注4)融合遺伝子、3番目に多いものは新規MEF2D(注5)融合遺伝子でした。
DUX4はこれまで発がんとの関わりは知られていなかった遺伝子ですが、AYA世代B-ALLにおいては、DUX4遺伝子の後ろ側が削れた上で免疫グロブリン遺伝子H鎖(以下、IGH、注6)座に挿入されて融合し(図1)、大量のDUX4-IGHの融合タンパクが産生されることが新たに明らかになりました(図2)。この融合タンパク質は強力な発がん能を獲得しており、DUX4-IGH融合タンパクをネズミのB細胞で産生させるとネズミは白血病を発症すること、またDUX4-IGHを持っているB-ALL細胞株でDUX4-IGHの発現を低下させると細胞死が誘導されることも確認されました。さらにDUX4-IGHあるいはZNF384融合型がん遺伝子を有する白血病は予後良好群(注7)に属し、MEF2D融合型がん遺伝子陽性の白血病は予後不良群(注7)に属することも明らかになりました。
本研究は、これまで発症原因が不明であったAYA世代白血病の多くの症例における原因を解明しただけでなく、その治療法・予後予測マーカーの提案へとつながる新たながん遺伝子を発見した画期的な成果です。この発見はAYA世代B-ALLに対する新しい分子標的治療法開発や、同疾患の予後予測診断法の速やかな実用化につながることが期待されます。
発表内容
AYA世代のがんは、これまであまり解析がなされておらず、その原因が殆ど不明です。治療法についても、小児がんの治療と成人がんの治療のどちらに準じて行うべきか未だ確立していません。AYA世代の代表的ながん種はB-ALLですが、9割以上においてがん遺伝子・発がん機構がわかっておらず、有効な分子標的療法も存在しません。小児B-ALLの多くがMLL融合遺伝子やTEL-AML1融合遺伝子が原因であることがわかっている一方、成人ALLはBCR-ABL1融合遺伝子が発がんの原因と考えられています。ところがAYA世代B-ALLは、これらがん遺伝子の頻度が低く、AYA世代B-ALLが単に小児ALLと成人ALLの集合体なのか、あるいはAYA世代B-ALLはその世代特有の発がん機構を有しているのかも不明なままでした。
東京大学大学院医学系研究科の間野博行教授らのグループはAYA世代のB-ALL患者73例の白血病細胞からメッセンジャーRNAを調整し、それを次世代シーケンサーにより網羅的に解析することで、融合遺伝子の探索を行いました。その結果、驚くべきことにB-ALLの約65%の症例が、何らかの融合型がん遺伝子を有することを発見しました。そのうち、最も多く見られたのは全く新しいがん遺伝子DUX4-IGH融合遺伝子で、2番目に多いものはZNF384融合遺伝子、3番目に多いものは新規MEF2D融合遺伝子でした。
DUX4は健常者の体細胞では発現していませんが、遺伝性疾患である顔面肩甲上腕型筋ジストロフィーにおいては高発現して細胞死を誘導し、筋細胞の減少によって筋ジストロフィー症状を示すことが従来から知られていました。しかし本解析の結果、AYA世代B-ALLにおいては、DUX4遺伝子が、後ろ側が削れた上でIGH座に挿入されて融合し(図1)、免疫グロブリン遺伝子転写調節領域の強力な作用によって大量のDUX4-IGHの融合タンパクが産生されることが新たに明らかになりました(図2)。この融合タンパクは筋ジストロフィーで見られた細胞死誘導能を失っており、代わりに強力な発がん能を獲得することが確認されました。DUX4-IGH融合タンパクをネズミのB細胞で発現させるとネズミは白血病を発症すること、またDUX4-IGHを持っているB-ALL細胞株でDUX4-IGHの発現を低下させると細胞死が誘導されることも新たに明らかになりました。これにより、DUX4-IGHはB-ALLの優れた治療標的であることが今回、証明されました。
AYA世代B-ALLに認められるZNF384融合遺伝子の多くは既知のEP300-ZNF384遺伝子でしたが、MEF2D遺伝子の融合パートナーは新規のBCL9とHNRNPUL1でした。EP300-ZNF384、MEF2D-BCL9、MEF2D-HNRNPUL1融合遺伝子のいずれもがん化能を獲得しており、DUX4-IGHと同様にネズミで白血病を発症させることがわかりました。興味深いことに、DUX4-IGHはAYA世代特異的に存在しており、小児B-ALLには極めてまれにしか存在せず、成人B-ALLでは検出できませんでした。同様にZNF384融合型がん遺伝子もAYA世代特異的な遺伝子融合でした。一方、MEF2D融合型がん遺伝子は小児期とAYA世代B-ALLに同じ頻度で見つかり、成人ALLには存在していませんでした。以上より、AYA世代B-ALLの多くは、AYA世代固有の発がんメカニズムで発症する白血病であることが初めて明らかにされました。
さらに患者の治療反応性を調べると、DUX4-IGHあるいはZNF384融合型がん遺伝子を有する白血病は予後良好群に属し、MEF2D融合型がん遺伝子陽性の白血病は予後不良群に属することも明らかになりました。
本研究は、これまで発症原因が不明であったAYA世代白血病の多くの症例における原因を解明しただけでなく、その治療法・予後予測マーカーの提案へとつながる新たながん遺伝子を発見した画期的な成果です。この発見はAYA世代B-ALLに対する新しい分子標的治療法開発や、同疾患の速やかな予後予測診断法の実用化につながることが期待されます。
本研究は間野博行・東京大学大学院医学系研究科教授が研究開発代表者を務める国立研究開発法人日本医療研究開発機構(AMED)の革新的先端研究開発支援事業(LEAP)と直江知樹・独立行政法人国立病院機構名古屋医療センター院長が研究開発代表者である、AMED次世代がん研究シーズ戦略的育成プログラム(P-DIRECT)の研究が連携して行ったものです。
発表雑誌
論文タイトル:Recurrent DUX4 fusions in B-cell acute lymphoblastic leukemia of adolescents and young adults
著者:Takahiko Yasuda, Shinobu Tsuzuki, Masahito Kawazu, Fumihiko Hayakawa, Shinya Kojima, Toshihide Ueno, Naoto Imoto, Shinji Kohsaka, Akiko Kunita, Koichiro Doi, Toru Sakura, Toshiaki Yujiri, Eisei Kondo, Katsumichi Fujimaki, Yasunori Ueda, Yasutaka Aoyama, Shigeki Ohtake, Junko Takita, Eirin Sai, Masafumi Taniwaki, Mineo Kurokawa, Shinichi Morishita, Masashi Fukayama, Hitoshi Kiyoi, Yasushi Miyazaki, Tomoki Naoe & Hiroyuki Mano*
お問い合わせ先
研究に関するお問い合わせ
分子細胞生物学専攻 細胞情報学分野
教授 間野 博行(マノ ヒロユキ)
〒113-0033 東京都文京区本郷7-3-1
Tel:03-5841-0633
E-mail:genome“AT”m.u-tokyo.ac.jp
報道に関するお問い合わせ
〒113-0033東京都文京区本郷7-3-1
Tel:03-5841-3304
E-mail:ishomu“AT”m.u-tokyo.ac.jp
日本医療研究開発機構 経営企画部 企画・広報グループ
〒100-0004 東京都千代田区大手町1-7-1
Tel:03-6870-2245
E-mail:contact“AT”amed.go.jp
事業に関するお問い合わせ
国立研究開発法人日本医療研究開発機構
戦略推進部医薬品研究課 革新的先端研究開発支援事業(インキュベートタイプ)担当
〒100-0004 東京都千代田区大手町1-7-1
Tel:03-6870-2219 Fax:03-6870-2244
E-mail:iyaku-leap“AT”amed.go.jp
国立研究開発法人日本医療研究開発機構
戦略推進部がん研究課 次世代がん研究シーズ戦略的育成プログラム(P-DIRECT)担当
〒100-0004 東京都千代田区大手町1-7-1
Tel:03-6870-2221 Fax:03-6870-2244
E-mail:cancer“AT”amed.go.jp
※E-mailは上記アドレス“AT”の部分を@に変えてください。
用語解説
- (注1)AYA
- adolescent and young adultの略。15才から39才までのことを言う(注:他の研究等では15才から29才の意味で使われることもある)。AYA世代のがんはこれまであまり解析がなされてこなかったこともあり、多くの種類のがんで発症機構が不明であり、治療法も、小児がん治療に準ずるべきなのか成人がん治療に準ずるべきなのかわかっていないことが多い。
- (注2)急性リンパ性白血病(acute lymphoblastic leukemia: ALL)
- Bリンパ球、Tリンパ球といったリンパ球(免疫能を担当する血液細胞。リンパ球にはBリンパ球とTリンパ球などの種類があり、うちBリンパ球は抗体を作る機能を有している)由来の白血病。小児ALLの約9割が長期寛解を得るのに比し、成人ALLは2割前後と予後不良。AYA世代ALLの予後はその中間となる。
- (注3)DUX4
- Double homeobox 4の略。DUX4遺伝子はD4Z4と呼ばれる繰り返し配列の中に存在しており、ヒト染色体4番と10番の長腕テロメア付近に11-150コピーのD4Z4/DUX4があることが知られている。正常な体細胞での発現がないため、以前は偽遺伝子(機能していない遺伝子)だと考えられていた。DUX4遺伝子が産生するタンパクは転写因子として働くと予想され、細胞死を誘導する。
- (注4)ZNF384
- Zinc finger protein 384の略。転写因子をコードする。TAF15、E2A、EP300などと融合してがん遺伝子となることが知られている。
- (注5)MEF2D
- MADS box transcription enhancer factor 2 polypeptide Dの略。転写因子をコードし、神経細胞の生存に重要な機能を持つ。DAZAP1、CSF1Rなどと融合してがん遺伝子となることが知られている。
- (注6)免疫グロブリン遺伝子H鎖
- 免疫グロブリン遺伝子は、免疫に重要な役割をもつ抗体の遺伝子。抗体はそれぞれ2つずつのL(light)鎖とH(heavy)鎖からなる多量体であるが、そのH鎖遺伝子はヒト染色体14番上に存在する。抗体はBリンパ球で産生されるため、IGHの転写調節領域(mRNA産生量を規定するプロモーター、エンハンサーと呼ばれる領域)は、Bリンパ球で活性化されている。
- (注7)予後不良群・予後良好群
- 化学療法に治療抵抗性、あるいは化学療法後に再発するなどして、生存期間が短い患者群を予後不良群と言い、予後良好群はその反対で、長期生存が期待できる患者群を指す。最初から予後不良群に属することがわかれば、骨髄移植など副作用が強いが完治が期待できる治療法を選択することも可能となる。
添付資料
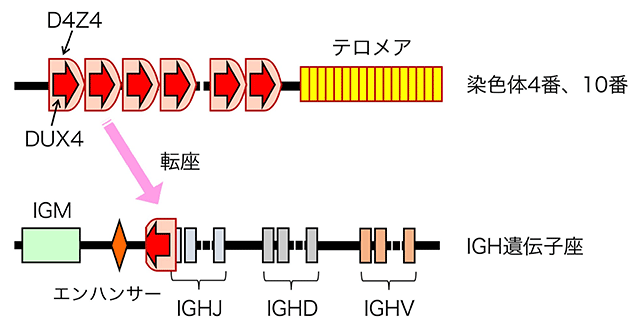
図1 B-ALLで発見されたDUX4転座
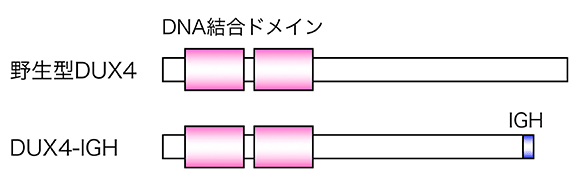
図2 DUX4-IGH融合タンパク質
掲載日 平成28年3月29日
最終更新日 平成28年3月29日


