免疫細胞が敗血症の発症を促進する“常識”を覆す新発見
プレスリリース
国立大学法人筑波大学
国立研究開発法人日本医療研究開発機構
研究成果のポイント
- 細菌感染の防御役として知られてきた辺縁帯B細胞が、敗血症ではその病態を悪化させることを世界で初めて発見しました。
- 辺縁帯B細胞から産生されるインターロイキン6が敗血症の発症を促進する因子であることを発見しました。
- インターロイキン6の働きを阻害する抗体を投与することによって、敗血症による死亡率が顕著に改善しました。今後、敗血症治療への応用が期待されます。
国立大学法人筑波大学医学医療系・生命領域学際研究センター 渋谷彰教授、本多伸一郎研究員らは、東京大学医科学研究所 三宅健介教授と共同で、敗血症の発症を促進する新しい免疫細胞を世界で初めて発見しました。
敗血症は、細菌による感染を発端として、細菌が産生する毒素が全身に広がり、多臓器不全、血圧低下、ショックなどの症状を引き起こす重篤な全身疾患です。腹膜炎や肺炎、術後感染などを原因とする敗血症の発症数は世界的に増えつつあり、その死亡率は非常に高く、新たな治療法が望まれる重要な疾患です。
辺縁帯B細胞は、脾臓の辺縁帯(注1)に存在する特殊なB細胞(注2)であり、これまで抗体を産生することによって、血液中 に侵入した細菌からの感染防御に働く細胞として知られていました。本研究では、そうした常識とは反対に、敗血症においては、辺縁帯B細胞がその発症を促進させる細胞であることを発見しました。さらにはその際、辺縁帯B細胞から産生されるインターロイキン6(IL-6)(注3)が、敗血症の発症を促進する因子であることを発見しました。そこで、IL-6の働きを阻害する抗体を投与したところ、敗血症による死亡率を顕著に減少させることに成功しました。今後、ヒトの敗血症の治療への応用が期待されます。
*本研究成果は、英国時間の2016年5月5日午前10時(日本時間5月5日午後5時)付で英国科学誌「Nature Communications」にオンライン公開されました。
*本研究は国立研究開発法人日本医療研究開発機構(AMED)革新的先端研究開発支援事業ユニットタイプ(AMED-CREST)の研究開発領域「アレルギー疾患・自己免疫疾患などの発症機構と治療技術」(研究開発総括:菅村和夫)における研究開発課題「ヒト肥満細胞活性化制御技術の開発によるアレルギー疾患の克服」(研究代表者:渋谷 彰)の一環で行われました。なお、本研究開発領域は、平成27年4月の日本医療研究開発機構の発足に伴い、国立研究開発法人科学技術振興機構(JST)より移管されています。
研究の背景
敗血症は、細菌による感染を発端として、細菌が産生する毒素が全身に広がり、多臓器不全、血圧低下、ショックなどの症状を引き起こす重篤な全身疾患です。特に大腸菌を代表とするグラム陰性菌の成分であるリポ多糖(LPS)(注4)は、敗血症性ショックを引き起こす原因となっています。腹膜炎や肺炎、術後感染などから敗血症の発症数は世界的に増えつつあります。日本では、正確な患者数の統計はありませんが、米国では毎年およそ100万人の患者が発症し、その20~30%が死亡しています。集中治療が必要な患者の死因としては最多の疾患で、新たな治療法の確立が待たれています。
一方、辺縁帯B細胞は、脾臓の辺縁帯に存在し、脾臓の全免疫細胞中のおよそ2~3%にあたる、ごく少数の特殊なB細胞です。この細胞は、これまで抗体を産生することによって、血液中に侵入した細菌の感染防御に働く細胞として知られていましたが、そのほかの機能については知られておらず、謎の部分が多く残されていました。
研究内容と成果
本研究では、辺縁帯B細胞が生体内で果たしている機能を明らかにするために、辺縁帯B細胞のみを欠損したマウスを作製しました。初めに、大腸菌を血管内に投与し、大腸菌の感染に対する辺縁帯B細胞の働きを解析しました。辺縁帯B細胞は抗体を産生することから、辺縁帯B細胞を欠損したマウスでは、その生存率が低下すると予想しました。しかし、その予想に反して、対照とした正常マウスでは、大腸菌投与36時間後で7匹のマウスが全て死亡したのに対し、辺縁帯B細胞を欠損したマウスでは、半数以上(4/7=57%)が生存しました(図1)。また、大腸菌投与12時間後の直腸温は、対照マウスでは26℃で顕著な低体温を示し、ショック状態に陥ったのに対し、辺縁帯B細胞を欠損したマウスでは、体温が比較的保たれていました(図1)。これらの結果から、辺縁帯B細胞は大腸菌感染に対し、生体防御に働くのではなく、むしろ感染症を増悪させることがわかりました。
大腸菌投与により、顕著な体温低下が生じたことから、大腸菌の成分であるLPSが敗血症性ショックを引き起こしていることが考えられました。そこで次に、LPSを血管内に直接投与し、生存率を解析しました。LPS投与48時間後には、対照とする正常マウスでは16匹中1匹(6%)しか生存していなかったのに対して、辺縁帯B細胞を欠損するマウスでは16匹中9匹(56%)が生存していました(図2)。また、LPSを投与後12時間後の肝機能(AST)を測定したところ、対照マウスと比べて、辺縁帯B細胞を欠損するマウスでは肝機能障害が有意に軽度でした(図2)。
これらの結果から、辺縁帯B細胞は、敗血症の病態を促進していることがわかりました。
次に、辺縁帯B細胞がどのように敗血症病態を誘導するかを明らかにするために、LPSを投与したマウスの脾臓から継時的に辺縁帯B細胞を分離し、炎症性サイトカイン(注3)の産生を解析しました。対照として、炎症性サイトカインを多量に産生することが知られているマクロファージも解析し、比較しました。その結果、LPS投与1時間後では、代表的な炎症性サイトカインであるIL-6やTNF-α(注3)はマクロファージから多量に産生されているのに対し、辺縁帯B細胞からは、ごくわずかしか産生されませんでした(図3)。しかし、LPS投与4時間後では、辺縁帯B細胞はマクロファージと比べて、IL-6をより多く産生しました(図3)。これらの結果から、辺縁帯B細胞が敗血症を増悪させる因子は、辺縁帯B細胞が産生するIL-6である可能性が示唆されました。
そこでこのことを確認するために、辺縁帯B細胞でのみIL-6の産生を欠損するマウスを作製し、このマウスにLPSを投与し、生存率を解析しました。その結果、対照とした正常マウスでは、LPS投与48時間後に14匹中3匹(21%)しか生存していなかったのに対し、辺縁帯B細胞でのみIL-6の産生を欠損するマウスでは、13匹中9匹(69%)が生存していました(図4)。また、この際の肝機能(ALT)は、対照マウスと比較し、辺縁帯B細胞でのみIL-6の産生を欠損するマウスで、有意に軽度でした。これらの結果から、辺縁帯B細胞から産生されるIL-6が、敗血症の病態を悪化させることが明らかとなりました。
そこで、IL-6の働きを抑制できれば、敗血症の治療が可能になるのではないかと考え、LPSを投与して敗血症を誘導したマウスに、LPS投与4時間後に、IL-6受容体を阻害する抗体を投与しました。その結果、対照とする抗体を投与したマウスでは、LPS投与96時間後で9匹のマウスすべてが死亡したのに対し、IL-6受容体を阻害する抗体を投与したマウスは12匹中9匹(75%)が生存していました(図5)。これらの結果から、IL-6受容体を阻害する抗体が、敗血症の治療に有効であることが示唆されました。
まとめと今後の展開
参考図
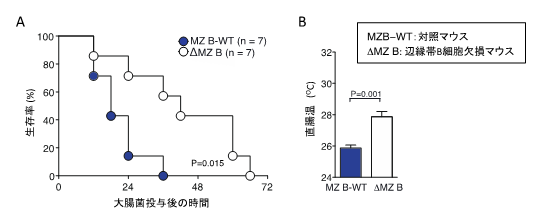 図1. 辺縁帯B細胞を欠損するマウスは、大腸菌による敗血症による生存率が高い。
図1. 辺縁帯B細胞を欠損するマウスは、大腸菌による敗血症による生存率が高い。
(B)上記において、大腸菌を投与後12時間後の直腸温を測定した。対照マウスと比べて、辺縁帯B細胞を欠損するマウスでは直腸温が比較的保たれていた。
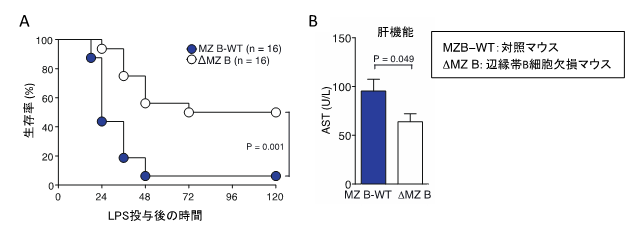 図2.辺縁帯B細胞を欠損するマウスは、LPSで誘導された敗血症による生存率が高い。
図2.辺縁帯B細胞を欠損するマウスは、LPSで誘導された敗血症による生存率が高い。
(B)上記において、リポ多糖(LPS)を投与後12時間後の肝機能(AST)を測定した。対照マウスに比較し、辺縁帯B細胞を欠損するマウスで有意に肝機能障害は軽度であった。
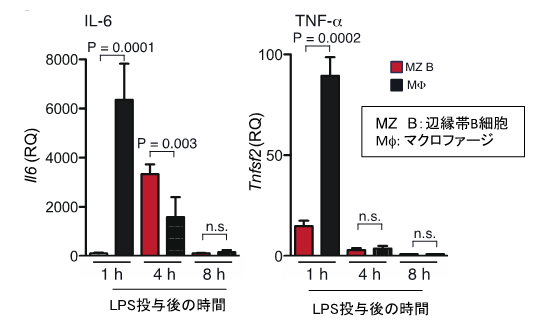 図3.辺縁帯B細胞はIL-6を産生する。
図3.辺縁帯B細胞はIL-6を産生する。
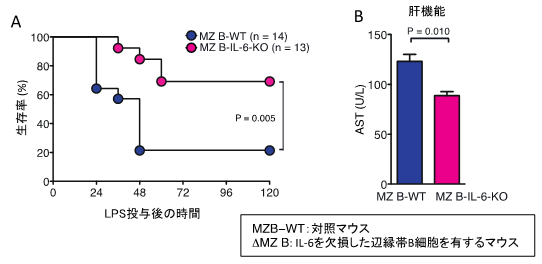 図4.辺縁帯B細胞から産生されるIL-6が、敗血症の病態を悪化させる。
図4.辺縁帯B細胞から産生されるIL-6が、敗血症の病態を悪化させる。
(B)上記において、リポ多糖(LPS)を投与後12時間後の肝機能(AST)を測定した。対照マウスに比較し、辺縁帯B細胞でのみIL-6の産生を欠損するマウスで有意に肝機能障害は軽度であった。
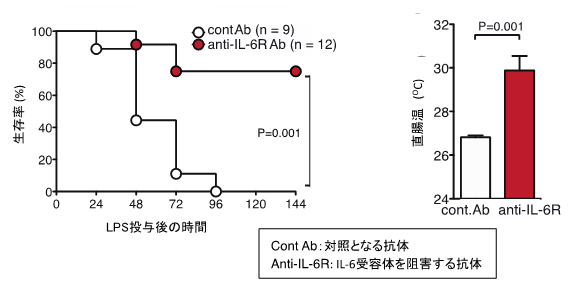 図5.IL-6受容体を阻害する抗体が、敗血症の治療に有効である。
図5.IL-6受容体を阻害する抗体が、敗血症の治療に有効である。
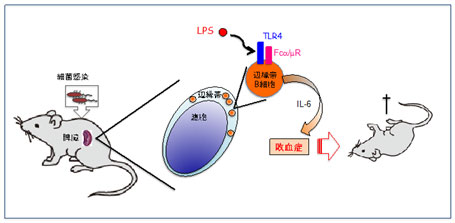
図6.まとめ
イメージ図を示す。感染した細菌が血液循環中に入ると、脾臓にある辺縁帯B細胞は細菌由来のLPSと結合し、IL-6を産生する。IL-6は敗血症を誘導してショックなどの重篤な病態になり、死亡する。
用語解説
- (注1)脾臓の辺縁帯:
- 脾臓と他の組織との境界領域で、脾臓へ出入りする血管が多く存在する部分。ここには、辺縁帯B細胞や他の免疫細胞が停留し、脾臓組織への侵入口となっている。
- (注2)B細胞:
- T細胞と並んで重要なリンパ球の一種。通常、抗体を産生し、感染を防ぐ。
- (注3)炎症性サイトカイン、インターロイキン6(IL-6)、TNF-α:
- 免疫細胞から産生されるたんぱく質で、炎症反応を亢進させる。代表的なものにIL-6やTNF-αがある。IL-6やTNF-αの働きを阻害する抗体は、現在、生物製剤としてリウマチなどの治療に使われている。
- (注4)リポ多糖(LPS):
- 大腸菌などを代表とする細菌の細胞壁の構成成分で、脂質、多糖からなる。免疫を活性化する働きを持つが、過剰になるとショック状態を引き起こす。
掲載論文
- 【題名】
- Marginal zone B cells exacerbate endotoxic shock via interleukin-6 secretion induced by Fcα/μR-coupled TLR4 signaling
(辺縁帯B細胞はFcα/μ受容体に結合したTLR4により誘導されるインターロイキン6を介して敗血症を増悪する) - 【著者名】
- Shin-ichiro Honda, Kazuki Sato, Naoya Totsuka, Satoshi Fujiyama, Manabu Fujimoto, Kensuke Miyake, Chigusa Nakahashi-Oda, Satoko Tahara-Hanaoka, Kazuko Shibuya, and Akira Shibuya.
- 【掲載誌】
- Nature Communications DOI: 10.1038/ncomms11498
お問い合わせ先
研究に関すること
研究者氏名 渋谷 彰(シブヤ アキラ)
筑波大学 医学医療系・生命領域学際研究センター 教授
〒305-8575 茨城県つくば市天王台1−1−1
Tel:029-853-3281 Fax:029-853-3410
E-mail:ashibuya“AT”md.tsukuba.ac.jp
AMEDの事業に関すること
国立研究開発法人日本医療研究開発機構(AMED) 戦略推進部 研究企画課
Tel:03-6870-2224 Fax:03-6870-2243
E-mail:kenkyuk-ask“AT”amed.go.jp
※E-mailは上記アドレス“AT”の部分を@に変えてください。
掲載日 平成28年5月9日
最終更新日 平成28年5月9日


