プレスリリース がん細胞が免疫から逃れるメカニズムの解明―免疫チェックポイント阻害剤の効果予測への応用に期待―
プレスリリース
国立大学法人京都大学
国立大学法人東京大学医科学研究所
国立大学法人北海道大学
国立研究開発法人日本医療研究開発機構
概要
今回、京都大学大学院医学研究科 腫瘍生物学 小川誠司 教授、片岡圭亮 特定助教、東京大学医科学研究所附属ヒトゲノム解析センター 宮野悟 教授、白石友一 助教、北海道大学大学院医学研究科免疫学 瀬谷司 特任教授、松本美佐子 客員教授らを中心とする研究チームは、33種類の主要ながん種を含む1万例を超えるがん試料のゲノム解析データについて、スーパーコンピュータを用いた大規模な遺伝子解析を通じて、がん細胞が免疫監視を回避する新たなメカニズムを解明することに成功しました。今回の研究の主な成果は以下の点です。
|
①肺がん、胃がん、食道がん、大腸がん、腎がん、膀胱がん、子宮頸がん、子宮体がん、頭頸部がん、悪性黒色腫、B細胞リンパ腫など、主要ながん種の多くで、代表的な免疫チェックポイント分子の一つであるPD-L1蛋白をコードする遺伝子の異常が生ずる結果、その遺伝子発現が著しく上昇していることを見出しました。特に、西南日本を中心として我が国に多く認められる 成人T細胞白血病では、25%という高い頻度でPD-L1のゲノムの異常が生じていることが明らかとなりました。 ②PD-L1遺伝子の異常は、いずれも、「3′非翻訳領域」と呼ばれる、蛋白質に翻訳されない遺伝子の末端部分に生ずる、欠失や部分的な配列の逆転(逆位)、他の遺伝子領域との異常な結合(転座)を含む構造異常で、どの異常においても、正常な「3′非翻訳領域」が失われる結果、PD-L1の遺伝子発現が上昇するという、新しいタイプの遺伝子異常であると考えられました。 ③実際に、がん細胞を含む様々な細胞において、最新のゲノム編集技術を用いてPD-L1の3′非翻訳領域に欠失や逆位を生じさせることによって、PD-L1の顕著な発現の上昇が生ずることが確認されました。 ④さらに、このようにして3′非翻訳領域を欠失させることによりPD-L1遺伝子の発現を誘導したがん細胞は、免疫による監視を回避して増殖することができるようになることが確認されました。一方、この増殖効果は、抗PD-L1抗体によって阻害されたことから、このようなPD-L1遺伝子のゲノム異常を認めるがんでは、免疫チェックポイント阻害剤による治療が有効である可能性が示唆されました。 |
本研究は、ATLをはじめとする様々な種類のがんで共通に認められる3′非翻訳領域の異常によって、免疫チェックポイント分子であるPD-L1の発現異常が生ずる結果、がん細胞が生体に本来備わっているがんに対する免疫監視を回避して、がんの発症に関わることを世界で初めて明らかにした研究です。本研究の意義は、
1) 新たにがん細胞が免疫を逃れるメカニズムの一端が解明されたこと、
2) がんの免疫回避に重要な役割を担うPD-L1遺伝子の発現制御に関わる、これまでに知られていなかった重要なメカニズムが解明されたこと、従って、本異常以外のメカニズムによって免疫の回避が起こる仕組みの理解に大きく貢献すること、
そして、最も重要な点は、
3) 本異常が、抗PD-1抗体や抗PD-L1抗体による免疫チェックポイント阻害が治療上、特に有用と思われる患者さんを見出すための有用なマーカーとなる可能性があること、
の3点に集約されます。
本研究は、日本医療研究開発機構(AMED)の「革新的がん医療実用化研究事業(15Ack0106014h0002)」、科学研究費助成事業 新学術領域研究(22134006, 15H05909)、文部科学省HPCI 戦略プログラム 分野1「予測する生命科学・医療および創薬基盤」(hp140230、hp150232)、文部科学省ポスト「京」重点課題(2)「個別化・予防医療を支援する統合計算生命科学」(hp160219)、国立がん研究センター研究開発費(26-A-6)の支援を受けて行われ、大規模なデータ解析は東京大学医科学研究所附属ヒトゲノム解析センターと共同でスーパーコンピュータ「京」を利用することにより実施されました。その成果は、2016年5月23日付で英国の科学誌「Nature」電子版にて公開されました。
研究の背景
一方、近年我が国の研究者による発見を契機として開発された抗PD-1抗体および抗PD-L1抗体が、悪性リンパ腫や、肺がん、悪性黒色腫をはじめとする多くのがん種において、顕著な臨床効果を示し、末期のがん患者においてもしばしば治癒をもたらすことが報告されるようになってきました。一般に生体には、本来がん細胞を除去するための免疫監視のメカニズムが備わっていて、がんの発症が抑制されていると考えられています。こうした、いわゆる「がん免疫」は、様々な免疫担当細胞によって担われていますが、このうち、直接的にがん細胞の殺傷に関わる細胞障害性T細胞(CTL)は、がん細胞に特異的に発現する多様な分子を通じてがん細胞を認識し、これを殺傷することにより、がん免疫を担っています。PD-L1は、がん細胞に発現する「免疫チェックポイント」を構成する一群の分子の一つで、がん細胞を攻撃するCTLが発現するPD-1分子に作用して、CTLを抑制することにより、こうしたCTLからの攻撃を逃れることができると考えられています(図1)。抗PD-1抗体および抗PD-L1抗体は、がん細胞によるこの免疫回避の仕組みを無効にすることによって、免疫担当細胞が再びがん細胞を認識し、これを攻撃することを可能にすることによって、抗腫瘍効果を発揮すると考えられます。このように抗PD-1抗体および抗PD-L1抗体をはじめとする免疫チェックポイント阻害薬では、生体にそもそも備わっているがん免疫を再度活性化することによって、抗腫瘍効果を得る、極めてユニークな治療法といえます。また、免疫システムは、患者の体内にある極めて多様ながん細胞を認識して殺傷できることが、通常の分子標的薬と異なった大きな特色です。
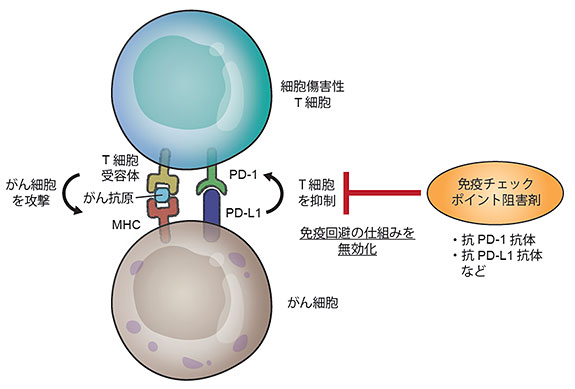 図1:がん細胞の免疫回避の仕組みと免疫チェックポイント阻害剤の標的
図1:がん細胞の免疫回避の仕組みと免疫チェックポイント阻害剤の標的
研究方法と結果
がんにおけるPD-L1遺伝子のゲノム異常の発見
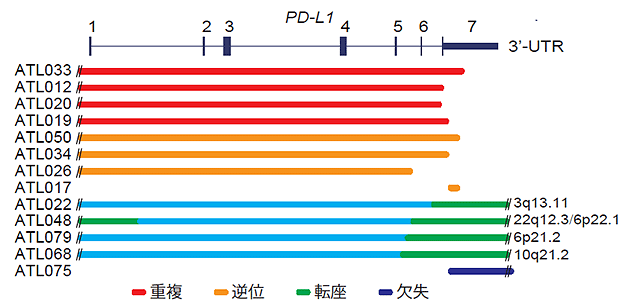 図2:ATLにおけるPD-L1のゲノム異常
図2:ATLにおけるPD-L1のゲノム異常
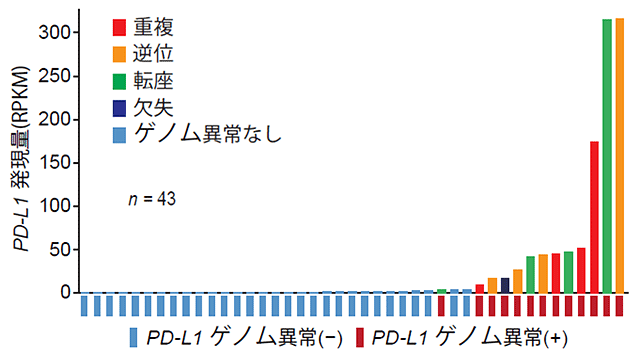 図3:ATLにおけるPD-L1ゲノム異常と発現の関係
図3:ATLにおけるPD-L1ゲノム異常と発現の関係
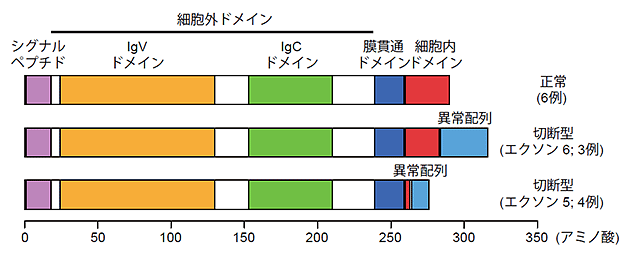 図4:PD-L1ゲノム異常を持つATL患者におけるPD-L1蛋白の構造
図4:PD-L1ゲノム異常を持つATL患者におけるPD-L1蛋白の構造
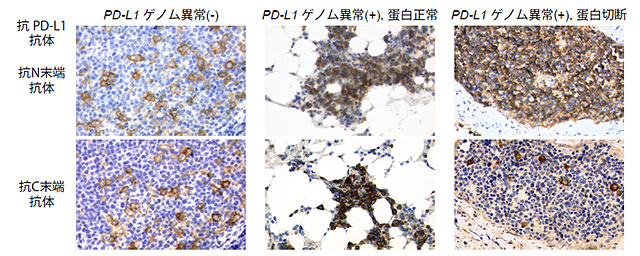 図5:PD-L1ゲノム異常を持つATL患者における免疫染色
図5:PD-L1ゲノム異常を持つATL患者における免疫染色
様々な悪性腫瘍におけるPD-L1遺伝子異常の解析
こうした一連のATLに関する解析から、PD-L1遺伝子の3′非翻訳領域の異常を介した遺伝子発現上昇は、ATLのみならず、様々ながん種で重要な免疫回避のメカニズムとなっている可能性が予測されました。そこで、米国のがんゲノムアトラス(The Cancer Genome Atlas(TCGA))に登録されている、33種類の悪性腫瘍からなる10,210例のがん試料の遺伝子解析データを用いてPD-L1遺伝子の3′非翻訳領域の異常の探索を行いました。その結果、肺がん、胃がん、食道がん、大腸がん、腎がん、膀胱がん、子宮頸がん、子宮体がん、頭頸部がん、悪性黒色腫、B細胞リンパ腫を含む、12種類のがん種を含む、計32症例において、PD-L1遺伝子の3′非翻訳領域の異常が同定されました(図6)。本異常は、特にB細胞悪性リンパ腫(8%)と胃がん(2%)で高頻度に認められました。さらに興味深いのは、TCGA症例の一部ではウイルスゲノムのPD-L1遺伝子領域への組み込みによって、PD-L1遺伝子の3′非翻訳領域の異常が生じていたことです。ウイルス感染は、子宮頸がん、頭頸部がん、肝がん、胃がんなど、様々ながんの原因になることが知られていますが、今回の結果は、一部のがんでは、ゲノムへのウイルスの組み込みによる3′非翻訳領域の異常がPD-L1遺伝子の発現上昇の原因になっていることが明らかになりました。
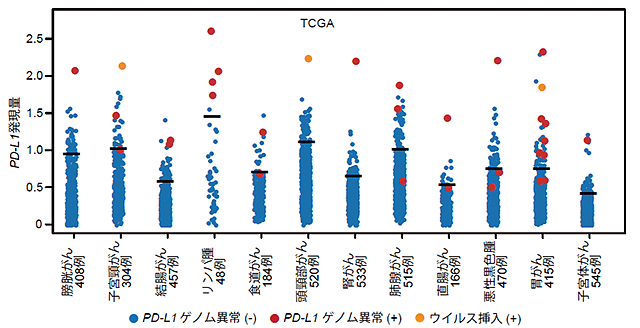
図6:様々な悪性腫瘍におけるPD-L1ゲノム異常
ゲノム編集技術を用いた3′非翻訳領域の機能の検討
一方、ウイルスの組み込みの有無に関わらず特筆すべき点として、これらの32例の全例でPD-L1遺伝子の高度な発現上昇が認められたことが挙げられます。これらのうち、12例については各々のがん種の中で最も高い発現を示していました(図6)。このことは、ATLと同様に、これらのがん種においても、PD-L1遺伝子の3′非翻訳領域の異常が遺伝子発現の調節に大変重要であることを示唆しています。そこで、これを検証するために、CRISPR-Cas9システムという最先端のゲノム編集技術を用いて、ヒトおよびマウス由来の様々な細胞株について、PD-L1遺伝子の3′非翻訳領域の異常(欠失ないし逆位)を導入して、それがPD-L1遺伝子発現に及ぼす影響を検討しました。その結果、PD-L1遺伝子の3′非翻訳領域の異常を導入した細胞では、いずれの細胞においても顕著なPD-L1発現上昇が認められました。このことから、3′非翻訳領域の異常が、一連のがんでPD-L1遺伝子の発現上昇の原因であることが確認されました(図7)。実際、3′非翻訳領域を欠いたPD-L1の転写産物は、正常のPD-L1転写産物と比較して、細胞内で安定に存在することが確認されました。このことは、正常の細胞では、その3′非翻訳領域を介したPD-L1の転写産物の安定性の制御を通じて遺伝子発現レベルが調節されていること、また、3′非翻訳領域の異常を有するがん細胞では、それが破綻を来す結果、転写産物が安定化することによって、PD-L1の遺伝子発現の上昇が生じていることが示唆されました。
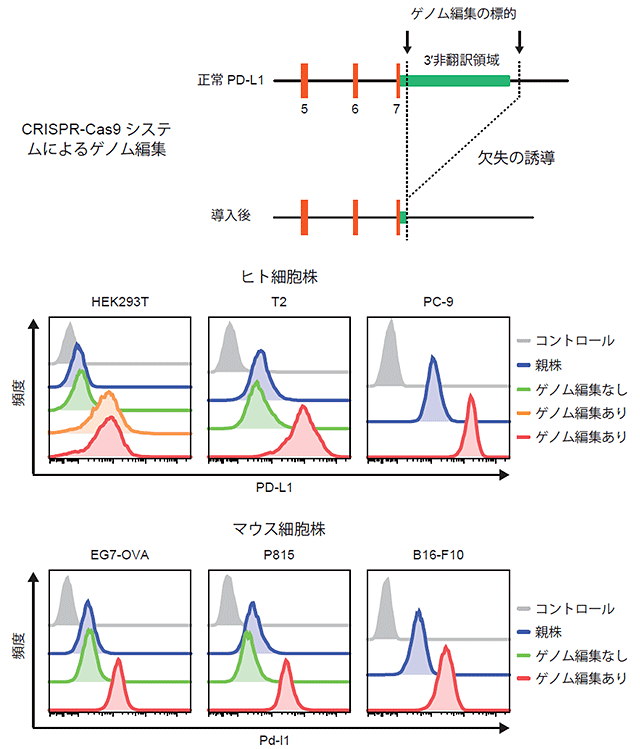
図7:ゲノム編集を用いたPD-L1ゲノム異常の導入によりPD-L1高発現が誘導される
3′非翻訳領域の欠失によるPD-L1遺伝子の発現上昇は、がん細胞の免疫回避と増殖を促進する
最後に、3′非翻訳領域の欠失により、生体内でがん細胞にどのような結果がもたらされるかについて、マウスの移植モデルを用いて検証しました。すなわち、マウスのリンパ腫由来の細胞株であるEG7-OVAをマウスの皮下に移植した後、免疫を促進させる薬剤(アジュバント)を投与してがん免疫を誘導することにより、腫瘍の縮小効果を通常のEG7-OVA細胞と3′非翻訳領域を欠失させたEG7-OVA細胞について検討しました。通常のEG7-OVA細胞を移植したマウスでは、がん組織内にTリンパ球(CTL)が浸潤し、がん細胞は縮小します。しかし、上記の方法で3′非翻訳領域を欠失させてPD-L1遺伝子の発現上昇を誘導したEG7-OVAがん細胞では、CTLの浸潤やがん細胞の縮小はほとんど認められませんでした(図8)。
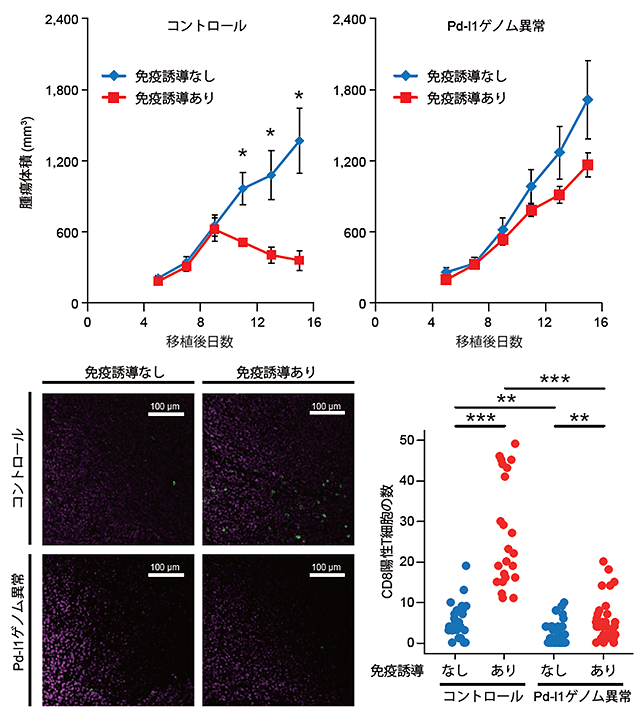
図8:Pd-l1ゲノム異常によりがん細胞の増殖と免疫回避が促進される
この結果は、PD-L1ゲノム異常を持つがん細胞は、PD-L1遺伝子の発現上昇を介して、CTLによって担われるがん免疫を回避できることを示唆しています。さらに、3′非翻訳領域を欠失させたEG7-OVA細胞を移植したマウスにアジュバントと併用して抗PD-L1抗体を投与すると、通常のEG7-OVA細胞を導入した場合と同様に、CTLの浸潤やがん細胞の縮小が認められました(図9)。これらの結果は、免疫チェックポイント阻害剤を用いることにより、PD-L1遺伝子の3′非翻訳領域の異常を有するがんの治療が可能であることを示していると考えられます。
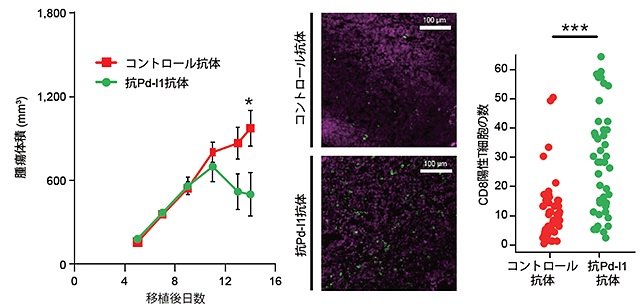
図9:抗Pd-l1抗体の投与によりPd-l1ゲノム異常による腫瘍増殖・免疫回避は阻害される
まとめ
今回の研究によって、がん細胞が免疫を回避する新たなメカニズムが解明されるとともに、PD-L1遺伝子の発現調節において、3′非翻訳領域が重要な役割を担っていることが明らかになりました。ほとんどのがん種において、本ゲノム異常が存在する症例は限られていますが、がん全体でみれば、最も普遍的かつ高頻度に認められるゲノムの構造異常の一つであると考えられます。さらに、本研究で示された最も重要なことは、PD-L1遺伝子の 3′非翻訳領域の異常は、これを有するがん細胞が積極的にがん免疫を回避していることを示しており、従って、抗PD-1/PD-L1抗体を用いた免疫チェックポイント阻害に対する顕著な臨床効果が期待される症例を同定するための有用な遺伝子マーカーになり得るという可能性です。また、現在抗PD-1/PD-L1抗体の効果予測に用いられている免疫染色において、PD-L1の後半部分(C末端)を認識する抗体が使用されていることの問題点も指摘しています。特に、PD-L1の遺伝子異常が高頻度に認められる一部のがん種(ホジキンリンパ腫など)において免疫チェックポイント阻害剤が極めて有効で、しばしば治癒も期待できることに鑑みると、この可能性は早急に検証されるべきであると考えられます。
今後の展望と期待される波及効果
今回の研究成果を踏まえた、今後の最も重要な課題は、本異常を有するがんに対して、抗PD-1/PD-L1抗体を用いた免疫チェックポイント阻害が、期待されるような顕著な臨床効果を示すかどうかを臨床試験によって検証することです。実際に、顕著な臨床効果が確認された場合には、本ゲノム異常がヒトのがんで最も普遍的かつ高頻度に認められるゲノムの構造異常の一つであることを考えると、その波及効果は極めて大きいと期待されます。また、本異常をバイオマーカーとして用いた分子標的治療の実現する可能性があります。実際、本異常のバイオマーカーとしての意義を検証するために、「再発又は難治性の成人T細胞白血病・リンパ腫に対するニボルマブの第Ⅱ相医師主導治験【UMIN000020601】」が現在鹿児島大学を中心として進行中であり、臨床試験の結果に大きな期待が持たれます。
論文タイトルと著者
タイトル
Aberrant PD-L1 expression through 3′-UTR disruption in multiple cancers.
著者
Keisuke Kataoka1*, Yuichi Shiraishi2*, Yohei Takeda3*, Seiji Sakata4, Misako Matsumoto3, Seiji Nagano5, Takuya Maeda5, Yasunobu Nagata1, Akira Kitanaka6, Seiya Mizuno7, Hiroko Tanaka2, Kenichi Chiba2, Satoshi Ito2, Yosaku Watatani1, Nobuyuki Kakiuchi1, Hiromichi Suzuki1, Tetsuichi Yoshizato1, Kenichi Yoshida1, Masashi Sanada8, Hidehiro Itonaga9, Yoshitaka Imaizumi10, Yasushi Totoki11, Wataru Munakata12, Hiromi Nakamura11, Natsuko Hama11, Kotaro Shide6, Yoko Kubuki6, Tomonori Hidaka6, Takuro Kameda6, Kyoko Masuda5, Nagahiro Minato13, Koichi Kashiwase14, Koji Izutsu15, Akifumi Takaori-Kondo16, Yasushi Miyazaki10, Satoru Takahashi7, Tatsuhiro Shibata11,17, Hiroshi Kawamoto5, Yoshiki Akatsuka18,19, Kazuya Shimoda6, Kengo Takeuchi4, Tsukasa Seya3, Satoru Miyano2 & Seishi Ogawa1
1 Department of Pathology and Tumor Biology, Graduate School of Medicine, Kyoto University, Kyoto, 606-8501, Japan.
2 Laboratory of DNA Information Analysis, Human Genome Center, Institute of Medical Science, The University of Tokyo, Tokyo, 108-8639, Japan.
3 Department of Microbiology and Immunology, Graduate School of Medicine, Hokkaido University, Sapporo, 060-8638, Japan.
4 Pathology Project for Molecular Targets, Cancer Institute, Japanese Foundation for Cancer Research, Tokyo, 135-8550, Japan.
5 Department of Immunology, Institute for Frontier Medical Science, Kyoto University, Kyoto, 606-8507, Japan.
6 Department of Gastroenterology and Hematology, Faculty of Medicine, University of Miyazaki, Miyazaki, 889-1692, Japan.
7 Laboratory Animal Resource Center and Faculty of Medicine, University of Tsukuba, Tsukuba, 305-8575, Japan.
8 Department of Advanced Diagnosis, Clinical Research Center, Nagoya Medical Center, Nagoya, 460-0001, Japan.
9 Department of Hematology, Sasebo City General Hospital, Sasebo, 857-8511, Japan.
10 Department of Hematology, Atomic Bomb Disease and Hibakusya Medicine Unit, Atomic Bomb Disease Institute, Nagasaki University, Nagasaki, 852-8523, Japan.
11 Division of Cancer Genomics, National Cancer Center Research Institute, Tokyo, 104-0045, Japan.
12 Department of Hematology, National Cancer Center Hospital, Tokyo, 104-0045, Japan.
13 Department of Immunology and Cell Biology, Graduate School of Medicine, Kyoto University, Kyoto, 606-8501, Japan.
14 Department of HLA Laboratory, Japanese Red Cross Kanto-Koshinetsu Block Blood Center, Tokyo, 135-8639, Japan.
15 Department of Hematology, Toranomon Hospital, Tokyo, 105-8470, Japan.
16 Department of Hematology and Oncology, Graduate School of Medicine, Kyoto University, Kyoto, 606-8501, Japan.
17 Laboratory of Molecular Medicine, Human Genome Center, Institute of Medical Science, The University of Tokyo, Tokyo, 108-8639, Japan.
18 Department of Hematology, Fujita Health University School of Medicine, Toyoake, 470-1192, Japan.
19 Division of Immunology, Aichi Cancer Center Research Institute, Nagoya, 464-8681, Japan.
* These authors equally contributed to this work.
用語解説
- 免疫チェックポイント
- がん細胞が免疫細胞に対してブレーキをかけて免疫細胞からの攻撃を阻止する際に働く、ブレーキ役の分子である。
- ゲノム
- ある生物のもつ全ての遺伝情報、あるいはこれを保持するDNA の全塩基配列である。タンパク質のアミノ酸配列に変換されるコード(エクソン)領域とそれ以外の非コード領域に大別される。
- 3′非翻訳領域
- ゲノム上のタンパク質に変換されない非コード領域の一つであり、遺伝子のコード領域の下流に存在する。遺伝子の発現の調節に関わる。
- シーケンス
- DNA を構成するヌクレオチドの塩基配列を決定すること。次世代シーケンサーは、従来の蛍光キャピラリーシーケンサーと対比させて用いられる用語。次世代シーケンサーの登場により、大量の塩基配列を短時間で決定することが可能となり、がんおける遺伝子変異の知見が飛躍的に進歩した。
- スーパーコンピュータ
- 科学技術計算を主要目的とする大規模コンピュータである。生物学の分野では次世代シーケンスなどの大規模データ解析に用いられている。「京」は理化学研究所に設置された世界有数のスーパーコンピュータである。
お問い合わせ先
報道関係のお問い合わせ先
- 国立大学法人京都大学
-
大学院医学研究科腫瘍生物学
教授 小川誠司(おがわ せいし)
E-mail:sogawa-tky“AT”umin.ac.jp
TEL:075-753-9283 FAX:075-753-9282特定助教 片岡圭亮(かたおか けいすけ)
E-mail:kkataoka-tky“AT”umin.ac.jp
TEL:075-753-9284 FAX:075-753-9282企画・情報部広報課
TEL:075-753-2071 - 国立大学法人東京大学
-
東京大学医科学研究所附属 ヒトゲノム解析センター
教授 宮野悟(みやの さとる)
E-mail:miyano“AT”ims.u-tokyo.ac.jp
TEL:03-5449-5615 FAX:03-5449-5442管理課総務チーム
TEL:03-5449-5601 - 国立大学法人北海道大学
-
大学院医学研究科免疫学
客員教授 瀬谷司(せやつかさ)
E-mail:seya-tu“AT”pop.med.hokudai.ac.jp
TEL:011-706-5073 FAX:011-706-7866総務企画部広報課
TEL:011-706-2610
革新的がん医療実用化研究事業に関するお問い合わせ
国立研究開発法人日本医療研究開発機構(AMED)
戦略推進部 がん研究課
〒100-0004 東京都千代田区大手町一丁目7番1号
TEL:03-6870-2221 E-mail:cancer“AT”amed.go.jp
※E-mailは上記アドレス“AT”の部分を@に変えてください。
関連リンク
掲載日 平成28年5月24日
最終更新日 平成28年5月24日


