プレスリリース 骨を溶かす細胞の機能を動物の体内で可視化―移動しながら溶かす場所を探す破骨細胞をその場で観測―
プレスリリース
国立大学法人大阪大学
国立研究開発法人日本医療研究開発機構
研究成果のポイント
- マウスの生体そのまま(in vivo)の状態で、活性時の破骨細胞※1が骨を溶かす場所を可視化
- 移動する破骨細胞の局在変化と活性変化をリアルタイムに画像化し、骨を溶かす強さの定量化に成功
- 破骨細胞の活性情報が簡便かつ迅速に得られることから、患部の早期診断や新規治療薬の開発に期待
概要
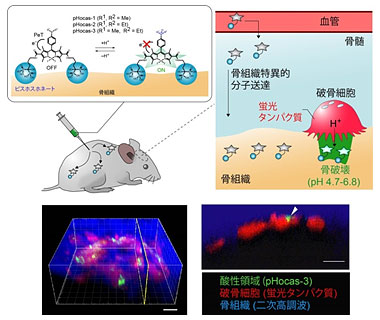 破骨細胞機能蛍光プローブとイメージング図
破骨細胞機能蛍光プローブとイメージング図
本研究成果の内容、社会に与える影響
蛍光タンパク質を用いる既存の手法では、破骨細胞の局在の情報は得られても、その活性まで調べることはできませんでした。しかし本手法は、破骨細胞の活性情報が簡便かつ迅速に得られることから、患部の早期診断や新規治療薬のスクリーニングに有効であり、医療や産業界に大きく貢献できると予想されます。また本研究は、物理化学の原理に基づく分子設計、有機合成化学による機能性蛍光プローブの構築、免疫学の知識・技術を用いた生体内機構の解明、という複数の分野の枠組みを越えた学際的研究であり、医学、化学、測定機器メーカーに関連する分野に幅広く貢献し、基礎研究から医学研究応用まで達成した研究として社会的にも学術的にも極めて大きな意義がある、と考えています。
掲載論文・雑誌
【論文タイトル】“Real-time intravital imaging of pH variation associated with osteoclast activity”
【著者】Hiroki Maeda, Toshiyuki Kowada, Junichi Kikuta, Masayuki Furuya, Mai Shirazaki, Shin Mizukami, Masaru Ishii and Kazuya Kikuchi
特記事項
詳しい解説
研究の背景
生体2光子励起イメージングとは、生きた動物やヒト体内における細胞動態を直接顕微鏡で検出する手法です。細胞培養や組織切片を利用したイメージング手法とは異なり、細胞移動、細胞間相互作用等を、生きたままの組織中で解析できます。生体2光子励起イメージングで使用される2光子励起顕微鏡は、蛍光団を通常の2倍の波長で励起可能であり、高い生体透過性、三次元画像の取得、自家蛍光の抑制など、in vivoイメージングに最適な特徴を有し、蛍光タンパク質や低分子プローブを蛍光団として、生体内の一細胞動態を詳細に解析可能です。蛍光タンパク質は、遺伝子工学による特定の細胞・細胞小器官への導入が可能であるため、組織中の特定細胞を標的としたイメージング実験系が多数報告されています。一方、低分子プローブは、多彩な化学的な修飾が可能で、遺伝子工学的手法を用いずに、細胞活性を評価可能であるという大きな利点を有します。しかし、蛍光タンパク質とは異なり、細胞選択性が低いため、動物個体内において特定の細胞を標的としたイメージングが不可能という問題がありました。このため、低分子プローブの内視鏡顕微鏡イメージングへの応用例は、ごく少数例に限られているのが現状です。この状況のもと、本研究では、破骨細胞機能を評価できる低分子プローブを作製し、2光子励起顕微鏡イメージングを達成しました。
従来の破骨細胞機能の評価法としては、細胞培養系を用いたin vitroアッセイ※4が主流です。しかしながら、細胞培養系と実際の生体内の破骨細胞では、細胞形態が著しく異なることが指摘されており、破骨細胞が本来有する骨吸収機能を正しく評価することはできませんでした。そこで、本研究では、骨組織に対する能動的標的指向性を有するpH感受性蛍光プローブを用いて破骨細胞活性を可視化可能なシステムを構築しました。
 破骨細胞は、活性化時に酵素やプロトンを放出し、骨組織の破壊を行います。本研究では、この酸性領域を蛍光プローブにより選択的に可視化することで、活性化破骨細胞を検出可能であると考えました(右図)。すなわち、活性化破骨細胞がpH感受性蛍光プローブの吸着した骨表面で酸性領域を形成すれば、活性化破骨細胞の細胞基底面から蛍光が観察されるはずです。そして、破骨細胞自身を蛍光タンパク質によってラベル化することで、破骨細胞の局在変化に伴うpH変動、つまり活性変化をリアルタイムに検出することを可能としました。具体的には、酸性条件下で蛍光ONとなるスイッチ機能を持った低分子プローブを、骨表面上に送達することによって、生体内破骨細胞活性を検出可能であると考えました。そこで、骨組織に対して高いアフィニティー※5を有するビスホスホネート基※6に着目し、ビスホスホネート基による能動輸送能を有する光安定性の高いpH感受性プローブ”pHocas”(pH-activatable fluorescence probe for osteoclast activity sensing)をデザイン・合成しました。破骨細胞自身を蛍光タンパク質によってラベル化し、pHocasで破骨細胞の活性化を検出することで、生体2光子励起イメージングによる細胞動態のリアルタイム解析が可能となりました。また、光安定性の高い色素母骨格を用いることによって、2光子励起顕微鏡観察下において、長時間に渡り破骨細胞活性を可視化が可能であることを示しました。この結果、長時間の破骨細胞動態を解析することによって、骨吸収中の破骨細胞には、➀酸性領域が動かず、motilityの低い細胞と、➁酸性領域が動く、運動性の高い細胞の2種類が存在することを明らかにし、破骨細胞の骨吸収メカニズムについて新たな知見を得ました。
破骨細胞は、活性化時に酵素やプロトンを放出し、骨組織の破壊を行います。本研究では、この酸性領域を蛍光プローブにより選択的に可視化することで、活性化破骨細胞を検出可能であると考えました(右図)。すなわち、活性化破骨細胞がpH感受性蛍光プローブの吸着した骨表面で酸性領域を形成すれば、活性化破骨細胞の細胞基底面から蛍光が観察されるはずです。そして、破骨細胞自身を蛍光タンパク質によってラベル化することで、破骨細胞の局在変化に伴うpH変動、つまり活性変化をリアルタイムに検出することを可能としました。具体的には、酸性条件下で蛍光ONとなるスイッチ機能を持った低分子プローブを、骨表面上に送達することによって、生体内破骨細胞活性を検出可能であると考えました。そこで、骨組織に対して高いアフィニティー※5を有するビスホスホネート基※6に着目し、ビスホスホネート基による能動輸送能を有する光安定性の高いpH感受性プローブ”pHocas”(pH-activatable fluorescence probe for osteoclast activity sensing)をデザイン・合成しました。破骨細胞自身を蛍光タンパク質によってラベル化し、pHocasで破骨細胞の活性化を検出することで、生体2光子励起イメージングによる細胞動態のリアルタイム解析が可能となりました。また、光安定性の高い色素母骨格を用いることによって、2光子励起顕微鏡観察下において、長時間に渡り破骨細胞活性を可視化が可能であることを示しました。この結果、長時間の破骨細胞動態を解析することによって、骨吸収中の破骨細胞には、➀酸性領域が動かず、motilityの低い細胞と、➁酸性領域が動く、運動性の高い細胞の2種類が存在することを明らかにし、破骨細胞の骨吸収メカニズムについて新たな知見を得ました。
研究の手法と成果
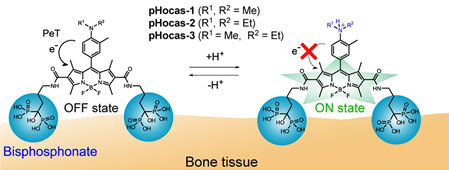 図1.pHocas類の分子構造及び蛍光制御メカニズム
図1.pHocas類の分子構造及び蛍光制御メカニズム
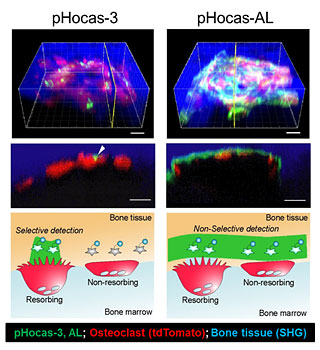 図2.pHocas-3(pHプローブ)及びpHocas-AL(コントロールプローブ)を用いた3D in vivoイメージング
図2.pHocas-3(pHプローブ)及びpHocas-AL(コントロールプローブ)を用いた3D in vivoイメージング
菊地教授らは以前に、in vivoでの2光子励起内視鏡型顕微鏡を用いた破骨細胞機能(破骨細胞が機能する骨表面にデリバリーされるpHプローブ)の可視化プローブBAp-E※7を合成しています[J. Am. Chem. Soc., 133, 17772 (2011)]が、光安定性に問題があり長時間観測は達成していませんでした。そこで、これまでイメージング用に合成してきたpHプローブを破骨細胞機能可視化プローブに応用することにしました。BODIPY色素※8に電子吸引基を導入したプローブpHocas-3をデザインし、pHocas-3の光安定性を検討するため、BAp-Eと同様の光照射条件下における蛍光強度変化を測定しました。その結果、BAp-Eが約10分で蛍光を失うのに対して、pHocas-3は30分間の照射後も十分な蛍光強度を有しました。このため、2光子励起顕微鏡による観察下においても、pHocas-3の蛍光は長時間に渡って検出可能であると期待されます。pHocas-3の光安定性向上が、2つのアミド基の導入によるROS(活性酸素)※9に対する反応性低下に起因することを確認するため、各種ROSとの反応後の蛍光強度変化を測定しました。その結果、BAp-Eと比較して、pHocas-3は一重項酸素とスーパーオキシドに対する安定性が高いことが判明しました。電子吸引基を導入し、BODIPY色素の電子密度を下げることによって、ROSに対する反応性が減少していると考えられます。
さらに、このpHocas-3を用いて破骨細胞活性を定量的に評価可能か検討しました(図3)。既存の破骨細胞活性評価手法では、生きた動物体内における細胞活性を定量的に解析することは非常に困難でした。pHocas-3を使って破骨細胞活性を定量解析するため、プローブと破骨細胞の蛍光シグナルが共局在しているものを活性化しているとみなして、活性化破骨細胞の数を解析しました。また、破骨細胞の分化、活性化、生存を促進するサイトカイン※10であるRANKL(receptor activator of NF-κB ligand)を加えた際の、骨吸収活性の変化についても検討しました。一視野当たりの活性化破骨細胞の割合を算出したところ、PBS投与群では、約30%の破骨細胞が活性化するのに対して、RANKL投与群では約60%の破骨細胞が活性化していました。これは、RANKL投与によって、骨吸収前の破骨細胞が活性化され、骨吸収が促進されたことを示しています。このように、pHocas-3はin vivoにおける活性化状態にある破骨細胞数を検出することが可能であり、細胞活性の定量解析に確かに応用可能です。
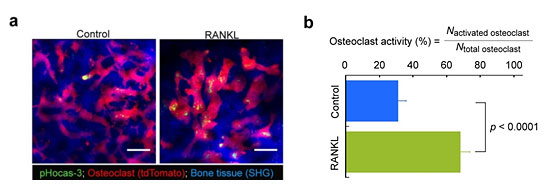
図3.RANKLによる破骨細胞活性化のイメージング定量評価
以上の検討で明らかになったこと
これまで運動性と機能(骨吸収能力)の相関が推論でしかなかった破骨細胞の生体内での挙動が初めて可視化して示されまし。この結果、多くの破骨細胞が生体内で動きながら機能する場所を探し、ごく僅かな破骨細胞が1カ所に留まって骨を溶かす様子が画像として示されました。
今後の期待
本研究では破骨細胞が骨を溶かす強さを定量可能と示しました。このため本技術は今後、薬物アッセイや細胞活性を指標としたサイトカインなどの活性分子の評価法へつながる可能性が高く、今後プローブの光特性を最適化することで、他の細胞との同時多色イメージングが可能となると期待できます。
また、本手法は、破骨細胞の活性情報が簡便かつ迅速に得られることから、患部の早期診断や新規治療薬のスクリーニングに有効であり、医療や産業界に大きく貢献できると予想されます。本研究は、物理化学の原理に基づく分子設計、有機合成化学による機能性蛍光プローブの構築、免疫学の知識・技術を用いた生体内機構の解明、という複数の分野の枠組みを越えた学際的研究であり、医学、化学、測定機器メーカーに関連する分野に幅広く貢献し、基礎研究から医学研究応用まで達成した研究として社会的にも学術的にも極めて大きな意義がある、と考えています。
用語解説
- ※1 破骨細胞
- 破骨細胞は、造血幹細胞から分化して細胞が融合した多核細胞として生まれる骨吸収細胞であり、骨の成長、修復に関与する重要な役割を果たす。破骨細胞機能の異常化と骨疾患発症との密接な関連が指摘されている。例えば、過剰な骨吸収によって骨粗しょう症や関節リウマチを発症する。
- ※2 蛍光プローブ
- プローブは元々探針という意味だが、転じて蛍光プローブは、特定の分子と反応することで強い蛍光を発したり蛍光色を変えたりする機能性分子を指す。
- ※3 生体2光子励起イメージング
- 体内透過力が高い近赤外領域の光子2つが吸収された結果、可視光領域に波長遷移することを利用して開発された。生物体内における細胞の動きを直接顕微鏡で検出する。
- ※4 in vitroアッセイ
- in vivoが生体そのままを指すのに対し、in vitroは培養した細胞などを対象に試験管やシャーレで行われる実験。
- ※5 アフィニティー
- 「親和性」ともいい結合しやすさを指す。
- ※6 ビスホスホネート(bisphosphonate)
- リン酸基を2つ持つ構造を基本骨格とする化合物で、破骨細胞の活動を阻害し骨の吸収を防ぐ薬として一般的。
- ※7 BAp-E
- 骨の表面のpHに依存して蛍光色を変える蛍光プローブ。
- ※8 BODIPY 色素
- 蛍光色素の一種で、シャープ(波長にぶれがない)で明るい光を発するため、様々なイメージングに使われる。
- ※9 ROS(活性酸素)
- 反応性の高い酸素を持つ有機化合物。細胞内のDNAを損傷することが知られている。
- ※10 サイトカイン
- 細胞が他の細胞に情報や命令を伝えるために出すタンパク質の総称。
お問い合わせ先
研究に関するお問い合わせ先
大阪大学 免疫学フロンティア研究センター(WPI-IFReC)
大学院工学研究科生命先端工学専攻 ケミカルバイオロジー領域
教授 菊地 和也(キクチ カズヤ)
TEL:06-6879-7924 FAX:06-6879-7875
E-mail: kkikuchi”AT”mls.eng.osaka-u.ac.jp
大阪大学 免疫学フロンティア研究センター(WPI-IFReC)
大学院医学系研究科 免疫細胞生物学
教授 石井 優(イシイ マサル)
TEL:06-6879-3880 FAX:06-6879-3889
E-mail: mishii”AT”icb.med.osaka-u.ac.jp
AMEDに関するお問い合わせ先
国立研究開発法人日本医療研究開発機構(AMED)
戦略推進部 研究企画課
TEL:03-6870-2224 FAX:03-6870-2243
E-mail:kenkyuk-ask”AT”amed.go.jp
WPIに関するお問い合わせ先
文部科学省研究振興局基礎研究振興課 国際研究拠点形成支援係
TEL:03-5253-4111(代表) 03-6734-4248(直通)
※E-mailは上記アドレス”AT”の部分を@に変えてください。
掲載日 平成28年6月7日
最終更新日 平成28年6月7日


