プレスリリース 神経損傷マーカー“神経細胞特異的酵素(NSE)”は炎症があると神経細胞ではなくグリア細胞で産生される
プレスリリース
国立大学法人群馬大学
国立研究開発法人日本医療研究開発機構
研究の概要
群馬大学大学院医学系研究科脳神経再生医学分野の平井宏和教授、澤田悠輔大学院生、今野歩助教、長岡潤医学部生らの研究グループは、脳内で炎症が起こるとグリア細胞(アストロサイト)(*1)の中でそれまで眠っていたNSE(*2)を作る遺伝子(NSEプロモーター)が働き出しNSEが産生され、神経細胞では逆にNSEを作る遺伝子が抑えられNSEが消失すること、さらにこの変化は炎症が収まると元に戻ることを発見しました。今回の発見は、脳疾患の診断精度の向上や、細胞レベルでの病態の理解に役立つことが期待されます。
脳内でNSEはこれまでグリア細胞には存在せず、神経細胞だけに存在するため、脳脊髄液内のNSEレベルの上昇は、神経細胞の損傷を反映しているとされてきました。実際、神経細胞が傷害を受ける脳血管障害や頭部外傷で血中、および脳脊髄液中のNSEが高値になることが知られています。しかし、注意して過去の文献を調べると髄膜炎や脳炎など、それほど神経細胞が傷害されるとは言えない疾患でも顕著に上昇し、さらにグリア細胞由来の腫瘍細胞でもNSEが産生されており、神経細胞だけにNSEが存在するというこれまでの考えと矛盾する報告もなされています。
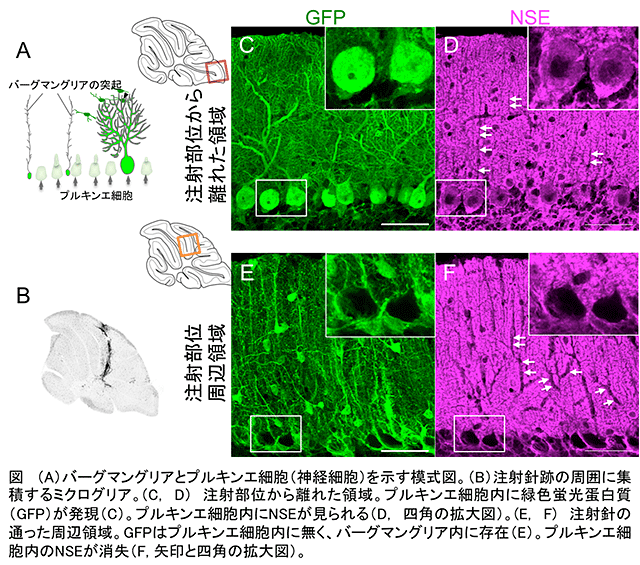
NSEが神経細胞のみに存在するのは、NSE産生を誘導する遺伝子領域(NSEプロモーター)が神経細胞だけで働くからです。NSEが「Neuron-specific(神経細胞特異的)」と名付けられたため、NSEプロモーターも必ず神経細胞だけで働くと考えられて来ました。本研究ではNSEプロモーターと緑色蛍光蛋白質(GFP)遺伝子を組み込んだウイルスをマウスの小脳に注射しました。ウイルスは脳内で神経細胞とグリア細胞の両方に感染しますが、NSEプロモーターが働く神経細胞でのみ蛍光蛋白質が作られると予測されました。ところが、注射した部位の周囲で緑色蛍光蛋白質は神経細胞ではなく、ほとんどグリア細胞で作られていました(図)。注意深く調べた結果、注射針で脳組織が損傷して炎症が引き起こされることが重要であることがわかりました。炎症によってグリア細胞が活性化すると細胞内でNSEプロモーターが働き、NSEが作られて解糖系が進み乳酸が作られます。一方、隣接する神経細胞ではグリア細胞から乳酸を受け取ってエネルギー源とするため、NSEプロモーターの働きが抑えられると考えられました。
発見の経緯
社会的意義とこれからの展望
本研究成果は2016年6月13日(月)に「Scientific Reports」オンライン発表されます。
用語の説明
- (*1)グリア細胞
- グリア細胞は脳に分布する神経細胞以外の細胞で、アストロサイト、オリゴデンドロサイトおよびミクログリアの三つに分類されます。今回、炎症に伴いNSEを産生したアストロサイトは神経細胞の周囲に存在し、神経細胞の活動で放出される神経伝達物質の取り込みや、神経栄養因子の放出などを介して脳機能の維持に重要な役割を担っています。
- (*2)神経特異的酵素(NSE:Neuron Specific Enolase)
- 解糖系の酵素であるEnolaseは哺乳類では3種類のサブユニット(α, β, γ)があり、2つのサブユニットからなる2量体です。αは大部分の細胞、βは筋肉、γは神経細胞に発現しており、γサブユニットを含むもの(γγおよびαγ)をNSEと呼びます。β-Enolase欠損はヒトの遺伝病として知られ、運動誘発性に筋症状を示します。
掲載論文
Inflammation-induced reversible switch of the neuron-specific enolase promoter from Purkinje neurons to Bergmann glia
Yusuke Sawada, Ayumu Konno, Jun Nagaoka & #Hirokazu Hirai (#責任著者)
本研究は、国立研究開発法人日本医療研究開発機構(AMED)の研究開発領域「革新的技術による脳機能ネットワークの全容解明プロジェクト」(平成27年度に文部科学省より移管)(技術開発個別課題「マーモセット中枢神経系の細胞種特異的、回路特異的遺伝子発現ウイルスベクターの開発」研究開発担当者 平井 宏和 群馬大学大学院医学系研究科教授の一環で行われました。
お問い合わせ先
研究について
脳神経再生医学分野 教授 平井 宏和(ひらい ひろかず)
TEL 027-220-7930/FAX 027-220-7936
E-mail:hirai“AT”gunma-u.ac.jp
取材対応窓口
広報係長 池守 善洋(いけもり よしひろ)
TEL 027-220-7895/FAX 027-220-7720
E-mail:m-koho“AT”jimu.gunma-u.ac.jp
AMEDの事業に関するお問い合わせ
日本医療研究開発機構戦略推進部 脳と心の研究課
TEL 03-6870-2222/FAX 03-6870-2244
E-mail:brain-pm“AT”amed.go.jp
※E-mailは上記アドレス“AT”の部分を@に変えてください。
掲載日 平成28年6月13日
最終更新日 平成28年6月13日


