プレスリリース ゲノム編集技術により免疫不全霊長類の作出に成功(霊長類を用いた自閉症、統合失調症などの精神神経疾患研究も可能に)
プレスリリース
公益財団法人実験動物中央研究所
慶應義塾大学医学部
国立研究開発法人日本医療研究開発機構
日本医療研究開発機構・脳科学研究戦略推進プログラムの一環として、(公益財団法人)実験動物中央研究所(実中研)マーモセット研究部の佐々木 えりか部長(慶應義塾大学先導研究センター特任教授兼務)と慶應義塾大学(慶應大)医学部生理学教室の岡野 栄之教授らは、ゲノム編集注1)という技術を用いて、世界に先駆けて目的の形質を示す霊長類のモデル動物の作製に成功しました。これまで、遺伝子改変マウスはライフサイエンス研究に貢献してきましたが、ヒト疾患の治療法開発研究のためにはマウスよりヒトと解剖学的、生理学的に類似している霊長類のモデル動物が重要となります。本研究グループは2009年に小型で繁殖力の高い霊長類であるコモンマーモセット(以下、マーモセット)を用いて、世界初のトランスジェニック注2)マーモセットの作製に成功し、ヒト疾患モデル動物の開発・研究を大きく進展させてきました。しかしながら多くのヒト疾患モデルマウスが作製されてきた標的遺伝子ノックアウト技術注3)はマーモセットを含む霊長類には適用できませんでした。一方、近年、開発されたゲノム編集技術により、霊長類を含む様々な動物種で受精卵の遺伝子を直接改変できるようになり、本研究によって霊長類であるマーモセットでもゲノム編集を用いてヒト病態モデルの作成が可能である事を示しました。
今回の研究では、ゲノム編集によりマーモセット受精卵のIL2rg遺伝子の機能を失活させて先天性免疫不全マーモセットを作成しました。具体的にはマーモセット受精卵内のIL2rg遺伝子を標的とした人工ヌクレアーゼをコードするmRNA注4)を注入し、正常に発生した胚を仮親マーモセット子宮内に移植し胎仔を得ました。種々の免疫学的解析の結果、産出された胎仔には正常の免疫機能が認められず、狙い通り免疫不全マーモセットになることが証明されました。このようにして得られた免疫不全マーモセットは、高度に衛生が管理されたクリーン飼育室では長期間(1年以上)生存させることが可能であり、ヒトの重症先天性免疫不全症と近似した特徴を示すことが明らかになりました。今後、免疫不全マーモセットはヒト免疫不全症の病態解明ならびに治療法開発モデルとして、また、ヒトiPS細胞を用いた様々な臓器再生医療における新たな治療法の有効性・安全性の検証にも貢献すると期待されます。さらに、今回開発したゲノム編集を用いたヒト疾患のマーモセットモデル作製技術は自閉症、統合失調症などのヒト精神・神経疾患をはじめとした様々な疾患の発症メカニズム、病態解明に貢献するものと期待されます。
本研究成果は、2016年6月30日(米国東部標準時正午)発行の科学雑誌Cell Stem Cell誌に掲載されます。
本成果は、主に以下の事業・研究領域・研究課題によって得られました。
日本医療研究開発機構(AMED)脳科学研究戦略推進プログラム(平成27年度より文部科学省より移管)
- 研究課題名:
- 「遺伝子改変マーモセットの汎用性拡大および作出技術の高度化とその脳科学への応用」
- 研究代表者:
- 佐々木えりか[(公財)実験動物中央研究所 マーモセット研究部 部長]
- 研究期間:
- 平成26年4月~平成30年3月
最先端研究開発支援プログラム(FIRST)
- 研究課題名:
- 「心を生み出す神経基盤の遺伝学的解析の戦略的展開」
- 研究代表者:
- 岡野 栄之(慶應義塾大学 医学部生理学教室 教授)
- 研究期間:
- 平成22年3月~平成26年3月
研究の背景と経緯
今回の研究は、今まで霊長類では成功していなかった特定の遺伝子を破壊して、機能できなくした標的遺伝子ノックアウトモデル動物の作製を試みたものです。具体的には、受精卵の中にある標的遺伝子を直接編集する事が可能なゲノム編集という技術を用いて、霊長類の一種であるマーモセットの標的遺伝子ノックアウトを試みたものです。従来は編集された遺伝子による遺伝子発現の変化が科学的に証明されていなかったためライフサイエンス研究に有用な霊長類モデルの作製が可能であるか不明でした。
今回の研究は、ゲノム編集による免疫不全マーモセットの作製に成功し、霊長類でも個体レベルで遺伝子をノックアウトすることによって動物の生理的性質(表現型)が変化したモデル動物作製が可能であることを世界で初めて明らかにしたものです。
研究の内容
まず、この免疫不全マーモセットを作製するため、標的となるマーモセットIL2rg遺伝子に特異的に結合して切断する人工ヌクレアーゼ(Zinc Finger Nuclease もしくはTALEN)を作製し、これを体外授精させた前核期の受精卵に注入した後、この胚でゲノム編集が成されているかについて新たな解析法を開発し、十分な検討を行いました(図1A)。今回、本研究グループが新たに考案した解析法は、作製したゲノム編集の人工ヌクレアーゼが目的の遺伝子のゲノム編集を行い、さらにゲノム編集された遺伝子を持って生まれてくる新生仔がゲノム編集前と異なる形質を持つかどうかを予測できる解析技術です。この技術の確立によってマウスよりも妊娠期間が長い霊長類で、ゲノム編集に失敗した新生仔を極力減らすことにより、研究を迅速に進めることが可能となりました。
次のステップとなる実際の個体の作製では、先述の評価を終えた人工ヌクレアーゼを導入したマーモセット受精卵を数日間培養し、正常に発生している受精卵のみを仮親の子宮に移植しました(図1B)。その結果、3頭の免疫不全マーモセットが、生後1年以上を経た現在も高度に衛生管理されたクリーン飼育室内で元気に生育しています(図2)。このマーモセットは、新生児期には免疫細胞の一種であるT細胞が殆ど欠落していましたが、生後半年を超えるとT細胞の増殖が認められました。この現象は特定のヒトの重症複合型免疫不全症の病態を反映するものであり、今後の治療法開発のモデル動物として注目されます(図3)。
今回、ゲノム編集により目的遺伝子が編集された霊長類において、生理的性質(表現型)の変化が認められたのは世界で初めてです。この成功は、本研究グループが開発した「ゲノム編集が受精卵の中でどれだけ迅速に正確に起きているか」を判定する技術が開発されたためであり、今後、多くの疾患モデルマーモセットの作製に有用な技術となります。
今後の展開
さらに、今回開発された人工ヌクレアーゼの機能評価方法は、今後、多くの標的遺伝子ノックアウトモデルを作製する上で有効な方法であり、この方法の応用によりヒト自閉症や統合失調症など精神・神経疾患モデルをはじめとした様々な疾患のマーモセットモデルの開発が可能となりました。この成果により、マウスでは研究が困難な知覚、記憶、学習、思考、判断といった高次脳機能のメカニズムの解明や、高次脳機能障害の治療法の開発研究を霊長類であるマーモセットをモデルとして用いた新たな研究の発展が期待されます。
参考図
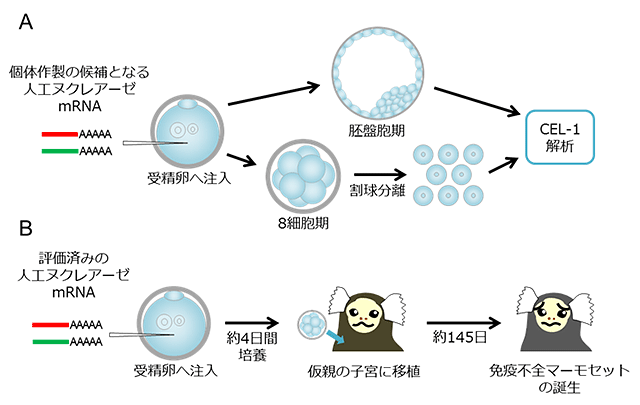 図1 免疫不全モデルマーモセット作製の流れ
図1 免疫不全モデルマーモセット作製の流れ
(A)目的とする免疫不全モデル個体の作製が可能であるかどうかを受精卵レベルで検討するための流れ。この解析を行うことで、遺伝子改変が起こらない(いわゆるハズレ個体)の出現率などが推定できる。CEL-1解析: わずかな遺伝子の欠損や挿入を検出することができる解析手法
(B)個体作製の流れ。仮親の子宮に移植された受精卵は約145日間胎内で育ち、免疫不全マーモセットとして誕生する。
 図2 免疫不全モデルマーモセット
図2 免疫不全モデルマーモセット誕生した3匹のマーモセットは、現在もクリーン環境下で順調に成育している。
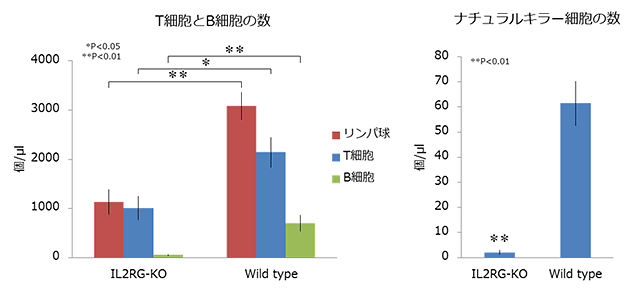 図3 血液解析の結果
図3 血液解析の結果
用語解説
- 注1)ゲノム編集:
- 人工的に合成された遺伝子を用いて生物内の任意の遺伝子を改変する技術の総称。
- 注2)トランスジェニック:
- 特定の外来遺伝子が人工的に細胞に導入され個体となった生物を指す。ただし、外来遺伝子が導入される部位はランダムである。
- 注3)標的遺伝子ノックアウト技術:
- 的遺伝子ノックアウト技術:生物の細胞や受精卵が生来持っている特定の遺伝子を破壊することで機能しないようにすること。
- 注4)mRNA:
- 元となる遺伝子からタンパク質合成の遺伝情報を写し取り、合成部位まで伝達することを担う1本鎖ヌクレオチド(塩基+糖+リン酸)。
論文名
お問い合わせ先
研究に関すること
佐々木 えりか(ササキ エリカ)
(公財)実験動物中央研究所 マーモセット研究部 部長
Tel:044-201-8545 Fax:044-201-8541
E-mail:esasaki“AT”ciea.or.jp
岡野 栄之(オカノ ヒデユキ)
慶應義塾大学 医学部生理学教室 教授
Tel:03-5363-3746 Fax:03-3357-5445
E-mail:hidokano“AT”a2.keio.jp
報道担当
(公財)実験動物中央研究所 広報担当:阪田 洋子
Tel:044-201-8510 Fax:044-201-8511
E-mail:ciea-office“AT”ciea.or.jp
慶應義塾大学 信濃町キャンパス総務課 谷口・吉岡
〒160-8582 東京都新宿区信濃町35
Tel:03-5363-3611 Fax:03-5363-3612
E-mail:med-koho“AT”adst.keio.ac.jp
AMED事業に関すること
日本医療研究開発機構 戦略推進部 脳と心の研究課
Tel:03-6870-2222 Fax:03-6870-2244
E-mail:brain“AT”amed.ac.jp
※Eメールは上記アドレス“AT”の部分を@に変えてください。
掲載日 平成28年7月1日
最終更新日 平成28年7月1日


