プレスリリース 小児ミトコンドリア病の新規病因遺伝子の発見について―黒毛和種牛における虚弱子牛症候群との関連―
プレスリリース
千葉県がんセンター
千葉県こども病院
国立研究開発法人日本医療研究開発機構
発表のポイント
- 子宮内発育遅延、脂肪肝、成長障害、難聴、糖尿病などを呈するミトコンドリア病の症例に対して包括的遺伝子解析を行い、IARS(IARS;イソロイシルtRNA合成酵素)遺伝子を新しい病因遺伝子として同定し、日・独・墺3カ国の国際共同論文として米国人類遺伝学会雑誌に報告した。
-
元々IARS異常症は、黒毛和種牛の遺伝病である「虚弱子牛症候群」の原因の一つとして知られている。
-
ヒト、牛のIARS異常症で共通した症状は、子宮内発育遅延、出生後の成長障害、易感染性である。
- IARS異常症は、核の遺伝情報をもとに細胞質内で蛋白合成を行う過程における、トランスファーRNA(tRNA)の翻訳過程の異常であり、各種の蛋白合成が障害された結果、様々な症状に結びつくと考えられる。
- 今後は、医師、獣医師、研究者が連携して人畜共通の遺伝性疾患の解明及び克服に取り組んでいく必要がある。
研究の背景
概要
ヒトIARS異常症の特徴
IARS遺伝子異常は、子宮内発育遅延、乳児期から肝障害(脂肪肝)、低身長などの成長障害、難聴、糖尿病などの症状を引き起こします。3カ国の3症例の症状の内訳は、周産期の成長障害(3/3)、知的障害(3/3)、亜鉛欠乏(3/3)、筋緊張低下(2/3)、肝臓の脂肪変性や繊維化(2/3)、糖尿病・難聴(1/3)、易感染性(1/3)となっています。
特に新生児期からの脂肪肝を伴う肝障害(ミトコンドリア肝症)はヒトIARS異常症の特徴です(図1;日本の症例)。オーストリアの症例は感染を契機に胆汁うっ滞、凝固障害が進行し、肝不全に陥っています(のちに改善)。
また、下記のようにミトコンドリア呼吸鎖酵素活性の低下を線維芽細胞、筋肉、肝臓などで認めます。
ミトコンドリア呼吸鎖酵素活性:
日本症例:線維芽細胞;呼吸鎖酵素複合体I、IVの低下(クエン酸合成酵素比でそれぞれ37、41%)
ドイツ症例:筋肉;呼吸鎖酵素複合体I、IV、ピルビン酸脱水素酵素(PDH)の低下(正常コントロール比でそれぞれ77、52、64%)
オーストリア症例:呼吸鎖酵素複合体 Iの低下(正常コントロール比で46%)
図1 肝臓の組織像(日本人症例)
全体的に脂肪変性と門脈域の線維化を認めるが、炎症細胞浸潤や胆汁うっ滞、銅の沈着等は認めない。
(A:HE染色)
肝細胞の胞体は明るく、軽度の架橋形成(bridging fibrosis)を認める。
(B:鍍銀染色)
局所的に門脈域線維化、架橋形成を認める。
(C:PAS+ヘマトキシリン染色)
大小の脂肪滴を認め細胞質のグリコーゲンを圧排している(矢印)。Kupffer細胞の中にセロイド色素を認める。
(D:抗マクロシアリン/CD-68免疫染色)
(C)に一致してKupffer細胞のクラスターを認め、細胞死や貪食反応が示唆される。
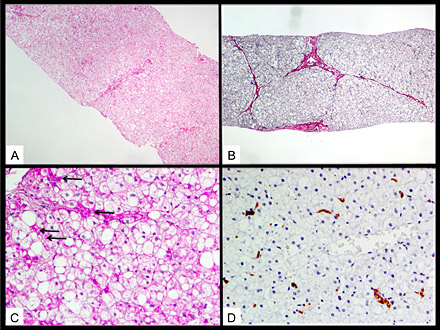
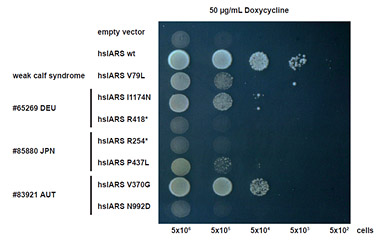
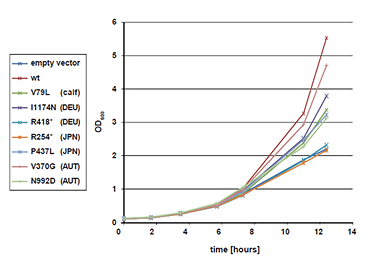
図3 ヒト及び牛IARS異常症で見出された変異の病原性確認実験
ヒト(I1174N, R418*, R254*, P437L, V370G, N992D)及び牛(V79L)IARS異常症で見出された変異を酵母に導入し、ドキシサイクリン添加(50μg/mL)条件下で培養し、その成長を野生型IARS(wt)を導入した酵母と比較した。
(A) 横軸は固形培地に蒔く酵母の個数を示す。ドキシサイクリン添加下ではIARSを導入しない(empty vector)と酵母は増殖できない。野生型IARS(wt)を導入すると少ない個数(5x103)でも酵母は増殖できるのに対し、変異導入細胞(ヒト、牛とも)では野生型に比して蒔く酵母の個数を減らすとすぐに増殖不能となる。
(B) 液体培地にドキシサイクリンを添加し一晩培養を行い、変異導入細胞の成長状況をOD600で評価した。変異導入細胞は明らかに成長が鈍化している。
図3-A
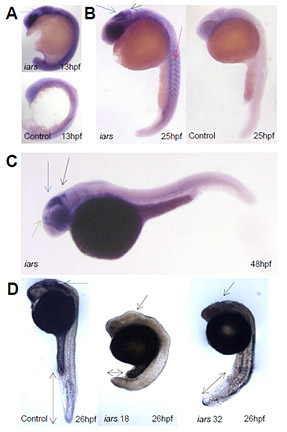
IARS はゼブラフィッシュにも存在しており、ヒト蛋白と74%の相同性を有する。IARS は、初期胚の時にはゼブラフィッシュの組織・臓器全体に発現し、次第に体節や原腸陥入後の脳に発展していく領域、特に脳の被蓋領域、松果体、後脳に局在していく。IARSのノックダウンにより、成長障害、脳の形成不全が生じる。
(A)~(D)はゼブラフィッシュの発達段階の側面像
(A)受精後13時間(13hpf)でのin situ hybridizationしたIARS mRNAとセンスRNAコントロール。IARSの発現は体節や脳になる領域に局在している。矢印は中脳。
(B)受精後25時間。IARSは被蓋(青矢印)、小脳(黒矢印)、体節(赤矢印)に局在している。センスコントロール(右図)は、シグナルが消失している。
(C)受精後48時間。IARSは脳の被蓋領域(青矢印)だけでなく、松果体(緑矢印)、後脳(黒矢印)に特異的に発現している。
(D)ゼブラフィッシュ胚にMOを注入して受精後26時間後(Exon18(中図)、32(右図)をターゲットにした)。IARSノックダウンにより発達障害、脳の形成不全を生じた(矢印は中脳と大幅に短くなった体軸を示す)。左図はコントロール。
黒毛和種牛におけるIARS異常症
IARS異常症はこれまで黒毛和種(黒毛和牛)において、虚弱子牛症候群(低出生体重、哺乳困難、免疫不全、貧血、低栄養、発育不全などを呈する)を来す常染色体劣性遺伝病として知られており(写真1)、保因牛同士の交配によりその子牛の1/4が発症、その約半数は早期に胚死滅し、出生した発症子牛も生後10ヵ月齢までにその約80%は死亡あるいは淘汰されます。黒毛和種牛の虚弱子牛症候群のうち約30%がIARS異常症であり、2014年には農林水産省の指定遺伝病となり、保因種雄牛が公表されています。近年の調査でも繁殖雌牛の約10%、種雄牛の約5%と高い頻度で原因遺伝子を保有しており、保因牛同士の交配を避けることでIARS異常症の発症は減少しつつあるものの、依然として畜産農家の経営を圧迫する重要な疾患です。
写真1 IARS遺伝子異常を有する黒毛和種牛

ヒト・牛IARS異常症に共通した症状
IARS異常症は、核の遺伝情報をもとに蛋白合成を行う過程において、トランスファーRNA(tRNA)にイソロイシンを結合させる酵素(IARS;イソロイシルtRNA合成酵素)の働きが低下することに起因します。これによって遺伝情報の翻訳が進まず蛋白合成が低下し様々な組織障害・臓器障害を引き起こします。
まとめ
今回の研究成果は、黒毛和種牛で問題となっているIARS異常症が、ヒトでもミトコンドリア障害を伴って発症することを示した世界初の報告です。特に黒毛和種牛を有する我が国で、IARS異常症は畜産業界やその食文化に多大な影響を及ぼす重要な問題でもあります。ヒトでも似た症状を呈するIARS異常症が発見されたのを契機に、本症は、医師、獣医師、研究者と、それを取り巻く医療、畜産業界がそれぞれ知恵を出し合いながらオールジャパン体制で克服しなければならない問題であり、今後更なる病態解明及び創薬研究へ発展させていく必要があります。
最後に、希少難病は日本だけで解決していくことは難しい現状があります。今回は、医師、獣医師、研究者の国際連携によって、似たような症状を有する症例が同じ遺伝子異常を有しているということをきっかけにして、IARS遺伝子が病因遺伝子であるとの解明につながりました。これまでも私たちのグループは、ミトコンドリア病を引き起こす新しい病因遺伝子を、国際連携することにより報告してきており、国際連携の重要性は増してきています。

本研究は、日本医療研究開発機構(AMED)の難治性疾患実用化研究事業の研究費を用いて行われました。この研究成果は日本時間7月15日午前2時(現地時間7月14日正午)に米国人類遺伝学誌(The American Journal of Human Genetics)に発表されます。
なお本研究成果は、東京慈恵医科大学小児科、北里大学獣医学部大動物臨床学研究室、ハイデルベルグ大学病院小児科、ミュンヘン・ヘルムホルツ研究所、インスブルック医科大学等の協力のもと実現されました。
ミトコンドリア病(小児ミトコンドリア病)について
病気の概要
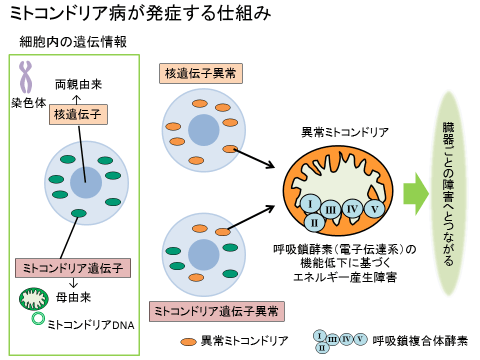
- 様々な臓器異常を起こすエネルギー産生異常の遺伝性疾患であり、2009年に指定難病になった。
- ミトコンドリアは、細胞の機能維持に必要なエネルギーを産生する器官で、あらゆる細胞・組織・臓器に存在する。
- どこの組織・臓器のミトコンドリアが、どれだけ異常を起こすかにより、様々な症状が出る(組織・臓器特異性がある)。
- 脳卒中発作や筋力低下、心筋症、白内障、肝不全のほか、難聴やけいれん、知能の発達障害等が起こる。
- ミトコンドリア遺伝子は37種類全てでミトコンドリア病が見つかっているのに対して、核遺伝子は1000~1500種類が推定され、現時点でまだ2割程度しか見つかっていない。
新生児~小児のミトコンドリア病
- 多くは両親から受け継いだ核遺伝子が原因とされる(1/4の確率で発症する常染色体劣性遺伝が多い)。
- ミトコンドリア遺伝子は、父親からは伝わらず母親からのみ伝わるが、母親がミトコンドリア病でもこどもが発症しない例もある(逆もある)。
疫学
- 本邦でミトコンドリア病の包括的な調査がされておらず、患者数や頻度は明らかではない
- 我々の研究からも本邦での発症頻度は欧米と同様におよそ約5000人に対し1人と推定されている。
治療の現状
- これまでは、発熱やけいれんを抑える薬を投与するなど対症療法が中心だった。
- 最近では、候補治療薬の企業による臨床試験(治験)や医師主導治験が進んでいる。
 2016年7月10日(日)日本経済新聞村山取材記事を元に資料作成
2016年7月10日(日)日本経済新聞村山取材記事を元に資料作成
お問い合わせ先
本件に関するお問い合わせ先
千葉県がんセンター
事務局医事経営課
Tel:043-264-5431
AMED事業に関するお問い合わせ先
国立研究開発法人日本医療研究開発機構
戦略推進部 難病研究課
Tel:03-6870-2223
E-mail:nambyo-info“AT”amed.go.jp
※E-mailは上記アドレス“AT”の部分を@に変えてください。
関連リンク
掲載日 平成28年7月15日
最終更新日 平成28年7月15日


