脳内マリファナがてんかんを抑えるしくみを解明
プレスリリース
発表者
- 菅谷 佑樹 (東京大学大学院医学系研究科 機能生物学専攻 神経生理学分野 助教)
- 山崎 真弥 (新潟大学脳研究所 細胞神経生物学分野 助教)
- 内ヶ島 基政(北海道大学大学院 医学研究科 解剖学講座 解剖発生学分野 助教)
- 小林 憲太 (生理学研究所 ウィルスベクター開発室 准教授)
- 渡辺 雅彦 (北海道大学大学院 医学研究科 解剖学講座 解剖発生学分野 教授)
- 崎村 建司 (新潟大学脳研究所 細胞神経生物学分野 教授)
- 狩野 方伸 (東京大学大学院医学系研究科 機能生物学専攻 神経生理学分野 教授)
発表のポイント
- 脳内マリファナの一種である2-アラキドノイルグリセロール(2-AG)がてんかんを抑制するメカニズムを明らかにした。
- 2-AGが複数のメカニズムを介して神経細胞への興奮性入力を低下させ、てんかんの症状であるけいれん発作や、てんかんの発症を抑制することを明らかにした。
- 脳内マリファナの働きを利用した新しい抗てんかん薬の開発につながる可能性がある。
発表概要
マリファナに含まれる精神作用物質(カンナビノイド)は脳内のカンナビノイド受容体と呼ばれる蛋白質に作用する。しかし、もともと脳の中にはカンナビノイド受容体に作用する物質が存在し、シナプス伝達を調節するなどの生理機能を営んでいる。このような脳内のマリファナ類似物質を“内因性カンナビノイド”と呼んでいる。
今回、東京大学大学院医学系研究科の狩野方伸教授らの研究グループは、主要な内因性カンナビノイドである2-アラキドノイルグリセロール(2-AG)がてんかん(注1)の症状であるけいれん発作を強力に抑制していることを明らかにした。遺伝子操作によって2-AGを作ることができないようにしたマウスでけいれん発作を誘発すると、野生型のマウスに比べて重篤なけいれん発作が観察された。さらに、2-AGが合成できないマウスではてんかんを発症するまでの時間が短くなっていた。これらの結果は2-AGがけいれん発作だけでなく、てんかんの発症を抑える効果をもつことを示唆している。
マウスで見出された本研究の成果は、てんかんの病態の解明と新しい治療法につながる可能性がある。
本研究は国立研究開発法人日本医療研究開発機構(AMED)の「革新的技術による脳機能ネットワークの全容解明プロジェクト」(平成27年度に文部科学省より移管)および科学研究費補助金の助成を受けて行われた。
発表内容
研究の背景
研究内容
本研究グループは、2-AGがけいれん発作に与える影響を明らかにするために、2-AGの産生酵素であるDGLαが欠損したマウス(DGLαノックアウトマウス)、CB1受容体が欠損したマウス(CB1ノックアウトマウス)、および野生型マウスを用いて実験を行った。CB1ノックアウトマウスでは、けいれん誘発物質によるけいれん発作が野生型マウスと比べて起きやすくなっていた。さらに、DGLαノックアウトマウスでは、CB1ノックアウトマウスよりもけいれん発作が起きやすくなっており、けいれん発作による死亡率も上昇していた。この結果から、2-AGはCB1受容体だけでなく、CB1受容体以外にも働いてけいれん発作を抑制していると考えられた。2-AGの作用する受容体はCB1受容体の他にCB2受容体が知られているが、CB2受容体の脳における働きはこれまで明らかになっていなかった。そこで、CB1ノックアウトマウスにCB2受容体の機能を阻害する薬を投与し、その後にけいれん発作を誘発したところ、DGLαノックアウトマウスと同等の重篤な発作が認められた。これらの結果から、2-AGがCB1受容体とCB2受容体を介してけいれん発作を抑制していることが示唆された。
次に2-AGによる発作抑制のしくみを詳細に明らかにするために、海馬歯状回にターゲットを絞り歯状回の主要な神経細胞である顆粒細胞に対するシナプス入力を計測した。DGLαノックアウトマウスの顆粒細胞では、海馬内からの興奮性シナプス入力と、海馬外からの興奮性シナプス入力が増大していた。一方、CB1受容体のみを薬によって阻害した野生型マウスでは海馬内からの興奮性シナプス入力だけが増大していた。したがって、2-AGは複数の脳領域からの顆粒細胞への興奮性シナプス入力を異なる機序で抑制することで、発作を抑制していることが明らかとなった(図1)。
さらに2-AGの働きを利用したてんかん治療の可能性を検討するために、自発的にけいれん発作が繰り返し出現するモデルマウスを用いて実験を行った。2-AGの分解を薬により阻害して2-AGの量を増やすと自発けいれん発作の回数が減少したことから、2-AGの働きを強くすることで、てんかん患者でみられるような自発的に繰り返されるけいれん発作を抑制できる可能性が示唆された。
一部のてんかんでは、外傷や熱性けいれんなどがきっかけとなって神経回路に変化が起き、後に進行して繰り返し発作を起こすようになる、すなわちてんかんを発症する。このような異常な神経回路(てんかん焦点)の形成に対する2-AGの影響を検討したところ、DGLαノックアウトマウスでは野生型マウスと比べててんかん焦点が早く形成され、逆に2-AGの量を増やすとてんかん焦点の形成が遅くなった。この結果から、2-AGはけいれん発作を抑制するだけでなく、てんかんの発症も阻止していることが明らかとなった。
社会的意義
発表雑誌
論文タイトル:Crucial roles of the endocannabinoid 2-arachidonoylglycerol in the suppression of epileptic seizures
著者:Yuki Sugaya, Maya Yamazaki, Motokazu Uchigashima, Kenta Kobayashi, Masahiko Watanabe, Kenji Sakimura, Masanobu Kano*
お問い合わせ先
本研究に関すること
東京大学大学院医学系研究科機能生物学専攻神経生理学分野
教授 狩野 方伸(かのう まさのぶ)
Tel:03-5802-3314, 03-5841-3538
Fax:03-5802-3315
E-mail:mkano-tky“AT”m.u-tokyo.ac.jp
AMED事業に関すること
国立研究開発法人日本医療研究開発機構 戦略推進部脳と心の研究課
Tel:03-6870-2222
Fax:03-6870-2244
E-mail:brain“AT”amed.go.jp
※E-mailは上記アドレス“AT”の部分を@に変えてください。
用語解説
- (注1)てんかん
- 突然出現する発作症状を繰り返す脳の疾患。てんかんで起こる発作にはけいれん発作のほかに、けいれんを伴わない意識の消失、感覚の変化など、多彩な症状がある。繰り返しこのような発作症状が出現した場合にてんかんを発症したと診断される。
- (注2)シナプス
- 情報を出力する神経細胞と入力される神経細胞の間に形成される情報伝達に関与する接合構造。神経細胞ではシナプスを介して情報が入力する。
- (注3)内側側頭葉てんかん
- てんかん発作が海馬やその周辺領域から始まるてんかん。海馬歯状回に特徴的な神経回路の変化が認められることが多く、薬物療法に対して治療抵抗性である。
- (注4)海馬歯状回
- 海馬は主に記憶を司る脳領域の一部で歯状回、CA1、CA2、CA3という小領域に別けられる。歯状回の主要な細胞は顆粒細胞と呼ばれている。顆粒細胞は海馬外の脳領域や、海馬内から興奮性のシナプス入力を受けている。
添付資料
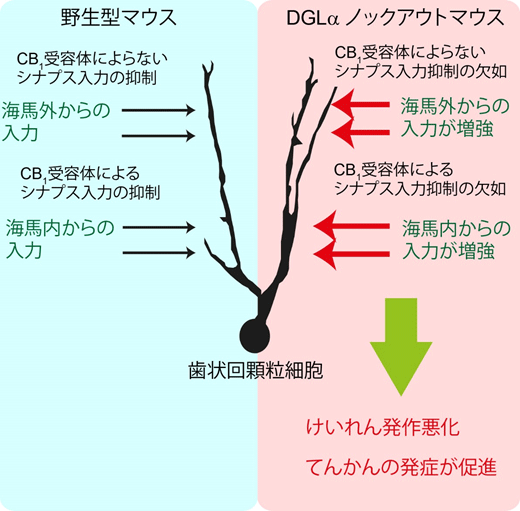
図1:図内左は野生型マウスの、右は内因性カンナビノイド2-AGが合成できないDGLαノックアウトマウスの歯状回顆粒細胞へのシナプス入力を模式的に表している。DGLαノックアウトマウスではCB1受容体によるシナプス入力の抑制とCB1受容体によらないシナプス入力の抑制が起きず、発作が悪化し、てんかんが発症しやすい。
掲載日 平成28年7月22日
最終更新日 平成28年7月22日


