プレスリリース アルツハイマー病の新たな抗体治療に道をひらく―アミロイド凝集前の病態シグナルを治療の分子標的に―
プレスリリース
国立大学法人東京医科歯科大学
国立研究開発法人日本医療研究開発機構
ポイント
- アミロイド凝集前に起きるリン酸化シグナルの病態意義を明らかにしました。
- リン酸化シグナルを惹起する細胞外分子を同定しました。
- 本細胞外分子に対する抗体治療がアルツハイマー病モデルマウスの病態抑制と症状改善につながることを示しました。
東京医科歯科大学・難治疾患研究所/脳統合機能研究センター・神経病理学分野の岡澤均教授の研究グループは、アミロイド凝集前にリン酸化の異常変動を示すタンパク質MARCKSを先行研究で同定しましたが、今回の研究で、MARCKSの上下のシグナル経路と病態意義を明らかにし、さらにMARCKSのリン酸化を誘導する細胞外分子HMGB1を標的とする抗体治療法を開発しました。この研究は、理化学研究所・宮脇敦史・副センター長、同・西道隆臣チームリーダー、名古屋大学・祖父江元特任教授、創価大学・中嶋一行教授、MBL・梶川益紀博士らとの共同研究として行われ、平成26年度から始まった文部科学省『革新的技術による脳機能ネットワークの全容解明プロジェクト』(平成27年度から日本医療研究開発機構:AMEDへ移管)の支援のもとで実施されたもので、その研究成果は、国際科学誌Scientific Reports(サイエンティフィック レポーツ)に、2016年8月25日午前10時(英国時間)にオンライン版で発表されます。
研究の背景と結果の概要
アルツハイマー病を初めとする神経変性疾患は、細胞の内外に異常タンパク質が蓄積することが病理学的な特徴です。アルツハイマー病では、細胞外にアミロイドベータ(注1)と呼ばれる異常タンパク質が沈着する老人斑と、細胞内にタウタンパク質が凝集する神経原線維変化の2つが起こることが知られています。これまで数々の治療法が試みられてきましたが、十分な有効性を示すものは得られていません。特に、約15年前からアミロイドベータに対する抗体医薬品の臨床試験が国際的な規模で行われてきましたが、脳内のアミロイドベータ除去に成功したものの、患者の症状は改善が見られないことも予想外の知見として得られました。このため、脳内にアミロイドベータ凝集が起きた後から治療を開始するのでは既に遅く、アミロイドベータの脳内での溜まり始めにアミロイド抗体療法を開始する、あるいは、脳内にアミロイドベータ凝集が起きる以前の超早期(Phase 0)に生じる脳内分子変化を解明して、新たな分子標的に対する治療を開発する必要があると考えられるようになってきました。
結果1.岡澤教授の研究グループでは先行研究(平成22年度~26年度の文部科学省『脳科学研究戦略推進プログラム』課題E)で、超早期(Phase 0)に生じる脳内分子変化について、最新の網羅的リン酸化ブロテオーム解析技術を用いて検討し、結果として、超早期から凝集、発症にかけて変化する17個の主要リン酸化タンパク質と、そのうち超早期変動を示す3個のリン酸化タンパク質(MARCKS, Marcksl, SRRM2)を同定しました(Tagawa et al, Hum Mol Genet 2015)。このうち、MARCKSはprotein kinase C(PKC)によってリン酸化を受ける基質タンパク質として知られ、MarckslはMARCKS類似タンパク質です。
そこで本研究では、MARCKSタンパク質中の多数のリン酸化部位のどの場所がアルツハイマー病態に重要なのかを、アルツハイマー病モデルマウスでの変動開始時期、アルツハイマー病ヒト死後脳での結果との比較、候補部位に対するリン酸化抗体による形態学的解析、などから絞り込みを行いました。その結果、Ser46部位のリン酸化が超早期(アミロイド凝集前)から上昇すること、Ser46部位でリン酸化したMARCKSタンパク質(pSer46-MARCKS)に対する抗体が脳内アミロイド斑周囲に集まる変性神経突起を染色すること、を認めました。
さらに、pSer46-MARCKSの病態意義を検討しました。MARCKSは細胞膜のタンパク質PIP2と結合する一方で細胞骨格タンパク質アクチンとも結合し、細胞の形をつくる機能があると考えられ、この機能は興奮性シナプス(注2)の後部構造であるスパインの形成・維持にも影響していると考えられています。他のグループの研究から、MARCKSの別のアミノ酸部位におけるリン酸化は、MARCKSと細胞骨格タンパク質アクチンとの結合力を弱めて、スパイン形成に悪影響を与えるという結果の報告があります(Neuron 48, 77-90, 2005)。調べてみると、Ser46部位のリン酸化についても同様にアクチンとの結合力を弱める効果があることが分かりました。
結果2.次に、MARCKSのSer46部位でのリン酸化が、どのような刺激によって誘導されるのかを調べました。アミロイドベータが細胞外に溜まる前には、いくつかの形態学的変化が起きると考えられています。例えば、タウタンパク質の凝集は、アミロイド凝集に引き続きて起きるものと長らく信じられてきましたが、近年ではその時間的な前後関係が必ずしもそうではないのではないかと議論の的になっています。さらに、アルツハイマー病モデルマウス、家族性アルツハイマー病患者の脳では、細胞内アミロイド沈着が観察されており、特にモデルマウスでは細胞内アミロイド沈着が細胞外アミロイド凝集に先行して観察されます(Shoji et al, Mol Brain Res 85, 221-233, 2000; Chen et al, Scientific Reports 2015)。また、近年では細胞内アミロイドベータが主な所見と考えられるアミロイド前駆体タンパク質の遺伝子変異を持つ家系も日本発で報告されています(Tomiyama et al, Ann Neurol 2008; Umeda et al, J Neurosci Res 2011)。このようなことから、細胞内部の変化そのものがpSer46-MARCKS増加のトリガーになる可能性があります。
一方で、このような細胞内変化に伴って、細胞は多数のダメージシグナル分子DAMPs(damage-associated molecular patterns)(注3)を細胞外に放出します。その代表格はHMGB1(注4)と呼ばれるタンパク質であり、また、アミロイドベータもDAMPsの一つであることが知られています。また、DAMPsはTLR(Toll-like receptor)やRAGE(receptor for advanced glycation end products)と呼ばれる膜タンパク質と結合して、細胞障害性のシグナルを誘導することが知られています。そこで、HMGB1とアミロイドベータのpSer46-MARCKS誘導効果を調べると、HMGB1にその作用があることが分かりました。さらに、アルツハイマー病ヒト患者の髄液を調べると、進行の早い一部の患者でHMGB1が高い傾向にあることが示唆され、pSer46-MARCKSの増加がヒトADにおいても同様な病態意義を持つことを支持する結果でした。
結果3.最後に、細胞外からのHMGB1刺激を抑制するためにHMGB1抗体を作成して、アルツハイマー病モデルマウスを用いて治療効果を調べてみました。その結果、HMGB1抗体は脳内のpSer46-MARCKS増加を抑えること、シナプス後部構造スパインの減少を回復させること、そして認知機能障害を改善することが示されました。
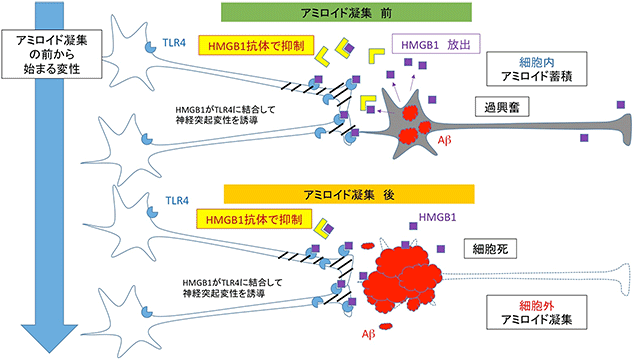
図の説明:
アミロイドの細胞外凝集(老人斑)が形成される以前より、細胞内アミロイド蓄積のある神経細胞、過度の興奮状態にある神経細胞、あるいはその両者の合併した状況では、ダメージシグナルとして細胞外にHMGB1が放出される。HMGB1は周辺の神経細胞の膜受容体TLR4に結合してMARCKSのリン酸化につながる異常なシグナルを誘導する。その結果、神経突起変性を引き起こす。HMGB1抗体療法は、HMGB1の細胞外拡散を防ぐことで、神経突起変性を抑制し、認知症の症状を抑制する。
研究成果の意義
用語の解説
- 注1:アミロイドベータ
- アルツハイマー病の病理像を特徴付ける分子であり、病理学的にアミロイドベータが脳内特に細胞外に沈着していること(老人斑)をもって、アルツハイマー病と診断している。細胞の膜タンパクであるアミロイド前駆体タンパク質が2つの酵素(ベータセクレターゼ、ガンマセクレターゼ)によって切断を受けて産生される40から42、3のアミノ酸からなるペプチドである。構造上、互いに会合しやすく凝集体を形成する。かつては、老人斑のような巨大な凝集体に毒性があると考えられていたが、オリゴマーと呼ばれる凝集前の状態にも毒性があることが分かっている。
- 注2:興奮性シナプス
- 神経細胞が次の神経細胞に電気的興奮を伝える構造をシナプスと呼び、遠心路(軸索)の終末(軸索終末もしくはシナプス前部)と求心路(樹状突起)の先端部(シナプス後部)によって構成される。シナプス前部からはシナプス小胞に含まれる伝達物質が放出され、シナプス後部の受容体を介して化学的伝達を電気的伝達に変換する。シナプス後部の受ける電気的伝達には脱分極と過分極の二つがあり、それぞれが興奮性シナプス、抑制性シナプスと呼ばれる。興奮性シナプスのシナプス後部は小さな突起となっており、これをスパインと呼ぶ。
- 注3:DAMPs
- ダメージを受けた細胞が細胞外に放出する分子群のこと。HMGB1、S100などのタンパク質以外に、尿酸、RNA、DNA、ヘパラン硫酸なども含まれる。多くは炎症を惹起して周辺細胞に悪影響を与える。アミロイドベータもDAMPの一つと考えられている。Toll-like receptor(TLR)はDAMPsの受容体として代表的なものである。
- 注4:HMGB1
- High mobility group box1の略称。細胞の核内に豊富に存在する概ね215個のアミノ酸で形成されるタンパク質であり、DNA構造を変換する働きを持っている。この働きは、転写、複製、DNA損傷修復など重要な核機能を果たす上で必須なものと考えられている。近年、細胞質にもHMGB1は移行して、オートファジーやミトコンドリアDNA損傷修復にも働くことが示されている。このような細胞生存に必須なタンパク質であるが、細胞がダメージを受けた場合には、細胞外に放出されて細胞障害もしくは炎症反応を惹起する。
お問い合わせ先
研究に関すること
神経病理学分野 岡澤 均(オカザワ ヒトシ)
TEL:03-5803-5847 FAX:03-5803-5847
E-mail:okazawa.npat“AT”mri.tmd.ac.jp
AMED事業に関すること
〒100-0004 東京都千代田区大手町1-7-1
TEL:03-6870-2222 FAX:03-6870-2244
E-mail:brain-pm“AT”amed.go.jp
報道に関すること
東京医科歯科大学 広報部広報課
〒113-8510 東京都文京区湯島1-5-45
TEL:03-5803-5833 FAX:03-5803-0272
E-mail:kouhou.adm“AT”tmd.ac.jp
※E-mailは上記アドレス“AT”の部分を@に変えてください。
掲載日 平成28年8月25日
最終更新日 平成28年8月25日


