プレスリリース ねらった遺伝子のスイッチをオンにする技術を開発―CRISPR/Casゲノム編集を応用したエピゲノム操作法―
プレスリリース
国立大学法人群馬大学
国立研究開発法人日本医療研究開発機構
本研究成果のポイント
- これまで、特定の遺伝子のみのスイッチを効率的にオンにすること(DNA脱メチル化)はできなかった。
-
CRISPR/Casゲノム編集を応用し、ねらった遺伝子のみのスイッチを効率的にオンにする技術を開発した。
- 本技術は、遺伝子のスイッチ異常により起こる疾患の治療、再生医療に利用可能。
概要
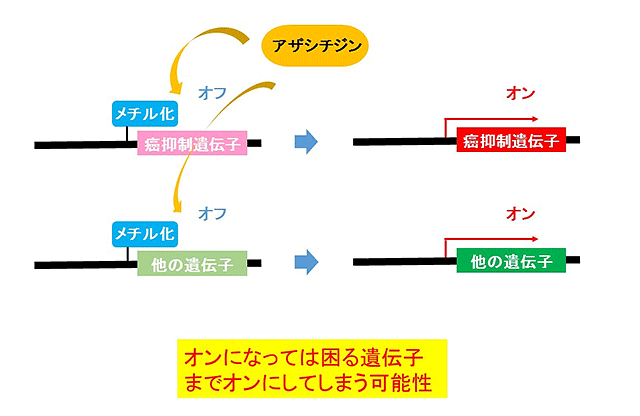
DNAのメチル化*1と脱メチル化は、遺伝子の発現にかかわるスイッチ(エピゲノム*2と定義されています)のひとつです。例えば、がんの増殖を抑える遺伝子のスイッチがオフになることで正常な細胞ががん細胞に変化することや、iPS細胞*3作製過程では特定の遺伝子(Oct-4)のスイッチをオンにする必要のあることが知られています。しかし、遺伝子のスイッチをオンにする従来の薬は、すべての遺伝子のスイッチ全部をオンにするものであり、オンになっては困る遺伝子までオンにしてしまうことによってひきおこされる副作用などの危険性がありました(図1)。
このたび、群馬大学生体調節研究所ゲノム科学リソース分野の畑田出穂教授、森田純代研究員、堀居拓郎助教らのグループは、九州大学大学院医学研究院の中島欽一教授、野口浩史特任助教及び国立成育医療研究センターの秦健一郎部長、中林一彦室長、岡村浩司室長らとの共同研究で、ゲノム編集法*4の技術を応用し、特定の遺伝子のみのスイッチを効率的にオンにする(DNA脱メチル化)技術を開発し、生体に適用させることに成功しました。この新しい技術により、抑制されていた癌抑制遺伝子をオンにするなどのエピゲノム療法*5や再生医療への応用が大きく広がることが期待されます。
本成果は米国の科学雑誌『Nature Biotechnology』オンライン版(米国時間8月29日付:日本時間 8月30日)に掲載されます。
図1 遺伝子のスイッチをオンにする従来の薬の問題点
背景
私たちの体には異なった働きをする様々な種類の細胞がありますが、細胞の種類が異なっても基本的に同じ遺伝子を持っています。では、どのようにして異なる細胞の個性が現れるのでしょうか?それは細胞中にある多くの遺伝子にはスイッチがあり、細胞の種類によって各々の遺伝子のスイッチのオン、オフは異なるからです。つまり、遺伝子には働いている(オン)のものと働いていない(オフ)の状態のものがあり、さらにどの遺伝子がオンになるかの組み合わせは細胞の種類によって違うのです。この遺伝子のスイッチをエピゲノムといい、いくつかの種類があります。その中でDNAメチル化はシトシン塩基*6のメチル化修飾のことで、メチル化されている遺伝子は一般にオフになり、脱メチル化されるとオンになることが知られています。
遺伝子のスイッチの異常は、様々な疾患でみられます。例えば、様々ながんでは、がんを抑制する遺伝子がオフになっています。また再生医療では、遺伝子のスイッチが重要な働きをしています。この分野では京大の山中教授の開発したiPS細胞など様々な細胞に分化できる万能細胞が用いられます。iPS細胞が万能性を持つのはOct-4という遺伝子がオンになっていることが1つの原因です。Oct-4は万能性のない細胞ではオフになっています。
遺伝子のスイッチを自在に操ることで、疾患の治療や再生医療に利用できることが期待されています。そこで、遺伝子のスイッチをオンにする薬(例:アザシチジン)が、悪性腫瘍の治療やiPS細胞の作製効率を上昇させるために使用されています。しかし、これらの薬は全部の遺伝子のスイッチをオンにしてしまうものであり、オンになっては困る遺伝子までオンにしてしまうことによる副作用などの危険性がありました。
2012年、CRISPR/Cas*7ゲノム編集法というねらった遺伝子のみを切断する技術が開発され、注目されています。この技術は、Cas9タンパク質が標的遺伝子の一部の配列を組み込んだガイドRNA(gRNA)と複合体を形成することで標的遺伝子を切断し破壊することができます。
成果
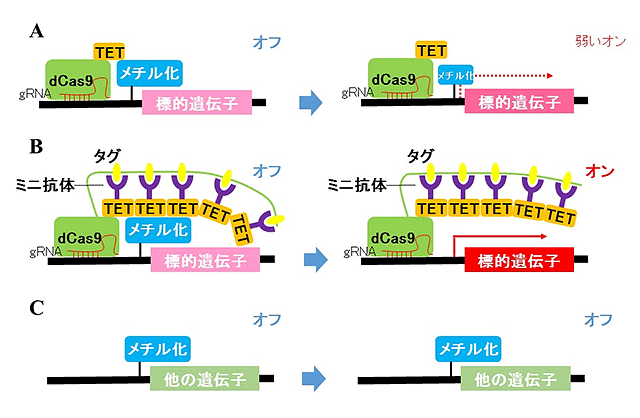
本研究では、まず遺伝子切断活性をなくしたCas9(dCas9)と、DNAのメチル化を外す最初の反応を起こす酵素(TET)を直結させました。この直結した蛋白が標的遺伝子に結合することで、TETの作用により脱メチル化して、標的遺伝子をある程度オンにできましたが、十分ではありませんでした(図2A)。そこで、脱メチル化能力を向上させるために、(1)dCas9の端に短い目印のアミノ酸配列(タグ)を複数個つないだものと(2)目印のアミノ酸(タグ)を認識して結合するミニ抗体にTETをつなげたものを同時に細胞に導入して新規複合体を構成させる方法を開発しました。それによって特定の遺伝子に複数のTETが作用し、効率的に脱メチル化されることがわかりました(図2B)。また上記複合体を作用させている状態で次世代シーケンサー*8によりすべての遺伝子のスイッチの状態を調べることにより、ねらった遺伝子のみのメチル化が外れ、スイッチがオンとなっており(図2B)、他の遺伝子はオンになっていない(図2C)ことを証明しました。このことにより、本技術により、危険性が低く特定の遺伝子のスイッチを安全にオンできることを証明しました。また、実際にこの技術を治療などに用いるためには、シャーレの中だけではなく生体内でこの技術が働くことが重要です。そこで、マウスの胎仔の脳にこの技術を適用したところ、有効に働くことが証明されました。
図2 ねらった遺伝子のスイッチだけをオンにする
社会的意義とこれからの展望
本研究は、文部科学省(2014年度)・日本医療研究開発機構(AMED)(2015年度以降)革新的バイオ医薬品創出基盤技術開発事業「新規CRISPR-Cas9システムセットの開発とその医療応用」(研究代表者:濡木 理)等の一環で行われました。
発表雑誌
- 雑誌名:
- 「Nature Biotechnology」オンライン版(米国時間8月29日付:日本時間 8月30日)
- 論文タイトル:
- Targeted DNA demethylation in vivo using dCas9-peptide repeat and ScFv–TET catalytic domain fusions
- 著者:
- Sumiyo Morita, Hirofumi Noguchi, Takuro Horii, Kazuhiko Nakabayashi, Mika Kimura, Kohji Okamura, Atsuhiko Sakai, Hideyuki Nakashima, Kenichiro Hata, Kinichi Nakashima, and Izuho Hatada*
*責任著者 - DOI 番号:
- 10.1038/nbt.3658
用語解説
- *1:DNAメチル化
- DNAはアデニン、シトシン、グアニン、チミンの4つの塩基を持ち、これにより遺伝情報をコードしていますが、シトシンは修飾酵素によりメチル化された状態のものと、脱メチル化された状態のものが存在します。これによりシトシンのコードする遺伝情報が変わるわけではありませんが、遺伝子のスイッチのオン(脱メチル化)、オフ(メチル化)が変化します。このような遺伝子のスイッチをエピゲノムといいます。
- *2:エピゲノム
- 遺伝子のスイッチのことです。私たちの体には異なった働きをする様々な種類の細胞がありますが、細胞の種類が異なっても基本的に同じ遺伝子を持っています。これは細胞中にある多くの遺伝子にはスイッチがあり、細胞の種類によって各々の遺伝子のスイッチのオン、オフは異なるからです。つまり、遺伝子には働いている(オン)ものと、働いていない(オフ)ものがあり、さらにどの遺伝子がオンになるかの組み合わせが細胞の種類によって違うのです。エピゲノムとしてはDNAのメチル化とヒストンの修飾があります。
- *3:iPS細胞
- 京都大学の山中教授が開発した、特定の遺伝子を導入することにより作成された、様々な細胞への分化が可能な万能細胞。再生医療への応用が期待されています。
- *4:ゲノム編集法
- ゲノム中の特定の遺伝子のみを切断する技術。特定の遺伝子を破壊したり改変したりすることができます。いくつかの方法がありますが、その中で2012年に開発されたCRISPR/Cas法は、Cas9タンパク質が標的遺伝子の一部の配列を組み込んだガイドRNA(gRNA)と複合体を形成することで標的遺伝子を切断し破壊することができます。
- *5:エピゲノム療法
- エピゲノムすなわち遺伝子のスイッチを変化させることによる治療法。脱メチル化をおこなうアザシチジンは骨髄異形成症候群の治療薬として使われています。もうひとつのエピゲノムであるヒストン修飾を変化させるものとしては、ボリノスタットが皮膚T細胞性リンパ腫の治療に用いられています。
- *6:シトシン塩基
- DNAの構成成分の中の塩基の1つ。塩基は遺伝情報を担っておりアデニン、シトシン、グアニン、チミンの4種類があります。中でもシトシンはDNAメチル化されることがあり遺伝子のスイッチとしての性質もあわせ持ちます。
- *7:CRISPR/Cas
- ゲノム編集法の1つ。最も簡便であることから2012年の開発以来、爆発的に利用されるようになっています。Cas9タンパク質が標的遺伝子の一部の配列を組み込んだガイドRNA(gRNA)と複合体を形成することで標的遺伝子を切断し破壊することができます。
- *8:次世代シーケンサー
- 一度にたくさんの遺伝情報を解読する装置。従来型のシーケンサーでは一度に最高で384個のDNA断片しか処理できませんでしたが、次世代シーケンサーでは一度に数千万から数億のDNA断片を処理できます。そのため以前はヒトのゲノムの遺伝情報を解読するのに13年で3000億円のコストがかかりました。しかし現在、次世代シーケンサーをもちいれば100万円以下のコストで数週間以内に解読することができます。
お問い合わせ先
研究に関すること
教授 畑田出穂
TEL:027-220-8111,8057
報道に関すること
庶務係長 金子友和
TEL:027-220-8822
国立研究開発法人日本医療研究開発機構(AMED)
経営企画部 企画・広報グループ
TEL:03-6870-2245
AMEDの事業に関すること
国立研究開発法人日本医療研究開発機構(AMED)
戦略推進部 医薬品研究課
革新的バイオ医薬品創出基盤技術開発事業担当
〒100-0004 東京都千代田区大手町1-7-1
TEL:03-6870-2219 FAX:03-6870-2244
掲載日 平成28年8月30日
最終更新日 平成28年8月30日


