iPS細胞由来網膜細胞の免疫拒絶反応モデルの開発―iPS細胞ストックを用いた網膜疾患の移植治療への一歩―
プレスリリース
国立研究開発法人日本医療研究開発機構
要旨
理化学研究所(理研)多細胞システム形成研究センター網膜再生医療研究開発プロジェクトの杉田直 副プロジェクトリーダーらの共同研究グループ※は、人工多能性幹細胞(iPS細胞)[1]から網膜色素上皮細胞(RPE細胞)[2]を分化・誘導し、それらを用いてサルとヒトの免疫拒絶反応モデルを開発しました。
2014年、網膜再生医療研究開発プロジェクトは、ヒトiPS細胞由来RPE細胞をシート状にし、滲出型加齢性黄斑変性[3]患者に世界で初めて移植しました(自家移植[4])。自家移植では自分の細胞を移植するため、術後に拒絶反応が起こる確率が極めて低いという特徴があります。しかし、自家移植は細胞培養のために膨大な時間と費用がかかるため、次の臨床試験では経費削減とより効率的に細胞の準備ができる「他家移植[4]」の実現を目指しています。他家移植には京都大学iPS研究所の再生医療用iPS細胞ストック[5]に保存されているヒト白血球抗原(HLA)[6]がホモ接合体[7]のドナーから作製したiPS細胞を使用する予定です。これらの細胞を利用すると、原理的には術後の拒絶反応は抑えられると考えられますが、実際に検証した報告は眼科領域ではありませんでした。
そこで、共同研究グループはまず、移植時の拒絶反応の要因となる主要組織適合抗原(MHC[8]、ヒトではHLA)がホモ接合体のカニクイザルからiPS細胞を樹立しました。そして、そのiPS細胞から分化・誘導したRPE細胞を他のカニクイザル(RPE細胞のMHCの型と一致する型を持つ個体と不一致の個体)の網膜に移植し、それぞれの個体の拒絶反応の有無を調べました。その結果、MHCの型が不一致のカニクイザルでは網膜に拒絶反応が起きました。一方、 MHCの型が一致のカニクイザルでは6カ月経過後も拒絶反応は起こりませんでした。
次に、ヒトiPS細胞からRPE細胞(少なくともHLA-A、HLA-B、HLA-DRB1の3座がホモ接合体)を分化・誘導しました。そして、そのRPE細胞と、ヒト血液から分離した末梢血単核球(PBMC)[9]およびCD4陽性T細胞[10]をそれぞれ共培養し、試験管内で免疫応答を調べました。その結果、HLAの型が不一致のPBMCとRPE細胞の組み合わせによる共培養では、コントロールに比べて炎症細胞(T細胞、B細胞など)が増加しました。一方、HLAの型が一致の組み合わせによる共培養では増加しませんでした。このことから、炎症細胞はHLA不一致のRPE細胞を認識し、HLA一致のRPE細胞を認識しないことが分かりました。
以上の結果は、再生医療用iPS細胞ストック由来のドナーとレシピエント(患者)のHLAを一致させることで、RPE細胞移植術後の拒絶反応が抑えられる可能性を示しています。
本研究は、日本医療研究開発機構(AMED)「再生医療実現拠点ネットワークプログラム 疾患・組織別実用化研究拠点(拠点A)」(平成27年度より科学技術振興機構から移管)、科学研究費補助金「基盤B」の支援を受けて行われました。
成果は、米国の科学雑誌『Stem Cell Reports』に掲載されるのに先立ち、オンライン版(9月15日付け)に掲載されました。
1.背景
人工多能性幹細胞(iPS細胞)は、多種類の細胞・組織に分化することができる細胞として注目され、基礎研究およびヒトへの臨床応用が進んでいます。理研多細胞システム形成研究センターの網膜再生医療研究開発プロジェクトは、患者自身の細胞をもとに作製したiPS細胞から網膜色素上皮細胞(RPE細胞)への分化・誘導に成功し、2014年、そのRPE細胞をシート状にして、滲出型加齢性黄斑変性患者に世界で初めて移植しました(自家移植)注1)。
現在、iPS細胞やRPE細胞の製造方法の確立、品質規格試験、安全性試験を引き続き行っています。
また、将来の標準治療になると考えられる「他家移植」の実現を目指し、研究を進めています。自家移植では自分の細胞を移植するため、術後に拒絶反応が起こる確率が極めて低いという特徴がありますが、細胞培養のために膨大な時間と費用がかかります。一方、他家移植は自分以外の人から作製したiPS細胞を使用するため、自家移植に比べて「経費を削減できる」「効率的に細胞の準備ができる」というメリットがあります。網膜再生医療研究開発プロジェクトは他家移植実現のため、ヒト白血球抗原(HLA)がホモ接合体のドナーから樹立したヒトiPS細胞由来RPE細胞(iPS-RPE細胞)が他家T細胞[10](iPS-RPE細胞のHLAの型と一致する型を持つT細胞)にどのように反応するかなどの実験を行っています。過去の海外での臨床試験の報告から、RPE細胞のHLAの型と移植を受けるレシピエント(患者)の型が不一致の他家移植は免疫拒絶反応が起こることが分かっています。HLAの型を一致させれば原理的には免疫拒絶は起こらないと考えられますが、実証した研究はこれまでありませんでした。
今回、共同研究グループは、サルおよびヒトの主要組織適合抗原(MHC、ヒトではHLA)がホモ接合体の個体からiPS細胞を樹立し、そこからRPE細胞へと分化・誘導しました。これらのiPS-RPE細胞を用いて、in vivo(生体内)動物モデルおよびin vitro(試験管内)ヒトモデルを作製し、MHC(HLA)一致、不一致で拒絶反応の有無について検証しました。
2.研究手法と成果
共同研究グループはまず、MHCがホモ接合体のカニクイザルからiPS細胞を樹立し、iPS-RPE細胞を誘導、さらにRPEシートを作製しました。そして、作製したRPEシートを他のカニクイザルへ他家移植を行い、移植したPREシートの生着と免疫拒絶反応の有無について調べました(図1)。移植は、iPS-RPE細胞のMHCの型と一致する型を持つ個体(MHC一致)および一致する型を持たない個体(MHC不一致)へ行いました。その際、いずれも免疫抑制剤は使用しませんでした。
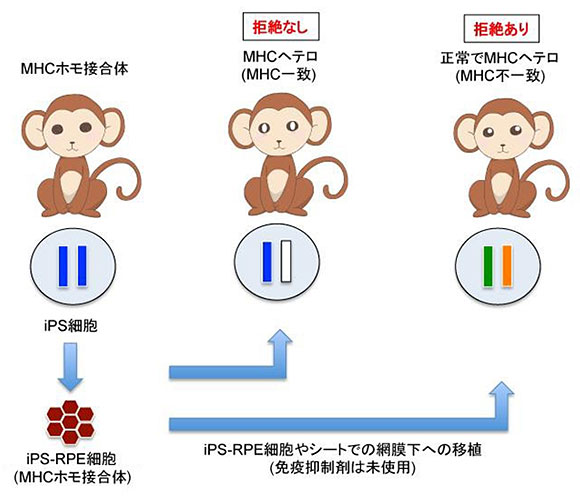 図1.サル個体を用いたMHCホモ接合体iPS細胞由来RPE細胞の他家移植と拒絶反応
図1.サル個体を用いたMHCホモ接合体iPS細胞由来RPE細胞の他家移植と拒絶反応
MHCがホモ接合体のカニクイザルからiPS細胞を樹立し、iPS-RPE細胞を誘導、RPEシートを作製した(左)。それらを他のカニクイザルの網膜下へ移植し(他家移植)、移植したシートの生着と拒絶反応の有無について調べた。MHC不一致のカニクイザルでは移植後に拒絶反応がみられ(右)、MHC一致の移植サルでは拒絶反応がみられなかった(中)。つまり、移植を受けたカニクイザルが、iPS-RPE細胞のMHCの型を一つでも持っていれば(この場合は青色)、拒絶反応を起こさないことを示している。
その結果、MHC不一致のカニクイザルでは、移植後まもない時期に拒絶反応が起きました。RPEシートは生着せず、移植した周囲では、網膜への炎症細胞浸潤、黄斑浮腫、網膜剥離などがみられました。さらに、時間が経つと網膜が薄くなり、移植部位は肉芽腫(肉芽組織からなる炎症性腫瘍)様に腫れて厚くなっているものもありました(図2A)。一方、 MHC一致のカニクイザルでは、6カ月経っても炎症はみられず、網膜はきれいな状態で、移植したRPEシートもきれいに生着していました(図2B)。
さらに、移植後の網膜の病理所見(パラフィン切片の免疫染色)では、MHC不一致のカニクイザルの眼では、網膜マイクログリアのマーカー、活性化した炎症細胞や抗原提示細胞のマーカー、T細胞のマーカーなどの炎症細胞が網膜内に浸潤していました。一方、MHC一致のカニクイザルの眼では、これらの炎症細胞の浸潤は軽度で正常眼に近いものでした。
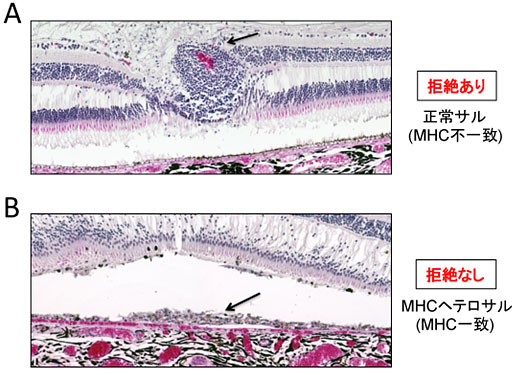 図2.他家移植後の網膜病理写真
図2.他家移植後の網膜病理写真
A.MHC不一致のカニクイザルの右眼のヘマトキシリン・エオジン(HE)染色写真。矢印で示す移植したiPS-RPEシートと思われる箇所に、肉芽腫様の激しい炎症細胞浸潤がみられた。
B.MHC一致のカニクイザルの左眼のHE染色写真。矢印で示す網膜下のiPS-RPEシートと思われる箇所の炎症細胞浸潤は軽度で、シートは移植部位にきれいに生着していた。
次に、ヒトiPS細胞由来RPE細胞(iPS-RPE細胞)についてin vitroでの免疫拒絶反応を調べました。まず、iPS細胞株454E2、453F2、Ff-I01(少なくともHLA-A、HLA-B、HLA-DRB1の3座がホモ接合体)から、iPS-RPE細胞を誘導しました。これまでの研究から、これら3座を合わせると、臓器移植や造血幹細胞移植で移植の成功率が高いことが分かっています。そこで、被験者26名の血液から免疫反応に関わる末梢血単核球(PBMC)とCD4陽性T細胞を分離し、iPS-RPE細胞とin vitroでそれぞれ共培養してその後の変化を解析しました。
PBMCは、ガンマ(γ)線を照射して増殖しないようにしたiPS-RPE細胞と96~120時間共培養し、免疫拒絶反応を調べました。その結果、iPS-RPE細胞にHLAクラスⅠ[11]が発現し、また、炎症性サイトカイン[12]であるインターフェロン-ガンマ(IFN-γ)[13]の存在下でHLAクラスⅡ[11]が発現しました。つまり、炎症下ではこのRPE細胞はHLAクラスII抗原を細胞表面に発現していて、これらが拒絶のターゲットになっている可能性を示しています。
また、細胞増殖試験の結果、HLA-A、HLA-B、HLA-DRB1が不一致のPMBCとiPS-RPE細胞の組み合わせによる共培養では、コントロール(PBMCのみ)と比べて、T細胞を中心にB細胞、抗原提示細胞などの炎症系の細胞が増加していました(図3A)。つまり、免疫拒絶反応が起きていました。一方、HLAの三つの型が一致するPBMCとiPS-RPE細胞の組み合わせによる共培養では、これらの炎症系の細胞の増加はみられず、免疫拒絶反応は起きていませんでした(図3B)。
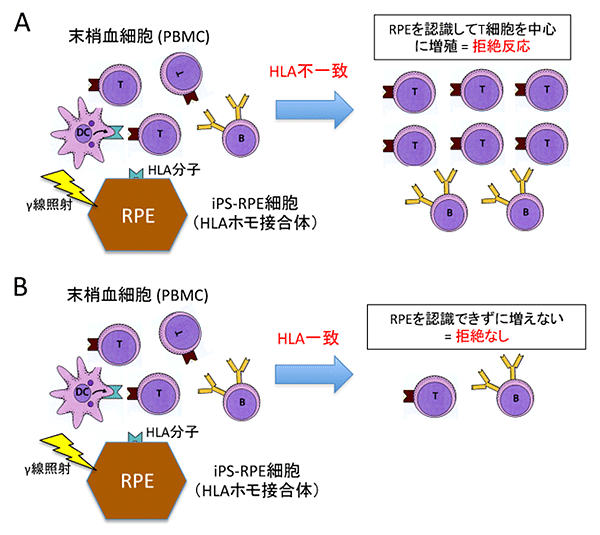 図3.iPS-RPE細胞を用いた他家細胞増殖試験
図3.iPS-RPE細胞を用いた他家細胞増殖試験
HLA-A、HLA-B、HLA-DRB1の3座がホモ接合体のiPS細胞から作製したiPS-RPE細胞と健常人の末梢血細胞(PBMC)を用いたヒトin vitro拒絶炎症モデル。γ線を照射して増殖しないようにしたiPS-RPE細胞とPBMCを96~120時間共培養した。
A.HLA-A、HLA-B、HLA-DRB1が不一致のPBMCとiPS-RPE細胞(他家)の組み合わせによる共培養での細胞増殖試験では、iPS-RPE細胞に対する免疫拒絶応答がありT細胞を中心に免疫系の細胞が増加した。つまり、拒絶反応を起こした。
B.HLAの三つが全て一致するPBMCとiPS-RPE細胞の組み合わせによる共培養では、免疫系の細胞の増殖がみられなかった。つまり、拒絶反応を起こさなかった。
CD4陽性T細胞は、iPS-RPE細胞と48時間培養後、その培養上澄み液のIFN-γ濃度を測定し、免疫拒絶反応を調べました。その結果、HLA-A、HLA-B、HLA-DRB1が不一致のCD4陽性T細胞とiPS-RPE細胞の組み合わせによる共培養では、コントロール(CD4陽性T細胞のみ)に比べてIFN-γの産生量が増加していました。つまり、免疫拒絶反応が起きていました。一方、HLAの三つの型が一致するCD4陽性T細胞(他家)とiPS-RPE細胞の組み合わせによる共培養では、IFN-γの産生量がコントロールと同じか、低下していました。つまり、免疫拒絶反応は起きていませんでした。
また、上澄み液を除去した細胞を用いて、IFN-γ陽性T細胞(IFN-γを産生するT細胞)のHLAの発現を細胞表面抗原解析法[14]で測定しました。その結果、IFN-γ陽性T細胞の割合は、HLA-A、HLA-B、HLA-DRB1が不一致のCD4陽性T細胞では、コントロールに比べて明らかに増加していました。一方、HLAの三つの型が一致するCD4陽性T細胞では低下していました。以上の結果より、“CD4陽性T細胞はin vitroでHLAの型が合わないiPS-RPE細胞を認識し、HLA型が合うiPS-RPE細胞を認識しない”ことが分かりました。
以上のin vivo動物モデルおよびin vitroヒトモデルの結果より、再生医療用iPS細胞ストック由来のドナーとレシピエントのHLAを一致させることで、RPE移植手術後の免疫拒絶反応が抑えられる可能性が示されました。一方で、HLA不一致での他家移植は拒絶反応のためにRPEシートが生着せず、移植付近の網膜が傷つくことが改めて確認されました。つまり、少なくともMHC(HLA)を一致させた移植がこの移植治療では必須であることが示されました。
3.今後の期待
2014年に実施した滲出型加齢性黄斑変性の臨床研究では、iPS細胞や最終産物であるRPE細胞の安全性に問題は見あたらず、RPEシート移植手術の手技的な問題もありませんでした。また、臨床研究は自家移植で行われたため拒絶反応や術後の炎症が起こらず、懸念された腫瘍形成についても術後2年以上経過した現在、問題はありません。
次のステップとして、網膜再生医療研究開発プロジェクトおよび関連機関(神戸市立医療センター中央市民病院、大阪大学、京都大学iPS細胞研究所)では、滲出型加齢性黄斑変性患者の移植治療の臨床研究に再生医療用iPS細胞ストックを利用した他家移植を行うことを計画しています注2)。もし、HLAが適合する患者の免疫炎症細胞がiPS-RPE細胞に反応せず(または反応低下)、実際に網膜内での拒絶反応が起きなければ、iPS細胞ストック由来の細胞移植が滲出型加齢性黄斑変性だけではなく、ほかの網膜移植医療への応用も期待できます。
4.論文情報
タイトル
- Successful transplantation of retinal pigment epithelial cells from MHC homozygote iPS cells in MHC-matched models
- Lack of T-cell response to iPS cell-derived retinal pigment epithelial cells from HLA homozygous donors
著者名
- Sunao Sugita, Yuko Iwasaki, Kenichi Makabe, Hiroyuki Kamao, Michiko Mandai, Takashi Shiina, Kazumasa Ogasawara, Yasuhiko Hirami, Yasuo Kurimoto & Masayo Takahashi
- Sunao Sugita, Yuko Iwasaki, Kenichi Makabe, Takafumi Kimura, Takaomi Futagami, Shinji Suegami & Masayo Takahashi
雑誌
Stem Cell Reports
DOI
- 10.1016/j.stemcr.2016.08.010.
- 10.1016/j.stemcr.2016.08.011.
5.補足説明
- [1]人工多能性幹細胞(iPS細胞)
- 脊椎動物の初期胚が持つ、全ての種類の体細胞へ分化する能力を多能性という。多能性を持ち、試験管内で培養して未分化なまま無限に増やすことができる細胞を多能性幹細胞という。iPS細胞は、成人の皮膚細胞などの体細胞・組織から採取した細胞にOct3、Sox2、Klf4遺伝子などを導入して初期化し多能性を持たせ、人工的に作製した多能性幹細胞である。iPSはInduced pluripotent stemの略。
- [2]網膜色素上皮細胞(RPE細胞)
- 網膜の最外側の層を覆う単層の組織。内側に神経網膜(視細胞)、外側に血管が豊富な脈絡膜がある。メラニン色素を含む茶色い細胞で、網膜内に入ってくる余分な光を吸収し散乱を防ぐなどの機能を持つ。また、視細胞外節を貪食することで、網膜のメンテナンスを行うという重要な機能を持つ。RPEはretinal pigment epitheliumの略。
- [3]滲出型加齢性黄斑変性
- 加齢などが原因で異常な血管(脈絡膜新生血管)が脈絡膜から網膜色素上皮の下、あるいは網膜と網膜色素上皮の間に侵入して網膜に障害が起こる病気。異常な血管は、血液の成分を漏出させたり、破れたりする。血液成分が漏出すると網膜が腫れたり(網膜浮腫)、網膜下に液体が溜まり(網膜下液)、網膜が正常に働かなくなり視力が低下する。血管が破れると出血し、網膜に障害を引き起こす。滲出性は欧米に比べアジアでの発症率が高い。
- [4]自家移植、他家移植
- 自家移植は自分の細胞・組織を自分の他の場所に移し変えること。他家移植は自分以外の細胞・組織を移し変えること。現在、行われている他家移植のほとんどは、同種他家移植でレシピエント(移植を受ける患者)と同一種(ヒト→ヒト)となる。
- [5]iPS細胞ストック
- ヒト白血球抗原(HLA)の型がホモ接合体の健康なボランティアから提供された細胞を使い、医療用のiPS細胞を作製してバンク化したもの。日本では京都大学iPS研究所が樹立した。患者自身の細胞を使う自家移植と比べると、格段に時間も費用も抑えられると考えられている。
- [6]ヒト白血球抗原(HLA)
- ヒトの赤血球を除くほぼすべての細胞に発現する組織適合性抗原。自他を認識する免疫機構として働き、移植医療やがんワクチンにはHLAの型が重要となる。HLA はhuman leukocyte antigenの略。
- [7]ホモ接合体
- 生物は遺伝子セット(ゲノム)を母から1セット、父から1セット受け継ぎ、2セット持っている。HLAやMHCも一つずつ両親から受け継ぎ2セット持っている。同じHLAやMHCを持つ生物をホモ接合体という。
- [8]主要組織適合抗原(MHC)
- 細胞膜に結合した糖タンパク質で、抗原がタンパク質分解酵素で分解されて生成するペプチドと結合し、T細胞に抗原として提示する働きをする分子。それぞれの個体には、似たような構造のMHC分子の遺伝情報を何種類も持ち、数種類のHMCを同時に発現させている。MHCが異なると臓器移植において拒絶抗原として働く。MHCはmajor histocompatibility complexの略。
- [9]末梢血単核球(PBMC)
- 血液から得られる血液細胞で主に白血球(生体防御に関わる免疫担当細胞)を示す。末梢血液内の白血球には、通常、好中球・好酸球・好塩基球・リンパ球・単球の5種類が含まれる。PBMCはperipheral blood mononuclear cellsの略。
- [10]CD4陽性T細胞、T細胞
- T細胞はリンパ球の一つで、機能を反映するサイトカインを産生することにより、免疫反応を制御する司令塔的役割を持つリンパ球。CD4陽性T細胞もT細胞の一つで、細胞表面にCD4分子を持ち、別名ヘルパーT細胞と呼ばれる。炎症時には免疫担当細胞の抗原提示細胞やB細胞などの他の炎症細胞に指令を出す働きを持つ。
- [11]HLAクラスⅠ、HLAクラスⅡ
- HLAはA、B、C、DR、DQ、DPなど多くの抗原の組み合わせで構成されており、大きく分けてA、B、CからなるクラスⅠ、DR、DQ、DPからなるクラスⅡに大別される。HLAクラスⅠは白血球だけにあるのではなく、ほぼ全ての細胞と体液に分布している。一方、HLAクラスⅡは限られた細胞(免疫担当細胞の抗原提示細胞やB細胞など)にしか存在しない。
- [12]サイトカイン
- 細胞に増殖、分化などの指令を伝える液性因子。炎症時に炎症を促進させる炎症性サイトカインと炎症を制御する抑制性サイトカインに分けられる。
- [13]インターフェロンガンマ(IFN-γ)
- 生体で分泌されるサイトカインの一つで、抗ウイルス作用のほか、抗腫瘍作用、免疫調節作用などの働きが知られている。インターフェロンには、α(アルファ)、β(ベータ)、γ、ω(オメガ)の4型がある。そのうち、インターフェロンガンマは、アレルギーに関連する抗体の産出を抑制する作用を持つ。また、局所炎症を増悪させたり組織傷害を起こす作用がある。
- [14]細胞表面抗原解析法
- 細胞に目的の抗原が発現しているかどうか、あるいは試料中に抗原陽性細胞がどのくらいあるかを調べる解析法。別名、フローサイトメトリー法(Flow cytometry)。
6.発表者・機関窓口
発表者 ※研究内容については発表者にお問い合わせください
理化学研究所 多細胞システム形成研究センター 網膜再生医療研究開発プロジェクト
副プロジェクトリーダー 杉田 直(すぎた すなお)
TEL:078-306-3305 FAX:078-306-3303
E-mail:retina-as“AT”cdb.riken.jp
機関窓口
理化学研究所 広報室 報道担当
TEL:048-467-9272 FAX:048-462-4715
E-mail:ex-press“AT”riken.jp
日本医療研究開発機構(AMED) 戦略推進部再生医療研究課
TEL:03-6870-2220 Fax:03-6870-2242
E-mail:saisei“AT”amed.go.jp
※E-mailは上記アドレス“AT”の部分を@に変えてください。
※共同研究グループ
- 理化学研究所 多細胞システム形成研究センター
- 網膜再生医療研究開発プロジェクト
副プロジェクトリーダー 杉田 直(すぎた すなお)
大学院生リサーチ・アソシエイト(研究当時) 岩崎 優子(いわさき ゆうこ)
研修生 真壁 健一(まかべ けんいち)
副プロジェクトリーダー 万代 道子(まんだい みちこ)
プロジェクトリーダー 高橋 政代(たかはし まさよ) - 川崎医科大学 眼科
- 講師 鎌尾 浩行(かまお ひろゆき)
- 東海大学医学部 基礎医学系分子生命科学
- 准教授 椎名 隆(しいな たかし)
- 滋賀医科大学 病理学講座 疾患制御病理学
- 教授 小笠原 一誠(おがさわら かずまさ)
- 京都大学 iPS細胞研究所
- 教授(研究当時) 木村 貴文(きむら たかふみ)
- HLA研究所 研究検査課
- 研究員(研究当時) 二神 貴臣(ふたがみ たかおみ)
研究員 末上 伸二 (すえがみ しんじ) - 先端医療センター病院 眼科
- 医長 平見 恭彦(ひらみ やすひこ)
- 神戸市立医療センター 中央市民病院 眼科
- 眼科部長 栗本 康夫 (くりもと やすお)
掲載日 平成28年9月16日
最終更新日 平成28年9月16日


