プレスリリース 「ハンチントン病の新しい治療薬シーズを発見」―化合物ライブラリーの統合的スクリーニングから意外な結果―
プレスリリース
国立大学法人東京医科歯科大学
国立研究開発法人日本医療研究開発機構
ポイント
- ハンチントン病の多様なモデル系を利用して治療薬シーズとなる化合物を統合的にスクリーニングしました。
- その結果、意外なペプチドに効果があることを発見しました。
- これらのペプチドはハンチントン病の疾患タンパク質凝集とは別な病態機序の改善を介して治療効果を発揮していました。
東京医科歯科大学・難治疾患研究所神経病理学分野の岡澤 均教授(脳統合機能研究センター長)の研究グループは、同・伊倉貞吉准教授(分子構造情報学分野)らとともに、ハンチントン病の治療薬シーズのスクリーニングとそこから得られた化合物の構造情報解析を行い、有望な候補ペプチドを得て、その作用機序を明らかにしました。 この研究は、カリフォルニア州立大学サンフランシスコ校/グラッドストーン研究所・Steven Finkbeiner教授、慶應義塾大学医学部・岡野栄之教授、産業技術総合研究所・富井健太郎研究グループ長、東北大学大学院情報科学研究科・山田和範博士らとの共同研究として行われ、平成21年度からの戦略的創造研究推進事業(CREST)『精神・神経疾患の分子病態理解に基づく診断・治療へ向けた新技術の創出』、平成22年度からの新学術領域研究『シナプス・ニューロサーキットパソロジーの創成』、平成26年度から始まった文部科学省『革新的技術による脳機能ネットワークの全容解明プロジェクト』(平成27年度から日本医療研究開発機構:AMEDへ移管)の支援のもとで実施されたもので、その研究成果は、国際科学誌Scientific Reports(サイエンティフィック レポーツ)に、2016年9月22日午前10時(英国時間)にオンライン版で発表されます。
研究の背景と結果の概要
アルツハイマー病、パーキンソン病、ハンチントン病、脊髄小脳失調症、筋萎縮性側索硬化症などの神経変性疾患は、それぞれに特異的な疾患タンパクの脳内凝集が病理診断の基準です。一方で、数十年来の研究から、病態にとっては、疾患タンパク質の凝集のみが意味があるのではなく、疾患タンパク質もしくは疾患RNAに起因する、多様な細胞機能の異常あるいは臓器間関係の異常が重要な意味をもっていることが、それぞれの疾患において明らかになってきました。
岡澤教授らは、オミックス解析(注1)と呼ばれる網羅的な分子情報解析を通じて、上記の問題に取り組んできました。その成果の一つとして、2010年に神経細胞において主要な役割を持つDNA損傷修復タンパク質Ku70(注2)が、ハンチントン病疾患タンパク質(変異型ハンチンチン)と結合して、その機能障害に至ることを明らかにしました(Enokido et al, J Cell Biol 2010)。これをベースとして、今回の研究では、変異型ハンチンチンとKu70の結合を阻害する低分子化合物を得て治療薬シーズとすることを目的としました。そこで、1次スクリーニングとして、1分子蛍光解析装置MF20(オリンパス社)によるin vitro結合阻害解析、及びコンピュータ上での結合シミュレーション、2次スクリーニングとして、1分子蛍光解析装置MF20によるin vitro結合阻害解析、3次スクリーニングとしてハンチントン病モデルショウジョウバエの寿命延長効果の解析、4次スクリーニングとして、ハンチントン病モデルマウスの運動機能改善および体重減少抑制効果の解析を行って、最終的に2個(もしくは、ややゆるい基準で3個)の候補化合物を得ました(図1)。さらに、ハンチントン病のヒト患者さん由来のiPS細胞を用いて、これらの候補化合物の治療効果を検証しました。
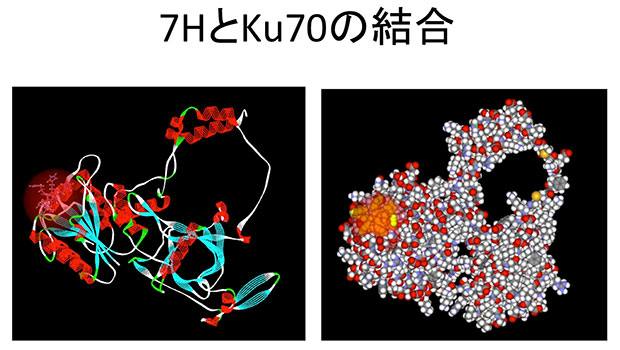
図1の説明: 7HはKu70分子の凹みに先にはまり込み、同じ部位で結合する変異型ハンチンチンのKu70への結合を阻害する。左右はKu70と7Hの結合を違った様式で示したもの。右図の淡い橙色の塊が7H。
これらは、いずれも数個のアミノ酸からなる短いペプチドであり、最も効果のあったのはヒスチヂンというアミノ酸が7個連続したペプチド(7H)でした。7Hは、Ku70と変異型ハンチンチンの異常な結合を抑制することも確認され、分子構造上、ある程度の共通性を持つことも分かりました。一方、ハンチントン病などの神経変性疾患は疾患タンパク質の凝集が病態に深く関与していると考えられています。そこで、動的光散乱法(注3)という技術を利用して、治療効果を持つペプチド3種類のハンチントン病の疾患タンパク質凝集に対する効果を検証しました。すると、凝集を阻害する効果はなかったものの、予想外に凝集過程(時間的な凝集スピードの変化)を変えて、最終的には凝集量を増やすことも分かりました(図2)。これに対応して、投与を受けたマウスの脳でも凝集体は変わっていないが、運動機能や体重などに治療効果が出ていたということも確認しました。一方で、7Hなどの候補薬シーズはDNA損傷などの病態を軽減していることも確認しました。
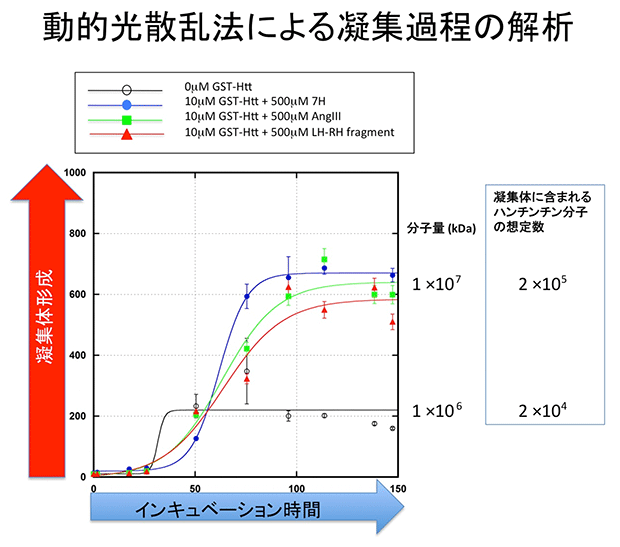
図2の説明: 動的光散乱法で、インキュベーション時間ごとの凝集体の大きさを測定した。ハンチンチン分子単独でインキュベーションする際と、明らかに異なる凝集過程が、7Hなどの治療薬シーズペプチドの存在下では生じている。初期には凝集は遅くなり、後半で急に速くなり、最終的に大きな凝集物ができる。
この意外な結果は、神経変性疾患の病態そのものについても示唆を与えるものです。すなわち、神経変性疾患における疾患タンパク質には大きく分けて3つの考え方があります。すなわち、(1)疾患タンパク質が凝集して、細胞内外に蓄積することが毒性の原因であるとする古典的な考え方、(2)疾患タンパク質の立体構造(コンフォメーション)が変化した時点で毒性の獲得が始まり、モノマー、オリゴマー、あるいは中間体という、凝集前の疾患タンパク質により強い毒性があるとの近年提唱された考え方、(3)その両者が正しいとする考え方、です。(2)の考え方に基づくと、凝集体形成の促進は平衡状態の中でモノマー、オリゴマー、あるいは中間体を減らす作用があり、むしろ細胞を保護することになります。この考えを支持する論文が、ポリグルタミン病、アルツハイマー病、パーキンソン病などの複数の神経変性疾患領域において、多数報告されています。
私たちの結果は、この中で、(2)あるいは、少なくとも(3)の仮説を支持するもので、今後の神経変性疾患の治療戦略にも示唆を与えるものです(図3)。

研究成果の意義
近年、神経変性疾患の様々な治療法が実験段階で提案され、一部は臨床試験段階に進んでいますが、がんと同様に多様な治療法を合わせた統合的治療が必要となることが予想されています。今回の研究で得られた治療薬シーズは、他の治療方法と合わせてより良い治療法に結びつく可能性があります。
用語の解説
- 注1:オミックス解析
- 細胞サンプルや組織サンプルに含まれる多様な分子の状態を包括的・網羅的に解析する研究方法です。例えば、あらゆるRNAを網羅的に定量するトランスクリプトーム解析、タンパク質やリン酸化などの修飾変化を受けたリン酸化タンパク質などの量を網羅的に解析するプロテオーム解析、核酸やタンパク質以外のアミノ酸、有機酸、脂肪酸などの比較的小さな分子を網羅的に解析するメタボローム解析などがあります。また、分子間の結合関係を網羅的に解析する手法をインタラクトーム解析といいます。これまでは過去の論文・知見に基づいて仮説を構築して単分子同士の関係を調べる仮説駆動型の研究が主体でしたが、オミックス解析の進歩により、網羅的データを基盤としたバイアス(先入観)の掛からないデータ駆動型研究が盛んになってきました。
- 注2:DNA損傷修復タンパク質Ku70
- Ku70タンパク質はDNAの両方の鎖が切れた場合(二重鎖切断)の修復メカニズムの一つである非相同末端結合(non-homologous end joining: NHEJ)の際に主要な働きをします。神経細胞のような分裂をしない細胞では、二重鎖切断修復のほとんどはNHEJに依存しています。Ku70はKu80とともにDNA二重鎖切断部を認識して結合し、ヘテロダイマーを形成します。さらにKu70-Ku80ヘテロダイマーはDNA-PKcs(DNA依存性プロテインキナーゼ触媒サブユニット)を二重鎖切断に引き寄せて、巨大な複合体を形成させ、損傷したDNAを修復します。
- 注3:動的光散乱法
- 動的光散乱法は微小な空間(数十から数百nm3単位)の中の分子あるいは分子が集合した粒子のサイズを測定する方法です。溶液中の分子や粒子は、水や溶媒分子が衝突することでブラウン運動をしており、大きな粒子は多方面から溶液分子がぶつかることから動きが少なく、小さな分子/粒子になるほど逆に1方向からの影響を受けて速くなります。このような分子/粒子にレーザー光を照射すると光が散乱し、検出器ではブラウン運動速度に対応して光の強さの変動が観測されます。この光強度の変動の大きさから粒子の大きさを解析します。疾患タンパク質も凝集して大きな粒子になるとブラウン運動の揺らぎが小さくなるため、凝集の状態を推定出来ます。
お問い合わせ先
研究に関すること
神経病理学分野 岡澤 均(オカザワ ヒトシ)
TEL:03-5803-5847 FAX:03-5803-5847
E-mail:okazawa.npat“AT”mri.tmd.ac.jp
AMED事業に関すること
〒100-0004 東京都千代田区大手町1-7-1
TEL:03-6870-2222 FAX:03-6870-2244
E-mail:brain-pm“AT”amed.go.jp
報道に関すること
東京医科歯科大学 広報部広報課
〒113-8510 東京都文京区湯島1-5-45
TEL:03-5803-5833 FAX:03-5803-0272
E-mail:kouhou.adm“AT”tmd.ac.jp
※E-mailは上記アドレス“AT”の部分を@に変えてください。
掲載日 平成28年9月22日
最終更新日 平成28年9月22日


