プレスリリース 脊髄損傷に対するヒトiPS細胞由来神経幹細胞移植治療における最大の課題であった移植細胞の腫瘍化を予防する方法を開発
プレスリリース
慶應義塾大学医学部
国立研究開発法人日本医療研究開発機構
慶應義塾大学医学部生理学教室(岡野栄之教授)と同整形外科学教室(中村雅也教授)は、ヒトiPS細胞から樹立した神経幹/前駆細胞(注1)をNotchシグナル阻害剤(注2)で前処理し、移植細胞の腫瘍化を予防し、安全に運動機能を回復・維持させることに成功しました。
これまで脊髄損傷を始めとした脳や脊髄の障害に対し神経幹/前駆細胞移植の有効性が報告されていますが、その一方で移植した細胞の腫瘍化(腫瘍を形成する性質)をいかに防ぐかが最大の課題となっているのが現状です。
本研究グループでは、細胞の多分化能(多様な組織へ分化する能力)や自己複製能(細胞自らが同じ性質のある細胞を作り出す能力)においてNotchシグナルが深く関係していることに着目しました。そこで脊髄損傷を加えたマウスへ腫瘍を形成する性質のあるiPS細胞(253G1クローン:顔面皮膚線維芽細胞にレトロウイルスを用いてOCT4、SOX2、KLF4の3因子を導入して樹立)由来神経幹/前駆細胞を移植しましたが、移植前にNotchシグナルを阻害する薬剤(Gamma secretase inhibitor、以下GSI)で前処理することによって、移植細胞の腫瘍化をブロックすることができました。また、移植細胞から脊髄神経回路の再構築が形成されることにより、運動機能の回復・維持を導いたことも明らかにしました。
今回の解明は、ヒトiPS細胞由来神経幹/前駆細胞移植の臨床応用を実現させる上での、新たな腫瘍化対策として非常に大きな成果であると考えます。
本研究成果は、2016年9月22日(米国東部時間)に、国際幹細胞学会(ISSCR)の公式ジャーナルである「Stem Cell Reports」のオンライン版に掲載されます。
1.研究の背景
本研究グループでは、2006年に京都大学の山中伸弥教授らにより開発されたiPS細胞技術を応用し、ヒトiPS細胞から樹立された神経幹/前駆細胞を、脊髄損傷を加えたモデル動物に移植することにより、良好な運動機能回復が得られることを報告しました。
しかしあるiPS細胞株を用いた移植実験では移植後に腫瘍化を示し、一度回復した運動機能は再度低下を示しました。iPS細胞幹/前駆細胞を用いた移植治療を行う上で、最も重要となる課題は移植細胞の腫瘍化であり、この腫瘍化を未然に防ぎ、安全性を確立することが今後の臨床応用に向けて急務であるといえます。
本研究グループでは、未分化(分化しきれていない未熟な状態の)細胞を除去もしくは、より分化をさせた状態で移植することで腫瘍化が抑制できるのではないかと考えました。そこで、神経幹細胞においてその多分化能や自己複製能に深く関与しているNotchシグナルに注目し、このシグナルを阻害するGSIを用いて、iPS細胞由来神経幹/前駆細胞(Neural stem / progenitor cells derived from human induced pluripotent stem cells、以下hiPSC-NS/PCs) の性質の変化を評価しました。また、移植前にGSIで前処理を行ったhiPSC-NS/PCsを脊髄損傷モデル動物へ移植し、その有効性と安全性を検証しました。
2.研究の概要と成果
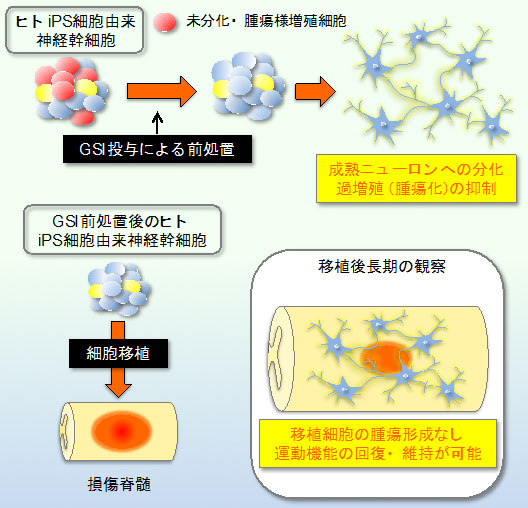
(2)腫瘍化を起こしやすいhiPSC-NS/PCsを用いた移植実験では、脊髄損傷後にGSI未処理のhiPSC-NS/PCsを移植したマウス(Control群)と、前日にGSI前処理を行ったhiPSC-NS/PCsを移植したマウス(GSI+群)で比較すると、移植後3ヶ月の時点で、Control群では細胞移植時と比較し約10倍にまで移植細胞は増殖を示しましたが、GSI+群では過増殖することなく生着しました。
運動機能評価に関しては、脊髄損傷後にリン酸緩衝生理食塩水のみを注入したマウス(PBS群)と比較し、両群ともに移植後は徐々に回復を示しましたが、その後Control群では移植後42日目以降に運動機能の再低下を認めました。一方、GSI+群では一度回復した運動機能はそのまま維持され、後肢で体重をしっかり支えての歩行が可能となっていました。
(3)腫瘍化傾向のないhiPSC-NS/PCsを用いた移植実験では、GSI+群において損傷脊髄内で移植細胞由来のニューロンから再生した軸索が明らかに増加しており、脊髄神経回路の再構築が形成されることにより運動機能のさらなる回復が確認できました。
3.研究成果の意義・今後の展開
4.特記事項
5.論文
- 表題:
- “ Pretreatment with a gamma-secretase inhibitor prevents tumor-like overgrowth in human iPSC-derived transplants for spinal cord injury ”
- 和文表題:
- 脊髄損傷に対するヒトiPS細胞由来神経幹細胞移植治療において、gamma secrtase 阻害薬を用いた細胞前処置は腫瘍様増殖を抑制する
- 著者名:
- 大久保寿樹、岩波明生、神山淳、板倉剛、川端走野、西山雄一郎、菅井桂子、尾崎正大、飯田剛、松林紘平、松本守雄、中村雅也**、岡野栄之*(* and ** Corresponding authors)
- 掲載誌:
- 「Stem Cell Reports」オンライン版
用語解説
- (注1)神経幹/前駆細胞
- 未分化な状態を保ったまま増殖することが可能な自己複製能と、中枢神経系を構成するニューロン、アストロサイト、オリゴデンドロサイトの3系統の細胞へと分化することができる多分化能を併せ持つ細胞。脊髄損傷や脳梗塞などへのヒトiPS細胞由来の神経幹細胞を用いた移植治療は今後の再生医療において有用な治療法として期待される。
- (注2)Notchシグナル阻害剤
- 神経、造血、血管や体節といった様々な組織へ分化をする過程に関係する遺伝子調節(シグナル伝達)経路。Notchシグナル経路は細胞同士の情報伝達において、発生や恒常性の維持、細胞分化に関する遺伝子制御において非常に重要な役割を担っている。
このシグナル経路の中で、Gamma secretase複合体の一部が切断され、その情報が細胞核へと移行し標的となる遺伝子が転写・発現するが、Gamma secretase阻害薬はこの切断を阻害することでNotchシグナルの阻害剤として機能し、神経をはじめとする様々な組織への分化を促進させる。また、腫瘍細胞に対してはその過増殖や転移を抑制する効果もあり、現在抗癌剤としての臨床応用も進んでいる。
お問い合わせ先
本発表資料のお問い合わせ先
慶應義塾大学医学部生理学教室
教授 岡野 栄之(おかの ひでゆき)
〒160-8582 東京都新宿区信濃町35
TEL:03-5363-3747 FAX:03-3357-5445
E-mail:hidokano“AT”a2.keio.jp
慶應義塾大学医学部整形外科学教室
教授 中村 雅也(なかむら まさや)
TEL:03-5363-3812 FAX:03-3353-6597
E-mail:masa“AT”a8.keio.jp
本リリースの発信元
慶應義塾大学信濃町キャンパス総務課
鈴木・吉岡
〒160-8582 東京都新宿区信濃町35
TEL:03-5363-3611 FAX:03-5363-3612
E-mail:med-koho“AT”adst.keio.ac.jp
http://www.med.keio.ac.jp/
AMED事業に関するお問い合わせ先
国立研究開発法人日本医療研究開発機構
戦略推進部 再生医療研究課
TEL:03-6870-2220
E-mail:saisei“AT”amed.go.jp
※E-mailは上記アドレス“AT”の部分を@に変えてください。
掲載日 平成28年9月23日
最終更新日 平成28年9月23日


