プレスリリース 生体外から光を当てて遺伝子のはたらきをコントロールする技術を開発―Cre-loxP DNA組換えシステムの光制御を高効率で実現―
プレスリリース
国立大学法人東京大学
国立研究開発法人日本医療研究開発機構
発表者
矢澤 真幸 (コロンビア大学リハビリテーション再生医療学科・薬理学科 助教授)
佐藤 守俊 (東京大学大学院総合文化研究科広域科学専攻 准教授)
発表のポイント
- 微弱な光や短時間の光照射でも極めて高い効率でDNA組換え反応をコントロールできる技術の開発に成功しました。
- 本研究により開発した技術は、生体外からの短時間の光照射でも遺伝子のはたらきをコントロールできる世界で初めての技術です。
- 病因や疾患などに関わるさまざまな遺伝子の機能解明への応用が期待されます。
発表概要
本研究グループは、二分割して一時的に活性を失わせたDNA組換え酵素(Cre)に光スイッチタンパク質を連結し、光照射でDNA組換え反応をコントロールできる光活性化型Cre(“PA-Cre”と命名)を開発することに成功しました。このPA-Creを用いて、わずか30秒程度という短時間の光照射を、しかも生体外から行うだけで、マウス生体深部の臓器における遺伝子のはたらきを高い効率でコントロールできることを示しました。
この新しい技術は、今後病因や疾患に関わるさまざまな遺伝子の機能解明に貢献すると共に、遺伝子組換え技術の応用可能性を大きく広げることが期待されます。
本研究成果は、米国科学誌「Nature Chemical Biology」[電子版:米国東部時間2016年10月10日(月)]に掲載されます。
本研究成果は、国立研究開発法人日本医療研究開発機構(AMED)の生命動態システム科学推進拠点事業「複雑生命システム動態研究教育拠点」(研究代表者:金子邦彦 東京大学大学院総合文化研究科 教授)の一環として得られました。
発表内容
研究の背景
1981年にバクテリオファージの研究で発見されたCre-loxP部位特異的DNA組換え酵素反応(注1)は、狙った遺伝子の塩基配列をゲノム上からノックアウト(除去)、またはゲノム上にノックイン(挿入)するための非常に簡便な方法として、世界中の研究室で広く利用されてきました。現在では、生命科学分野の重要なリサーチツールのひとつとして欠くことのできない技術となっています。近年、生体での遺伝子のはたらきを解明するための技術として、化合物や光を使ってCre-loxPシステムを人為的にコントロールする技術に興味が持たれています。特に、光でのコントロールを実現できれば、狙った生体組織や細胞を標的として、任意のタイミングでDNA組換えを誘導することができるようになり、DNA組換え技術の応用可能性を大きく広げることができると期待されていました。しかし、光を利用した従来の技術はいずれもDNA組換え効率が著しく低く、そのことが生体(マウスなどの動物個体)への応用の大きな妨げになっていました。このような背景から、DNA組換え反応を光でコントロールできる簡便でかつ高性能な技術の開発が強く求められていました。
研究内容
本研究グループはDNA組換え酵素(Cre)の光制御を実現するために、まずCreを二分割してそのDNA組換え活性を一時的に失活させました(図1)。そして、分割したCreのN末端側断片(CreN)とC末端側断片(CreC)のそれぞれに、同研究グループが最近開発した光スイッチタンパク質(Magnet)を連結しました。Magnet(pMagとnMagからなる:注2)は青色の光に応答して互いに結合する性質を持っています。したがって、青色光を照射すると、Magnetの結合に伴って、CreNとCreCも互いに結合します。このときCreNとCreCは、本来のCreと同じようにDNA組換え活性を示すことがわかりました。つまり、光照射でCreNとCreCのDNA組換え活性を誘導できるようになったのです。
上述の基本設計にさまざまな最適化を施すことにより、本研究グループは、従来の技術を遥かに凌駕する極めて効率の高い光活性化型DNA組換え酵素(“PA-Cre”と命名)の開発に成功しました(図2)。驚くべきことに、PA-Creは、従来の光遺伝学(注3)で使われている光の強さの10万分の1程度の微弱な光照射でも十分に機能し、高い効率でのDNA組換えを実現しました(図3)。さらにPA-Creは、わずか30秒程度の短時間の光照射でも十分にDNA組換えを誘導できることを示しました(図4)。加えて、PA-Creを用いて、狙った場所でのみDNA組換えを起こせることも実証しました(図5)。
以上のように開発したPA-Creをマウスの生体深部における遺伝子の光制御にも応用しました。その結果、PA-Creは、生体外からの非侵襲的な光照射方法を用いた場合でも、マウスの生体深部の臓器(肝臓を例に実証)において、DNA組換えを極めて高い効率で誘導できることがわかりました。この結果は、PA-Creを用いることにより、内臓における遺伝子のはたらきを生体外からの光照射で自由自在にコントロールできることを示しています(図6)。
なお、従来の光遺伝学では、マウスなどの動物個体の生体深部に光を届けるために、細い光ファイバーを差し込んだり、小型LED装置をインプラントするなど、外科的侵襲を伴う方法が用いられてきました。今回、本研究グループは、極めて高感度のPA-Creを開発することにより、わずか30秒程度という短時間の光照射を、しかも生体外から行うだけで、生体深部でDNA組換え反応を誘導できることを実証しました。このような非侵襲的な手法は、動物の負担を大幅に減らすとともに、実験の簡便性を劇的に向上させます。このように極めて簡便に生体深部における遺伝子のはたらきの光制御を実現した点は、本技術の最も特筆すべき特徴と言えます。
社会的意義・今後の予定
上述のように本研究グループは、光を使って自由自在にDNA組換え反応をコントロールするための技術を開発しました。本技術を使うことによって、従来では不可能であった生体(マウスなどの動物個体)の生体深部での遺伝子のはたらきを、生体外からの非侵襲的な光照射によってコントロールすることができるようになりました。本研究の成果は、病因や疾患に関わるさまざまな遺伝子の機能解明に役立つことが期待できます。また、DNA組換え反応を利用するさまざまな技術を革新し、遺伝子関連分野の発展に大きく貢献することが期待されます。
発表雑誌
論文タイトル:A photoactivatable Cre–loxP recombination system for optogenetic genome engineering
著者:Fuun Kawano, Risako Okazaki, Masayuki Yazawa, Moritoshi Sato*(*責任著者)
DOI番号:10.1038/nchembio.2205
問い合わせ先
研究内容に関するお問い合わせ先
東京大学大学院総合文化研究科
准教授 佐藤 守俊(さとう もりとし)
〒153-8902 東京都目黒区駒場3-8-1
Tel:03-5454-6579
E-mail:cmsato”AT”mail.ecc.u-tokyo.ac.jp
事業に関するお問い合わせ先
国立研究開発法人日本医療研究開発機構(AMED)戦略推進部医薬品研究課
〒100-0004 東京都千代田区大手町1-7-1
Tel:03-6870-2219
E-mail:20-DDLSG-16”AT”amed.go.jp
※E-mailは上記アドレス”AT”の部分を@に変えてください。
用語解説
- (注1)Cre–loxP部位特異的DNA組換え酵素反応
- loxPと呼ばれる34塩基対からなるDNA配列に対して、Creと呼ばれるDNA組換え酵素がはたらくことによって起こる部位特異的DNA組換え酵素反応。任意のDNA配列(遺伝子のDNA配列など)の前後にloxP配列を配置することで、そのDNA配列をゲノム上からノックアウト(除去)することができる。特定の遺伝子を欠損させたノックアウトマウスなどの作製に使用されている。さらに、loxP配列の配置を工夫して、転写終結配列を除去したり、標的遺伝子の配向を反転させることにより、標的遺伝子の発現(オン・オフ)をコントロールすることもできる。
- (注2)光スイッチタンパク質(Magnet)
- アカパンカビ(Neurospora crassa)が有する青色光受容体(Vivid)に対して多角的にプロテインエンジニアリングを施して開発された2つのタンパク質(pMagとnMag)のペア。分子サイズが小さいこと(GFPなどの蛍光タンパク質の60%程度の大きさ)が特徴のひとつ。pMagとnMagは暗所などの青色光非存在下の状況では、それぞれ単量体として存在する。青色光を受容すると、互いに結合する。最近、本研究グループにより開発・報告された(Nat. Commun. 6,6256 (2015). doi: 10.1038/ncomms7256)。
- (注3)光遺伝学
- 光学(optics)と遺伝学(genetics)の方法論を融合させた学問分野。オプトジェネティクス(optogenetics)とも呼ばれている。遺伝子としてコード化された光応答性のタンパク質を使って、細胞内のイオン濃度やタンパク質の挙動などを光でコントロールすることにより、生命現象を明らかにすることを目的とする。2005年、光駆動型のイオンチャネル(チャネルロドプシン)を使って、神経細胞の活動を光でコントロールする技術が報告されたのをきっかけに、脳神経科学の分野で爆発的に広まった。現在では、チャネルロドプシン以外にもさまざまなツールが開発され、生命科学の新たな研究手法として幅広い分野から注目されている。
添付資料
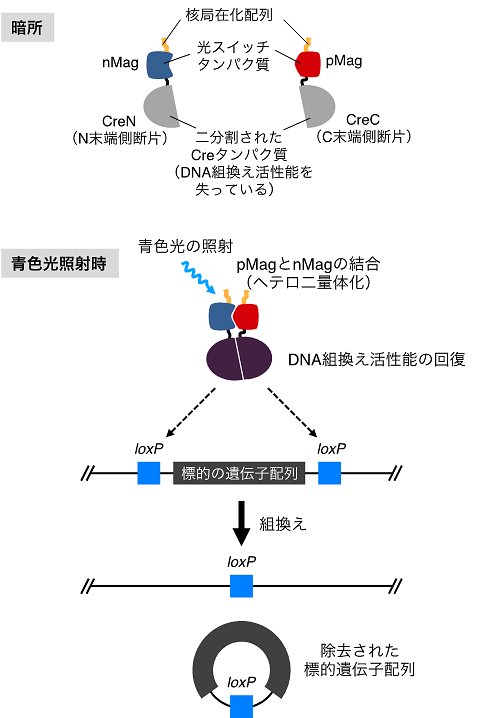 図1.本技術の原理
図1.本技術の原理
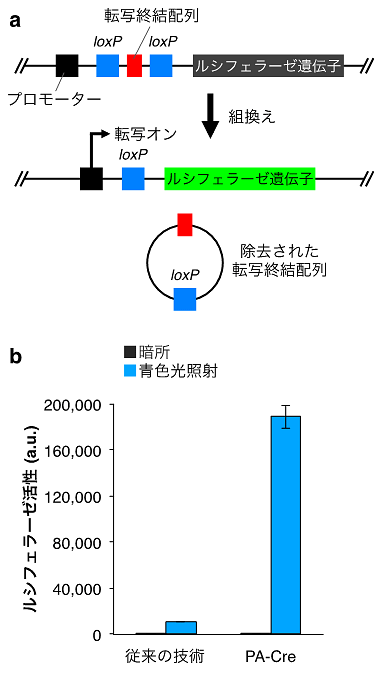
図2.従来の技術との比較
(a)組換えが起きたかどうかを定量的に測定するためのルシフェラーゼレポーターの原理。ルシフェラーゼ遺伝子の上流に転写終結配列を配置することで、組換えが起きる前はルシフェラーゼの発現が抑制される。2つのloxP の間でのDNA組換えによって転写終結配列が除去されると、ルシフェラーゼの発現が誘導される。したがって、発現してきたルシフェラーゼの活性を測定することで、DNA組換えを定量することができる。(b)本技術(PA-Cre)と代表的な従来技術との比較。PA-Creを導入した細胞では、従来のツールを導入した細胞と比べて、青色光照射によって極めて高い効率でDNA組換えが起こった。「従来の技術」と「PA-Cre」は、それぞれの左側が暗所でのデータ、右側が青色光照射時のデータ。
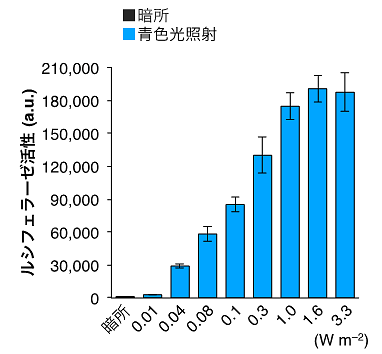
図3.PA-Creの微弱な青色光に対する応答
従来の光遺伝学(オプトジェネティクス)では、1.0~5.0 mW/mm2程度の非常に強い光が使われている。本研究のPA-Creは0.04 W/m2(= 0.00004 mW/mm2)という非常に弱い青色光にも応答して、DNA組換えをコントロールできることがわかった。光照射の強度を弱くすることで、光照射で生じる熱などによる細胞・生体へのダメージを大幅に抑制できる。
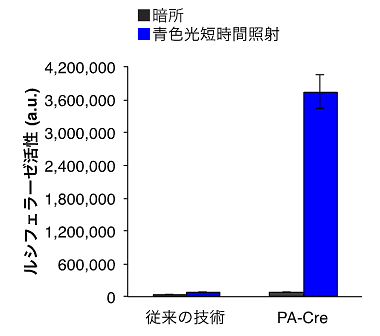
図4.PA-Creの短時間照射に対する応答
従来の技術はDNA組換え効率が著しく低く、短時間での光照射でのDNA組換えは不可能であったが、PA-Creは、わずか30秒間の非常に短い照射時間でも十分に応答し、DNA組換えを誘導できることがわかった。したがって、長時間の光照射で生じる熱などによる細胞・生体へのダメージを大幅に抑制できる。また、照射時間の短縮は、実験の簡便性を劇的に向上させることができる。「従来の技術」と「PA-Cre」は、それぞれの左側が暗所でのデータ、右側が青色光短時間照射時のデータ。
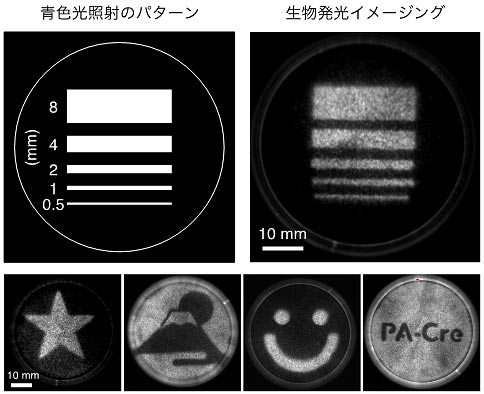
図5.DNA組換え反応を空間的にコントロール
培養皿上のPA-Creを発現した細胞に、縞状のパターンで青色光を照射した(上左)。その結果、光照射と同じパターンでDNA組換えが起こり、生物発光を有するルシフェラーゼ遺伝子の発現が観察された(上右)。さまざまなパターンで照射を行った(下)。この結果は、空間的に限られた領域のみでDNA組換え反応をコントロールできることを示している。
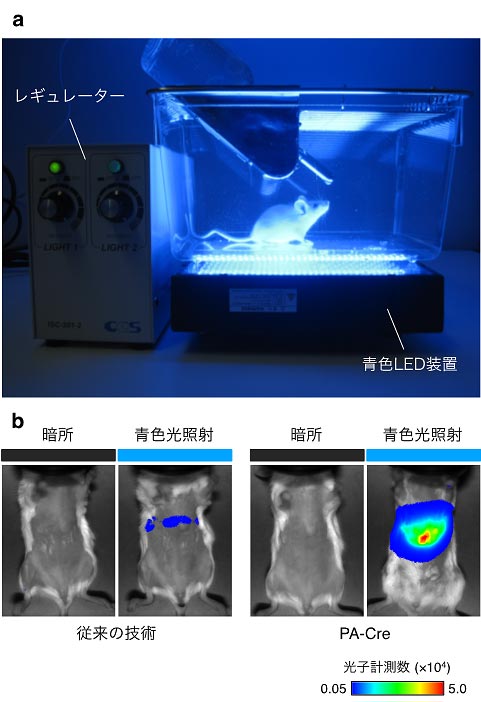
図6.PA-Creのマウス生体深部での応答
(a)LEDを用いてマウスの生体外から非侵襲的に青色光を照射している様子。(b)肝臓にPA-Creとルシフェラーゼレポーター(図2a)を導入したマウスは、従来の技術を導入したマウスと比べて、光照射によって極めて高いルシフェラーゼ活性を示した。この結果は、生体外からの光照射であっても、マウスの生体深部において、PA-Creが高い効率でDNA組換えを誘導できることを示している。
掲載日 平成28年10月11日
最終更新日 平成28年10月11日


