プレスリリース タンパク質合成を促進する「ジャンク」と呼ばれていたRNA―アンチセンスRNAの翻訳促進機構をヒトでも確認―
プレスリリース
国立研究開発法人日本医療研究開発機構
要旨
理化学研究所(理研)ライフサイエンス技術基盤研究センタートランスクリプトーム研究チームのアレクス・シャイン研究員とピエロ・カルニンチ チームリーダーらの研究チームは、タンパク質の合成を促進するアンチセンスRNA[1]がヒトでも発現していることを発見しました。
アンチセンスRNAとは、タンパク質をコードするメッセンジャーRNA(mRNA)と相補的な配列を持つ、ノンコーディングRNA(ncRNA)[2]の一種です。アンチセンスRNAの機能として、mRNAと相補的に結合してタンパク質への翻訳を阻害することがよく知られています。ところが、マウスで見つかったSINEUP(サインアップ)[3]と呼ばれるアンチセンスRNAは、mRNAからタンパク質への翻訳を促進するという逆の作用を持っていました。SINEUPの構造の特徴は、標的mRNAに対する相補的な配列に加え、ゲノムに散在する短い反復配列(SINE因子[4])から転写された配列を持つことです。一般的にSINE因子は、機能を持たない「ジャンク(がらくた)DNA」と考えられています。SINEUPは、SINE因子由来のRNAに翻訳促進機能が見つかった初めての例です。ただしマウスSINEUPに含まれるSINE因子の配列はヒトが持つSINE因子とは異なっており、アンチセンスRNAによる翻訳促進機構がヒトにも存在するかは不明でした。
今回、研究チームは、ヒトのアンチセンスRNAの中に、SINE因子の配列を持ちタンパク質への翻訳を促進するものがあるかどうかを探索しました。脳に存在するRNAを大規模にスクリーニングした結果、ヒトSINE因子のうち「FRAM」および「MIRb」と呼ばれる配列を持つアンチセンスRNAが、タンパク質の合成を促進することが分かりました。次に、FRAMを含むアンチセンスRNAを人工的に作製し、ヒト由来の培養細胞で発現させたところ、本来の標的とは異なるmRNAに対しても翻訳を促進させる効果があることを見つけました。ヒトFRAMはマウスのSINEUPとは異なる起源を持つSINE因子であり、塩基配列は似ていません。以上の結果から、ヒトでは、マウスと異なるSINE因子を含むアンチセンスRNAがSINEUPとして機能し、タンパク質翻訳促進作用を持つことを実証しました。
マウスで発見されたSINEUPは、mRNAからタンパク質への合成を促進する技術として既に生命科学の研究で用いられています。今回ヒトのSINEUPを見つけたことで、特定のタンパク質の量が低下する疾患を治療する臨床応用への可能性が前進したと期待しています。
本研究の一部は、国立研究開発法人日本医療研究開発機構(AMED)の革新的バイオ医薬品創出基盤技術開発事業の支援によって行われました。成果は、英国のオンライン科学雑誌『Scientific Reports 』(9月20日付け)に掲載されました。
背景
生物がタンパク質を合成する仕組みは、DNAからメッセンジャーRNA(mRNA)への転写、mRNAからタンパク質への翻訳の二つの過程から成り立っています。転写や翻訳の効率は、最終的なタンパク質の合成量に影響します。近年、ゲノムDNAから転写されるRNAには、タンパク質をコードするmRNAの他に、タンパク質をコードしないノンコーディングRNA(ncRNA)が多く含まれていることが明らかになりました。ncRNAの中にはDNAの転写やmRNAの翻訳を制御し、ゲノム機能を調節する役割を果たすものがあることが示されています。
アンチセンスRNAとは、ncRNAの一種であり、配列の一部あるいは全部がタンパク質をコードするmRNAと相補的であるものを指します。アンチセンスRNAには、mRNAの分解や翻訳を阻害することでタンパク質合成を低下させる機能があることが知られています。しかし、2012年にピエロ・カルニンチらとイタリアInternational School of Advanced Studies(SISSA)の国際共同研究グループは、マウス脳で発現するアンチセンスRNAに、タンパク質合成を促進する機能を持つものがあること発見し「SINEUP(サインアップ)」と名付けました注1)。SINEUPは、その5'末端[5]側に、標的となるmRNAの5'末端側と相補的な配列を持ち、加えて3'末端[5]側に短い反復配列(SINE因子)を持っています(図1)。このSINE因子がmRNAのリボソームへの移行を促進することで、翻訳効率を上昇させます。これまでSINE因子は、機能を持たない「ジャンク(がらくた)DNA」と呼ばれていました。マウスSINEUP中に見つかった SINE因子(SINE B2ファミリー)は、翻訳促進機能が確認された初めての例です。しかし、SINE B2ファミリーはマウスなど齧歯(げっし)類に特有のSINE因子であり、他の生物種でも翻訳促進機能を持つアンチセンスRNAが存在するかは不明でした。
 図1 マウス脳で発現するアンチセンスRNAのSINEUPとその標的mRNAの構造
図1 マウス脳で発現するアンチセンスRNAのSINEUPとその標的mRNAの構造
研究手法と成果
研究チームはまず、ヒト脳で発現するRNAの大規模スクリーニングを行い、SINE因子の配列を持つアンチセンスRNAの中にSINEUPとして機能するものがあるか探索しました。その結果、1,971個のアンチセンスRNAのうち1,096個が、mRNAのアンチセンス配列と、少なくとも一つのヒトSINE因子の両方を含んでいました。このうち、マウスのSINEUPと同じ特徴である標的mRNAの翻訳開始配列(開始コドン)と結合する配列を持つものが、129個見つかりました。
次に、これらのアンチセンスRNAが翻訳を促進する機能を持つか検証するため、ヒト細胞での発現量が特に多いタンパク質であるPPP1R12A[6]をコードするセンスRNA(mRNA、図2B)とそのアンチセンスRNA(R12A-AS1)(図2A)のペアについて詳細に調べました。その結果、R12A-AS1は、その5'末端側にPPP1R12AのmRNAと相補する領域を、3'末端側にヒトのSINE因子である「FRAM」配列を持っていました。
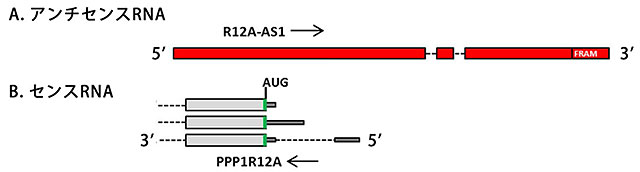 図2 ヒトアンチセンスncRNA(R12A-AS1)のゲノム上の配列構造
図2 ヒトアンチセンスncRNA(R12A-AS1)のゲノム上の配列構造
A: アンチセンスRNAの一つR12A-AS1に対応するゲノムDNAの構造。5'末端側に、PPP1R12A mRNAの第1エクソン(成熟したmRNAに含まれる部分)に相補的な配列を含む。破線は、最終的なRNA産物からは取り除かれるイントロン領域(成熟したmRNAに含まれない部分)を示す。3'末端側にSINE因子のFRAM配列を持つ。
B:ヒトPPP1R12A mRNAに対応するゲノムDNAの構造。右側が5'末端側。5'末端側の非翻訳領域の長さが異なる3種類のmRNAが存在する。破線は、イントロン領域を示す。
アンチセンスRNAのR12A-AS1をヒト培養細胞に強制発現させると、PPP1R12Aタンパク質の量が増加することが確認できました(図3A)。このときのmRNA量を測定すると、その発現量は増加していなかったことから、R12A-AS1は転写ではなく翻訳に作用していると考えられました(図3B)。さらに、FRAM配列が本来の標的mRNA以外にも翻訳促進効果があるかを明らかにするため、蛍光タンパク質(GFP)[7]をコードするmRNAに対して、そのアンチセンス配列とFRAM配列を持つアンチセンスRNAを人工的に設計し、ヒト培養細胞で発現させました(図3C)。その結果、このアンチセンスRNAはGFPの合成量を10倍近く上昇させる効果があることが分かりました(図3D)。
以上の結果から、ヒトにおいては、マウスとは異なるSINE因子を持つアンチセンスRNAが発現し、SINEUPとして機能していることが示されました。また、FRAM配列とは別のSINE因子である「MIRb」配列を持つアンチセンスRNAにも、標的となるmRNAがコードするタンパク質(ITFG2[8])の合成を促進する効果があることが、ヒト細胞培養実験から示されました。
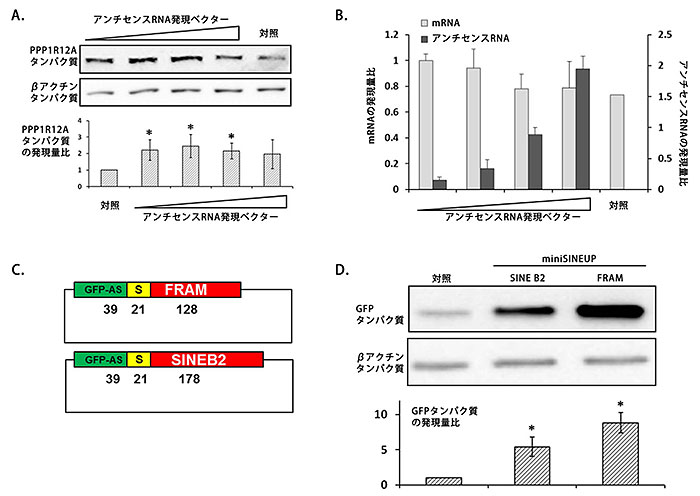 図3 ヒトSINEUPが示すタンパク質合成の促進効果
図3 ヒトSINEUPが示すタンパク質合成の促進効果
A:アンチセンスRNAである発現するベクターをR12A-AS1をヒト培養細胞に導入し、強制発現させると、PPP1R12Aタンパク質の合成量が増加した。バンドの濃さはタンパク質量に対応し、グラフはバンドの濃さを数値化したもの。PPP1R12Aタンパク質とは無関係のβ-アクチンの合成量には変化がなかった。
B: R12A-AS1(アンチセンスRNA)の発現量とPPP1R12A(mRNA)量の関係。R12A-AS1を強制発現させても、PPP1R12AのmRNA量は増加しなかった。
C: GFPのアンチセンス配列にSINE因子配列を融合させたSINEUPを発現するベクター(mini SINEUP)の構造。FRAM配列は今回の研究で見出されたヒトのSINE因子。SINE B2配列はマウスのSINE因子。Sはスペーサー配列。数字は、それぞれの配列の長さを示す。
D:Cで示したmini SINEUPのタンパク質翻訳促進効果。バンドの濃さはGFPの量に対応し、グラフはバンドの濃さを数値化したもの。FRAM配列を持つmini SINEUPは、SINE B2配列よりも強い翻訳促進を示した。
ヒトFRAMとマウスSINE B2は異なる起源を持つSINE因子であり、配列上の類似度は高くありません。しかし、RNAの二次構造を予測するプログラムソフトで解析したところ、共通する一部の領域が似た立体構造をとる可能性があることが分かりました。SINEUPによるタンパク質合成促進のメカニズムとして、SINE因子が作る立体構造が翻訳装置[9]に結合し、mRNAの翻訳効率を上げている可能性が考えられます。
今後の期待
多様なSINE因子がSINEUPとして機能できるという事実は、これまでマウスでのみ確認されていたアンチセンスRNAによる翻訳促進機構が、哺乳類で普遍的な現象であることを示唆しています。
マウスで発見されたSINEUPはすでに、mRNAからのタンパク質合成を促進する技術として生命科学実験に用いられています。さらに、ハプロ不全 [10]などタンパク質の発現が低下する疾患に対して、タンパク質の合成量を増加させる治療薬としての応用も検討されています。ヒトに内在するアンチセンスRNAにも翻訳促進機能を持つものがあることを明らかにした本成果により、SINEUPの臨床応用の前進が期待できます。
論文情報
- タイトル
- Identification of antisense long noncoding RNAs that function as SINEUPs in human cells
- 著者名
- Aleks Schein, Silvia Zucchelli, Sakari Kauppinen, Stefano Gustincich & Piero Carninci,
- 雑誌
- Scientific Reports
- DOI
- 10.1038/srep33605
補足説明
- [1] アンチセンスRNA
- DNAの配列として書かれた遺伝情報はRNAに転写される。タンパク質をコードするメッセンジャーRNA(mRNA)のように意味を持つ配列として転写されたRNAをセンスRNAと呼ぶのに対し、その相補的な配列を持つRNAをアンチセンスRNAと呼ぶ。アンチセンスRNAがセンスRNAと2本鎖を形成するとタンパク質合成が阻害されることはよく知られていた。
- [2] ノンコーディングRNA(ncRNA)
- タンパク質をコードしないDNA配列から転写され、タンパク質には翻訳されないRNA。遺伝子以外のDNA領域はしばしば「ジャンクDNA」と呼ばれ、その転写産物も機能を持たないゴミのようなものと思われていたが、転写制御などの機能を担っていることが近年明らかになっている。なお、200塩基以上のncRNAを特にロングノンコーディングRNAと呼ぶ場合がある。
- [3] SINEUP
- マウスのUchl1遺伝子のアンチセンスRNAがUchl1タンパク質の合成を促進する現象の発見をきっかけに見出された新しいタイプのノンコーディングRNA。SINE因子[4]の配列を持ちタンパク質翻訳を促進する機能領域(ED:Effector Domain)と、標的mRNAと相補的な配列を持つ結合領域(BD:Binding Domain)の二つのドメインで構成される。任意の標的mRNAからのタンパク質翻訳を促進することができるツールとして使うことができるため、研究用試薬やタンパク質製造ツールから核酸医薬まで、幅広い応用が進んでいる。SINE element-containing translation UP-regulatorの略。
- [4] SINE因子
- 短鎖散在反復配列とも呼ばれる。ゲノムの特定の塩基配列がコピーされ、これが再びゲノムに挿入されたもの。生物進化の過程において、ある生物のゲノムの特定の場所にSINEが挿入されると、これが子孫に受け継がれる。このことから、多数の生物のSINEを分析すると系統関係が分かる。「ジャンクDNA」とも呼ばれている。SINE は、short interspersed nuclear elementの略。
- [5] 5'末端、3'末端
- RNAはヌクレオシドの2'-リボースの5'位のヒドロキシ基と3'位のヒドロキシ基がリン酸ジエステル結合によって連結されてできている。RNAの5'位のヒドロキシ基側を5'末端と呼び、3'位のヒドロキシ基側を3'末端と呼ぶ。これらはそれぞれ、タンパク質をコードするmRNAの場合、5'末端に翻訳開始コドンが位置する。
- [6] PPP1R12A
- protein phosphatase 1 regulatory subunit 12A(タンパク質ホスファターゼ1制御サブユニット12A)タンパク質の略。
- [7] 蛍光タンパク質(GFP)
- 発光クラゲに由来する緑色蛍光タンパク質。GFPは、Green Fluorescent. Proteinの略。
- [8] ITFG2
- 本研究で用いたヒト培養細胞(HEK293)において、多量に発現するタンパク質の一つ。Integrin-Alpha FG-GAP Repeat-Containing Protein 2の略。
- [9] 翻訳装置
- 翻訳を担う細胞小器官リボソームを指す。複数のリボソームRNAとリボソームタンパク質で構成される。
- [10] ハプロ不全(haploinsufficiency)
- 2倍体の生物であるヒトは、二つある対立遺伝子のうち一つが正常であれば十分量のタンパク質が作られ、多くの場合は表現型として影響が現れない。これに対し、正常な遺伝子が一つだけでは十分なタンパク質量が生産できず、機能を維持できない現象をハプロ不全と呼ぶ。このとき、正常な遺伝子から転写されるmRNAを標的とするSINEUPを細胞に導入すれば、タンパク質の合成量が増加し機能を回復させることができると期待される。
お問い合わせ先
発表者 ※研究内容については発表者にお問い合わせください
理化学研究所 ライフサイエンス技術基盤研究センター 機能性ゲノム解析部門
LSA要素技術研究グループ トランスクリプトーム研究チーム
チームリーダー ピエロ・カルニンチ(Piero Carninci)
研究員 アレクス・シャイン(Aleks Schein)
TEL:045-503-9247(機能性ゲノム解析部門) FAX:045-503-9216(同)
E-mail:carninci“AT”riken.jp(ピエロ)
機関窓口
理化学研究所 ライフサイエンス技術基盤研究センター
広報・サイエンスコミュニケーション担当 山岸 敦 (やまぎし あつし)
TEL:078-304-7138 FAX:078-304-7112
E-mail:ayamagishi“AT”riken.jp
理化学研究所 広報室 報道担当
TEL:048-467-9272 FAX:048-462-4715
E-mail:ex-press“AT”riken.jp
国立研究開発法人日本医療研究開発機構(AMED)
経営企画部 企画・広報グループ
TEL:03-6870-2245
AMEDの事業に関する問い合わせ先
国立研究開発法人日本医療研究開発機構(AMED)
戦略推進部 医薬品研究課
革新的バイオ医薬品創出基盤技術開発事業担当
〒100-0004 東京都千代田区大手町1-7-1
TEL:03-6870-2219 FAX:03-6870-2244
※E-mailは上記アドレス“AT”の部分を@に変えてください。
掲載日 平成28年10月28日
最終更新日 平成28年10月28日


