プレスリリース 患者由来iPS細胞による脊髄小脳変性症の病態再現―小脳プルキンエ細胞変性から病態を理解し、創薬への道を開く―
プレスリリース
国立研究開発法人日本医療研究開発機構
要旨
理化学研究所(理研)多細胞システム形成研究センター非対称細胞分裂研究チームの石田義人客員研究員、六車恵子専門職研究員らの共同研究グループ※は、脊髄小脳変性症[1]の患者からiPS細胞を樹立し、小脳プルキンエ細胞[2]を分化誘導させ、病態の一部を再現することに成功しました。また、疾患由来の小脳プルキンエ細胞がある種のストレスに対して“脆弱性”を示すことを突き止め、この脆弱性を抑制する化合物の評価系を構築しました。
遺伝性神経変性疾患の一つである脊髄小脳変性症6型(SCA6)は、小脳神経細胞が選択的に変性、脱落する病気です。現在、有効な治療法は確立されていません。SCA6では、原因遺伝子の「CACNA1A」でグルタミン酸をコードするCAGリピート配列[3]が異常に伸長し、小脳プルキンエ細胞内にグルタミン酸が蓄積することが知られています。しかし、神経変性に至るメカニズムは明らかになっていませんでした。
六車専門職研究員らは、2015年にヒト多能性幹細胞[4](ES細胞および iPS細胞)から小脳神経細胞を作製する方法を開発しました。今回、その手法を応用し、SCA6患者の皮膚細胞あるいは血液細胞から樹立したiPS細胞を小脳プルキンエ細胞へと分化誘導して病態の一部を再現しました。CACNA1Aは、神経細胞に存在するP/Q型Ca2+チャネル[5]のα1サブユニットをコードする遺伝子です。SCA6患者由来の小脳プルキンエ細胞を観察した結果、健常人の同細胞に比べ、P/Q型Ca2+チャネルのα1サブユニットの「Cav2.1[5]」が異常に蓄積していました。また、患者由来プルキンエ細胞では、CACNA1AのC末端がコードする転写因子[6](α1ACT)、およびその標的分子(TAF1、BTG1)の発現が低下していることが分かりました。さらに、細胞にストレスを与えるような特殊な条件下で培養をすると、SCA6患者由来の小脳プルキンエ細胞は高い“脆弱性”を示し、異常な形態が現れました。この形態変化を指標に化合物評価を行ったところ、一部の既存薬にその脆弱性を抑える効果があることが分かりました。
今回開発した新たな病態モデルによって、これまで不明だったSCA6の病態解明と創薬研究への道が開かれると期待できます。また、患者から樹立したiPS細胞を用いた技術は、他の神経変性疾患の研究への応用が可能と考えられ、今後の疾患研究の進展に貢献する可能性が期待できます。
本研究は、AMED再生医療実現拠点ネットワークプログラム「疾患特異的iPS細胞を活用した難病研究」事業の一環として行われ、成果は米国の科学雑誌『Cell Reports』に掲載されるのに先立ち、オンライン版(11月1日付け:日本時間11月2日)に掲載されます。
- 理化学研究所 多細胞システム形成研究センター
-
非対称細胞分裂研究チーム
- 客員研究員 石田 義人(いしだ よしひと)(塩野義製薬株式会社 研究員*)
- 専門職研究員 六車 恵子(むぐるま けいこ)
テクニカルスタッフ 西山 あやか(にしやま あやか)
器官発生研究チーム(研究当時)- 専門職研究員 北島 裕幸(きたじま ひろゆき)
器官発生研究グループ- グループディレクター(研究当時) 笹井 芳樹(ささい よしき)
- 広島大学 原爆放射線医科学研究所 分子疫学研究分野
-
- 教授 川上 秀史(かわかみ ひでし)
- 京都大学 iPS細胞研究所 増殖分化機構研究部門
-
- 教授 井上 治久(いのうえ はるひさ)
*本研究成果は、理研、広島大学、京都大学の共同研究による成果であり、塩野義製薬の寄与はありません。石田義人は理研客員研究員として共同研究グループに参加しています。
背景
脊髄小脳変性症は小脳性の運動失調症状を主体とするもので、主に小脳や脳幹の神経細胞が選択的に変性、脱落する病気です。日本には約3万人の患者がいるといわれています注1)。遺伝性が約1/3を占め、多くの原因遺伝子が明らかとなっていますが、その病態や発症のメカニズムは分かっていません。そのため、根本治療につながる治療法の開発が求められています。中でも、脊髄小脳変性症6型(SCA6)は日本で最も多い遺伝性脊髄小脳変性症の一つで、臨床的には純粋小脳型(症状が小脳症状に限定される型)であり、小脳プルキンエ細胞(以下、プルキンエ細胞)特異的に神経変性が認められます。
SCA6の原因遺伝子は、神経細胞に存在するP/Q型Ca2+チャネルのα1サブユニットをコードする「CACNA1A」です。この遺伝子のC末端側の細胞内ドメイン(領域)にグルタミン酸をコードするCAGリピート配列(シトシン・アデニン・グアニン配列)が異常に伸長することにより、プルキンエ細胞内にグルタミン酸が蓄積し、SCA6が発症することが分かっています。SCA6はCAGリピート数が20以上になったときに発症し、ほとんどの症例で30リピート程度です。一般にポリグルタミン病[7]といわれる他の疾患では、発症に少なくとも40リピート以上の伸長が必要であることから、SCA6の発症には他のポリグルタミン病とは異なるメカニズムがあると考えられます。
これまで脊髄小脳変性症の研究には、原因遺伝子を強制的に過剰発現させた動物モデルや株化細胞モデルなどが使われてきましたが、病態の再現には不十分でした。一方、近年発展が目覚ましいiPS細胞技術を用いることにより、生理的な遺伝子発現量を持つ患者由来のプルキンエ細胞を試験管内で作製し、解析に用いることが可能となりました。理研多細胞システム形成研究センター非対称細胞分裂研究チームの六車恵子専門職研究員らは、2015年にヒト多能性幹細胞(ES細胞および iPS細胞)から3次元浮遊培養法を用いて、プルキンエ細胞へ分化誘導する方法を開発しました注2)。本研究ではこの培養技術を用いて、SCA6患者由来のiPS細胞からプルキンエ細胞へ分化誘導を行い、病態の解析を試みました。
- 注1)難病情報センターホームページより
- 難病情報センター | 脊髄小脳変性症(多系統萎縮症を除く。)
- 注2)理化学研究所ホームページより
- 2015年1月30日プレスリリース「ヒトES細胞から小脳の神経組織への分化誘導に成功」
研究手法と成果
1)SCA6患者由来iPS細胞からプルキンエ細胞を分化誘導
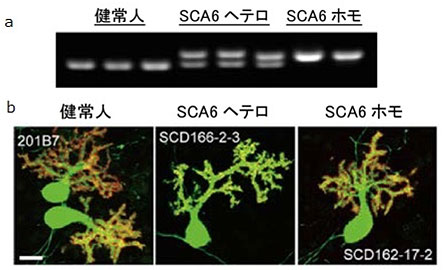 図1 iPS細胞から分化誘導したプルキンエ細胞
図1 iPS細胞から分化誘導したプルキンエ細胞
a:iPS細胞におけるCAGリピート数を示す電気泳動画像。SCA6ヘテロはSCA6ヘテロ接合型患者、SCA6ホモはSAC6ホモ接合型患者由来のiPS細胞。健常人では11~15リピート、SCA6ヘテロとSCA6ホモは22~26リピートが保持されていることが分かった。
b:iPS細胞から分化誘導した培養後75日目のプルキンエ細胞。緑(L7)は細胞全体に発現、赤(GRID2)は樹状突起棘に発現するプルキンエ細胞に特異的なマーカー。健常人由来とSCA6患者由来のプルキンエ細胞の形態に大きな違いはなかった。スケールバーは20マイクロメートル(μm、1μmは1,000分の1mm)。
2)SCA6患者由来プルキンエ細胞の表現型解析
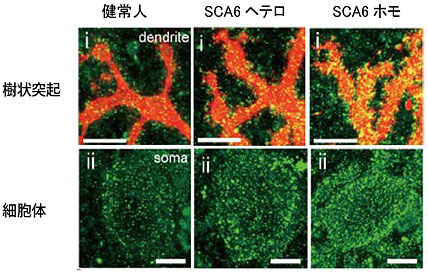 図2 iPS細胞から分化誘導したプルキンエ細胞におけるCav2.1の発現
図2 iPS細胞から分化誘導したプルキンエ細胞におけるCav2.1の発現
赤(L7)はプルキンエ細胞に特異的なマーカー、緑はCav2.1タンパク質(α1サブユニット)に特異的なマーカーを使用した。Cav2.1の点状の発現は、健常人<SCA6ヘテロ<SCA6ホモの順で増加していることが分かる。スケールバーは全て10μm。
最近、Cav2.1のC末端側フラグメントであるα1ACT(CAGリピートを含む)が、第二シストロン[10]として翻訳され転写因子として働き、プルキンエ細胞の発達や疾患に関与しているという報告がありました。そこで共同研究グループは、α1ACTとその標的分子TAF1とBTG1の発現を解析し、疾患との関係について調べました。その結果、健常人由来のプルキンエ細胞ではα1ACTは細胞体に、TAF1とBTG1は核内に発現していました。一方、SCA6患者由来のプルキンエ細胞では、SCA6ヘテロ>SCA6ホモの順にα1ACT、TAF1、BTG1の発現量が減少することが分かりました(図3)。この結果は、CAGリピートが異常に伸長すると(リピート数が増えると)、α1ACTが転写活性機能を失い、神経細胞の増殖や発達を抑制するというモデルマウスや株化細胞の報告と一致し、SCA6患者由来のプルキンエ細胞でも再現されたことになります。
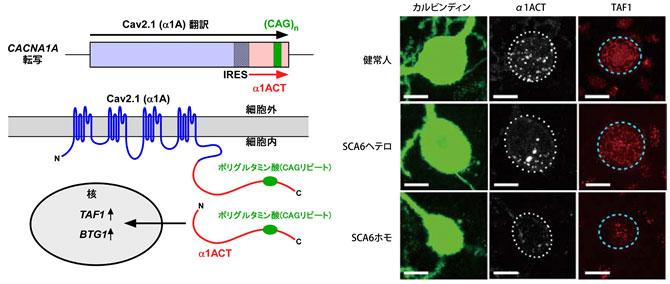 図3 α1ACTと標的分子TAF1、BTG1の働きと発現
図3 α1ACTと標的分子TAF1、BTG1の働きと発現
左: Cav2.1のC末端側断片が転写因子α1ACTとして核内に移行し、標的分子TAF1、BTG1を活性化する。IRESは、内部リボソーム導入部位。
右: 緑はカルビンディンというカルシウム結合タンパク質の一つで、プルキンエ細胞の代表的なマーカーの一つ。白はα1ACT、赤はTAF1を示す。また、白の点線は細胞体、水色の点線は核の大まかな輪郭を示す。SCA6由来iPS細胞から分化誘導したプルキンエ細胞では、α1ACT、TAF1の発現量がSCA6ヘテロ>SCA6ホモの順に減少することが分かる。スケールバーは、カルビンディン像は20μm、α1ACT像およびTAF1像は10μm。
3)SCA6患者由来プルキンエ細胞の脆弱性と同細胞を活用した化合物評価系の構築
生理的な遺伝子発現量を持つ患者のiPS細胞から分化誘導したプルキンエ細胞は、既に知られている病理像を再現できるだけではなく、疾患の初期状態や、これまで知られていない病態に関わる現象を調べることができると考えられます。しかし、SCA6は50歳以上で発症することが多い遅発性の疾患です。そのため、図1bの75日目のプルキンエ細胞の形態が、健常人と患者由来でほとんど変化がなかったように、試験管の中で長期間培養するだけでは病態に関連した表現型が現れにくいと考えられます。
そこで共同研究グループは、プルキンエ細胞の成熟と維持に重要な因子である甲状腺ホルモンT3を培養液から除くことで、培養環境に負荷をかけ、健常人由来とSCA6患者由来のプルキンエ細胞の間で、成熟などに違いがあるかを調べました。その結果、健常人由来のプルキンエ細胞ではT3の添加の有無に関わらず、細胞の生存数および形態には特に変化が認められませんでした(図4)。しかし、SCA6患者由来のプルキンエ細胞では培養液にT3の添加をしなかった場合、樹状突起が太くなり枝分かれの数が少なくなるなどの形態に変化が現れ(図4)、細胞の生存数も著しく減少しました。
次に、SCA6患者由来のプルキンエ細胞の脆弱性がみられた上記の培養系を使って、細胞の脆弱性を抑える薬剤の効果を調べました。その結果、すでにその誘導体がSCAの治療に使われている甲状腺刺激ホルモン放出ホルモン(TRH)や、筋萎縮性側索硬化症(ALS)の治療に用いられているリルゾールの添加によって、樹状突起の萎縮が緩和され(図4)、細胞数の減少も抑制できることが分かりました。
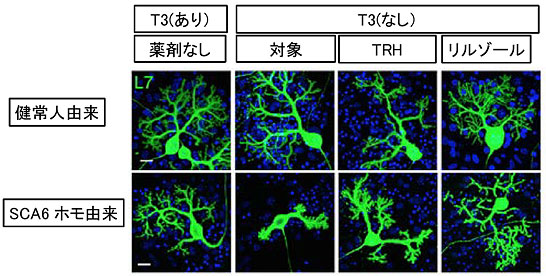
図4 甲状腺ホルモンT3の有無によるプルキンエ細胞の形態変化
健常人とSAC6ホモ接合型患者由来iPS細胞から分化誘導したプルキンエ細胞の形態変化。細胞全体に発現するプルキンエ細胞に特異的なマーカー(L7)を使用した。健常人由来のプルキンエ細胞ではT3の添加の有無に関わらず、細胞の形態に変化はなかった(上段左と左から二つ目の画像)。SCA6患者由来のプルキンエ細胞では培養液にT3を添加しなかった場合、樹状突起が太くなり、枝分かれの数が減少するなど異常な形態を示した(下段左から二つ目の画像)。甲状腺刺激ホルモン放出ホルモン(TRH)あるいは筋萎縮性側索硬化症の治療薬リルゾールを添加したところ、細胞の形態変化を抑制する作用が認められた(下段左から三つ目と右端の画像)。スケールバーは 200μm。
今後の期待
難治性疾患の患者の体細胞からiPS細胞を樹立し、それを疾患の目的細胞へと分化させ、病態を試験管内で再現することによって、発症に至る原因の解明や治療法の開発が可能になりつつあります。本研究では、これまでに開発されたプルキンエ細胞への分化誘導技術を患者由来iPS細胞に応用することで、SCA6特異的なプルキンエ細胞を作製し、病態を一部再現することに成功しました。また、今回、開発した疾患特異的な細胞の脆弱性の再現や、それらを緩和する薬剤について評価する系を構築しました。これにより、これまで不明だったSCA6の病態解明と創薬研究への道が開かれると期待できます。
また、本研究の手法はSCA6以外のさまざまな神経変性疾患にも応用が可能であると考えられ、今後の創薬研究の進展に貢献すると期待できます。
論文情報
- タイトル
- Vulnerability of Purkinje cells generated from spinocerebellar ataxia type 6 patient-derived iPS cells
- 著者名
- Yoshihito Ishida, Hideshi Kawakami, Hiroyuki Kitajima, Ayaka Nishiyama, Yoshiki Sasai, Haruhisa Inoue, and Keiko Muguruma
- 雑誌
- Cell Reports
- DOI
- 10.1016/j.celrep.2016.10.026
補足説明
- [1] 脊髄小脳変性症
- 運動失調を主症状とする神経変性疾患の総称。遺伝性と非遺伝性(孤発性)に分けられ、遺伝性が全体の約1/3を占める。遺伝性の中ではSCA3、SCA6、SCA31型が日本には多くみられる。SCA6型はプルキンエ細胞の脱落が選択的に引き起こされる。
- [2] プルキンエ細胞
- 小脳皮質での情報処理の中心的な神経細胞。脳の中でも特に大きな細胞体を持ち、広範囲に樹状突起を広げることにより、多くの神経情報を受け取り統合することが知られている。小脳皮質ではプルキンエ細胞層を形成し、細胞体が平面一列状に整列している。樹状突起は表面の分子層に伸ばし、軸索は白質を通って深部小脳核へと投射する。樹状突起では、入力神経線維である苔状線維と登上線維からの情報を受け取る。
- [3] リピート配列
- 生物ゲノムのDNAを構成する4種の塩基、アデニン(A)、グアニン(G)、シトシン(C)、チミン(T)の配列で、同じ配列が反復して(特に数回以上)みられるものの総称。真核生物、特に進化した動植物に多くみられる。反復配列ともいう。CAGリピート配列はシトシン、アデニン、グアニンの配列。
- [4] 多能性幹細胞
- 身体を構成するすべての種類の細胞に分化する能力(多能性)を持ち、未分化なまま試験管内で培養して無限に増やすことができる細胞。多能性を持っているため、体のさまざまな細胞に分化する能力があり、再生医療の材料として利用することが期待されている。ES細胞と同様に、皮膚細胞などの体細胞に遺伝子Oct3、Sox2、Klf4などを導入して初期化し、多能性を持たせたiPS細胞も人工的な多能性細胞である。
- [5] Ca2+チャネル、Cav2.1
- 神経細胞膜上には、Na+チャネル、K+チャネル、Ca2+チャネルなどのイオンチャネルが存在し、神経細胞の興奮・抑制などを司っている。Ca2+チャネルは神経細胞において多様な働きをする。ポア(イオンが通る穴)を形成する主要サブユニットのα1サブユニットと、その開閉などを制御するβ、γ、α2-δサブユニットからなる。α1サブユニットの種類により、L型(Cav1.1、 Cav1.2、Cav1.3、Cav1.4)、N型(Cav2.2)、R型(Cav2.3)、T型(Cav3.1、Cav3.2、Cav3.3)、本研究のP/Q型(Cav2.1)などに分類される。
- [6] 転写因子
- タンパク質の合成は、DNAを鋳型として、メッセンジャーRNA(mRNA)が転写され、このmRNAがリボソームで翻訳される反応である。転写因子は、DNAに対してその配列特異的に結合するタンパク質で、プロモーター、エンハンサー、リプレッサーなど転写を制御する領域に結合することで、RNAポリメラーゼによる遺伝子の転写を活性化あるいは不活性化する。
- [7] ポリグルタミン病
- シトシン(C)・アデニン(A)・グアニン(G)リピートが翻訳領域に存在すると、C・A・Gがグルタミンに翻訳されるため、グルタミン鎖(ポリグルタミン)が遺伝子産物に含まれる。ポリグルタミン病は、この遺伝子産物の伸長したポリグルタミンの毒性が発症に関与していると考えられている。ハンチントン病、球脊髄性筋萎縮症、遺伝性の脊髄小脳変性症(SCA1、2、3、6、7、17)、歯状核赤核淡蒼球ルイ体萎縮症(DRPLA)が、現在知られているポリグルタミン病である。
- [8] ホモ接合型、ヘテロ接合型
- ホモ接合型とは同じ対立遺伝子を持つもので、ヘテロ接合型とは違う対立遺伝子を持つものをいう。
- [9] 樹状突起
- 細胞体、軸索とともに神経細胞を構成する部分の一つ。細胞体から枝状に広がる複数の突起構造で、その表面は樹状突起棘と呼ばれる小さな突起で覆われており、軸索との間にシナプスを形成し、情報の交換を行う。中枢神経系の中でもプルキンエ細胞の樹状突起は非常に特徴的で、うちわを拡げたような形状をとるため、その形態だけで細胞の種類を同定できる特異な神経細胞である。
- [10] シストロン
- 遺伝子の機能単位のこと。一つのシストロンから1種類のポリペプチドが翻訳される。CACNA1A遺伝子は、内部リボソーム導入部位(IRES)を持つバイシストロニックmRNAを使って2種類の遺伝子発現が行われる特殊な例である。第一シストロンからはα1Aサブユニットが翻訳され、第二シストロンからは転写因子α1ACTが翻訳される。IRESとは、mRNAの5’末端キャップ構造とは無関係にリボソームが結合し、翻訳が開始されるヌクレオチド配列を指す。
お問い合わせ先
発表者
理化学研究所 多細胞システム形成研究センター
非対称細胞分裂研究チーム
客員研究員 石田 義人(いしだ よしひと)
専門職研究員 六車 恵子(むぐるま けいこ)
取材申し込み先
理化学研究所 多細胞システム形成研究推進室 広報担当
TEL:078-306-3310 FAX:078-306-3090
E-mail:cdb-pr“AT”cdb.riken.jp
機関窓口
理化学研究所 広報室 報道担当
TEL:048-467-9272 FAX:048-462-4715
E-mail:ex-press“AT”riken.jp
国立研究開発法人日本医療研究開発機構(AMED)
戦略推進部 再生医療研究課
〒100-0004 東京都千代田区大手町一丁目7番1号
TEL:03-6870-2220 FAX:03-6870-2242
E-mail:saisei“AT”amed.go.jp
※E-mailは上記アドレス“AT”の部分を@に変えてください。
掲載日 平成28年11月2日
最終更新日 平成28年11月2日


