プレスリリース ES細胞よりも分化が進んだ前駆細胞から特定の組織に限定したキメラを作製する手法の開発
プレスリリース
国立研究開発法人科学技術振興機構
発表者
正木 英樹 (東京大学医科学研究所附属幹細胞治療研究センター 幹細胞治療分野 助教)
発表のポイント
- 着床後の多能性状態にあるエピブラスト幹細胞(EpiSC、注1)は、着床前の胚に移植した場合にはキメラ(注2)を形成できないが、その原因として移植後に速やかに細胞死(アポトーシス、注3)が起こることが関係していることを見出した。
- 今回、EpiSCや、さらに分化の進んだ内胚葉系前駆細胞(注4)を用い、それらの細胞にアポトーシス阻害因子を強制発現させ、着床前の胚との間にキメラを形成させることに成功した。
- この成果は、ナイーブ型多能性幹細胞(注5)を用いなくてもキメラ動物作製が可能になること、前駆細胞を用いれば目的以外の臓器形成を回避できることから生命倫理的な懸念(注6)の解消につながることなど、動物体内でのヒト臓器作製の実現化に大きく貢献する。
発表概要
これまで中内教授らのグループはES細胞/iPS細胞からの動物体内での臓器作製に取り組んで来たが、今回の成果と組み合わせることで、ナイーブ型多能性幹細胞を用いなくてもキメラ動物作製が可能になる、目的以外の臓器形成を回避できることから生命倫理的な懸念の解消につながるなど、動物体内での移植可能なヒト臓器作製の実現可能性が大きく高まった。
本研究は、国立研究開発法人日本医療研究開発機構(AMED)の革新的先端研究開発支援事業インキュベートタイプ(LEAP)における研究開発課題「発生原理に基づく機能的立体臓器再生技術の開発」(研究開発代表者:中内啓光)ならびに国立研究開発法人科学技術振興機構(JST)の戦略的創造研究推進事業総括実施型研究(ERATO)中内幹細胞制御プロジェクト(研究総括:中内啓光、平成24年度終了)の一環として行われた。
本研究成果は11月3日付の科学雑誌Cell Stem Cellのオンライン版に掲載される。
発表内容
本共同研究チームは、着床後の多能性状態にあるEpiSCを着床前胚に移植し、移植細胞がアポトーシスによって排除されることを見出した。そこで、アポトーシス阻害因子を一過性に強制発現することによってアポトーシスを阻害したところ、マウスおよびラットのEpiSC、さらにより進んだ発生段階にあるマウス内胚葉系前駆細胞をマウスの着床前の胚に移植してもキメラ形成することが確認できた(図2)。これらのキメラ動物は移植細胞の発生運命に従ったキメラ状態を示し、EpiSCでつくられたキメラは全身の組織がキメラであったのに対し、内胚葉系前駆細胞でつくられたキメラでは内胚葉由来組織のみがキメラであった。
中内教授らの研究グループは胚盤胞補完法という技術を用いES細胞/iPS細胞からの動物体内での臓器作製に取り組んで来た。この方法を用いる際の大きな技術的障壁としては、着床前の胚と同じ発生段階にあるヒトナイーブ型多能性幹細胞が必要だと考えられてきたが、既報の樹立法は再現性に乏しいものがほとんどで、未だ評価の確立したヒトナイーブ型多能性幹細胞株が存在しないことがあった。また、仮にヒト―動物キメラが実現した場合にも、全身に分布したヒト多能性幹細胞からヒトの中枢神経系細胞や生殖細胞がつくられ得るという、生命倫理的な懸念も存在する。今回発見された「アポトーシス阻害によるキメラ形成促進」がヒト多能性幹細胞および前駆細胞にも応用できるようになれば、これらの課題を克服し、動物体内でのヒト臓器作製の実現に向け大きな前進となる。また、げっ歯類以外の動物種の多能性幹細胞に応用できるようになれば、遺伝子改変動物作製が難しい種においても、マウスと同等に容易に作製できるようになることが期待される。また、培養下で分化誘導された細胞が、生理的に充分かつ正常な機能・性質を有するかを生体内で評価する実験系としても重要であると想定される。
発表雑誌
- 雑誌名:
- Cell Stem Cell 11月3日付(日本時間11月4日)オンライン版
- 論文タイトル:
- Inhibition of apoptosis overcomes stage-related compatibility barriers to chimera formation in mouse embryos
- 著者:
- Hideki Masaki*, Megumi Kato-Itoh, Yusuke Takahashi, Ayumi Umino, Hideyuki Sato, Keiichi Ito, Ayaka Yanagida, Toshinobu Nishimura, Tomoyuki Yamaguchi, Masumi Hirabayashi, Takumi Era, Kyle M. Loh, Sean M. Wu, Irving L. Weissman, Hiromitsu Nakauchi*
お問い合わせ先
研究に関する問い合わせ先
助教 正木 英樹(マサキ ヒデキ)
東京都港区白金台4−6−1
Tel:03-5449-5129
E-mail:hmasaki“AT”ims.u-tokyo.ac.jp
AMED事業に関する問い合わせ先
戦略推進部 研究企画課
東京都千代田区大手町1−7−1 読売新聞ビル22階
TEL:03-6870-2224
E-mail:kenkyuk-ask“AT”amed.go.jp
JST事業に関する問い合わせ先
国立研究開発法人科学技術振興機構 研究プロジェクト推進部
大山 健志(オオヤマ タケシ)
東京都千代田区五番町7 K's五番町
Tel:03-3512-3528
E-mail:eratowww“AT”jst.go.jp
※E-mailは上記アドレス“AT”の部分を@に変えてください。
用語解説
- (注1)エピブラスト幹細胞(EpiSC):
- マウスまたはラットの着床後胚のエピブラストから樹立される多能性幹細胞。ヒトES細胞/iPS細胞に類似した性質を持つことから、同じ発生段階にあると想定されている。
- (注2)キメラ:
- ここでは着床前胚と移植された細胞が発生プロセスを経て協調的に個体を形成することを指す。移植された細胞に由来する細胞と着床前胚由来細胞はパッチ状に分布するのであって、細胞同士が融合するのではない。
- (注3)アポトーシス:
- 細胞死の一種で、外部刺激などにより積極的に引き起こされる、プログラムされた細胞死のこと。
- (注4)内胚葉系前駆細胞:
- 内胚葉系前駆細胞は腸管や卵黄嚢になる細胞であり、Sox17を発現する。本研究においては、Sox17のレポーターシステムを組み込んだES細胞を培養下で分化誘導し、Sox17を発現している細胞を使用した。
- (注5)ナイーブ型多能性幹細胞:
- X染色体が二本とも活性化している、特有の遺伝子発現プロファイルを示す等、着床前段階の多能性細胞である内部細胞塊(ICM)の特徴を有する多能性幹細胞を指す。代表例はげっ歯類のES細胞/iPS細胞。
- (注6)生命倫理的な懸念:
- ヒト細胞を動物胚に移植したものを動物性集合胚と呼ぶ。国内では米英を含む諸外国に比較して厳格な規制が行われており、動物性集合胚は培養下で最長14日間または原腸陥入期までの発生のみが認められている。ヒト多能性幹細胞の多能性評価法や、生体内で機能的組織・臓器を作製する等の目的で注目されているが、一方で、動物体内で生殖細胞や中枢神経細胞が形成されることは避けるのが望ましいというのが現時点でのコンセンサスである。
添付資料
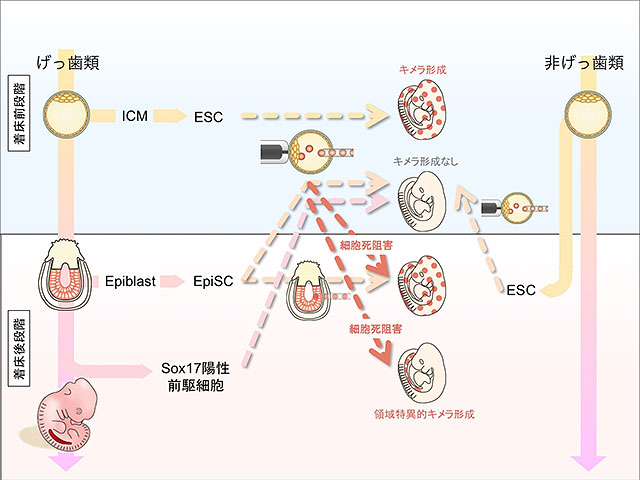
図1. 本研究の概略図。非げっ歯類のES細胞(ESC)に相当するエピブラスト幹細胞(EpiSC)は、着床前胚に移植してもキメラ形成できないが、細胞死を阻害して移植細胞を生存させるとキメラ形成が可能になる。さらに発生が進行し多能性を有さない、Sox17を発現する内胚葉系前駆細胞(Sox17陽性前駆細胞)においても、細胞死阻害によって発生運命に従った内胚葉由来組織に限定されたキメラ形成が可能になる。破線は着床前胚に移植した結果を示す。
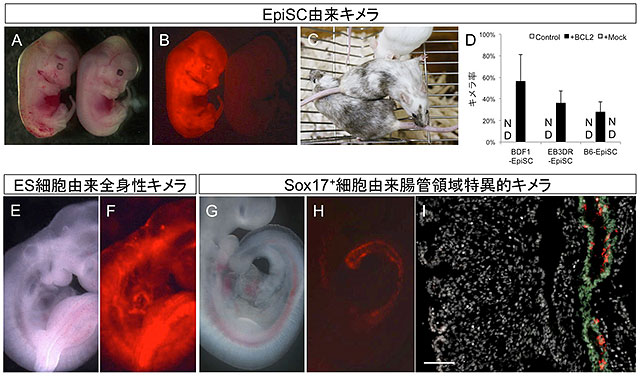
図2. ES細胞よりも分化が進んだ前駆細胞を細胞死阻害することにより形成されたキメラ個体。(A)-(D)はマウスEpiSCとマウス着床前胚から作製されたキメラマウスについての結果、(G)-(I)はマウスSox17陽性内胚葉系前駆細胞から作製されたキメラマウス、(E, F)は比較対象としてES細胞から作製されたキメラマウスを示す。(A, C, E, G)は明視野像、(B, F, H)は蛍光像である。移植したEpiSCおよびSox17陽性内胚葉系前駆細胞に由来する細胞は赤色蛍光を呈する。一過性に細胞死阻害処理を施されたEpiSCはキメラを形成し(A, B)、EpiSC由来キメラマウスは成体まで成長する(C)。EpiSC由来キメラ個体は部分的に黒色の毛色を呈する。細胞死阻害処理しなかったEpiSCからはキメラは得られなかった(D)。BCL2は細胞死阻害のために強制発現させた抗アポトーシス因子である。NDはキメラ率が0%であったことを示す。ES細胞由来のキメラ個体は全身がキメラになるが(E, F)、Sox17陽性前駆細胞由来のキメラ個体は腸管のみがキメラであった(G, H)。(I)はこの胎仔から作製した組織切片像。緑が腸管細胞、赤が移植されたSox17陽性細胞由来の細胞、白が視野にある全ての細胞の核(腸管細胞とそれ以外の細胞)を示す。移植された細胞は腸管以外の領域には分布していないことが確認できる。白線は長さ100μmを示す。
関連リンク
掲載日 平成28年11月4日
最終更新日 平成28年11月4日


